
心肺复苏中超声引导动脉穿刺成功1例
作者:刘天柱,代金贞,华中科技大学同济医学院附属同济医院麻醉学教研室
1.临床资料
患者,女,54岁,体重49kg,身高163cm,因“门静脉高压症 ,脾亢,肝硬化失代偿期”入院,ASAⅢ级。既往有乙型病毒性肝炎病史20余年,口服恩替卡韦
,脾亢,肝硬化失代偿期”入院,ASAⅢ级。既往有乙型病毒性肝炎病史20余年,口服恩替卡韦 0.5mg每日1次。无高血压、糖尿病、冠心病史。入院辅助检查血小板29×109/L,PT16s,INR1.30;AST78U/L,AST143U/L;TB140.2μmol/L,CB109.7μmol/L,UCB30.5μmol/L。
0.5mg每日1次。无高血压、糖尿病、冠心病史。入院辅助检查血小板29×109/L,PT16s,INR1.30;AST78U/L,AST143U/L;TB140.2μmol/L,CB109.7μmol/L,UCB30.5μmol/L。
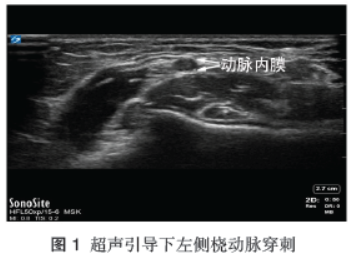
检查提示肝硬化,食管胃底静脉曲张,脾大 ;拟全麻下行“脾切除术+贲门周围血管离断术”,余检查基本正常。麻醉经过:入室后常规监测ECG、SpO2、无创血压、体温。诱导前扫查左手肱,见图1、桡动脉,并于左侧桡动脉穿刺并置管,监测有创动脉压及血气(pH7.458、PaCO2 33.8mmHg、PaO2 85mmHg、Hb124g/L,K+4.05mmol/L、Glu7.20mmol/L,BE-16mmol/L,Lac0.6mmol/L)。
;拟全麻下行“脾切除术+贲门周围血管离断术”,余检查基本正常。麻醉经过:入室后常规监测ECG、SpO2、无创血压、体温。诱导前扫查左手肱,见图1、桡动脉,并于左侧桡动脉穿刺并置管,监测有创动脉压及血气(pH7.458、PaCO2 33.8mmHg、PaO2 85mmHg、Hb124g/L,K+4.05mmol/L、Glu7.20mmol/L,BE-16mmol/L,Lac0.6mmol/L)。
静脉给予0.5mg咪唑安定、芬太尼0.1mg、依托咪酯 12mg、罗库溴铵
12mg、罗库溴铵 40mg进行麻醉诱导。气管导管插入顺利,机械通气
40mg进行麻醉诱导。气管导管插入顺利,机械通气 (VT400mL,RR12次/min,I∶E=1∶2,Paw17cmH2O)。以丙泊酚
(VT400mL,RR12次/min,I∶E=1∶2,Paw17cmH2O)。以丙泊酚 3mg/kg/h、瑞芬太尼
3mg/kg/h、瑞芬太尼 0.1μg/kg/min持续泵入、复合七氟醚1.5%~2.5%吸入维持麻醉,间断静脉注射罗库溴铵10mg维持麻醉。
0.1μg/kg/min持续泵入、复合七氟醚1.5%~2.5%吸入维持麻醉,间断静脉注射罗库溴铵10mg维持麻醉。
二氧化碳气腹后调整通气参数VT400mL,RR15次/min,I∶E=1∶1.5,Paw22cmH2O。手术进行至2h左右突然发生术中大出血,血压骤降,立即加快输液速度,同时开放多路静脉通路,并给予库血红细胞2.5U快速输注,急查血气分析示pH7.258,PaCO2 33.1mmHg,PaO2 160mmHg,Hb8.7g/L,K+未测出,Glu12.64mmol/L,BE-16mmol/L,Lac1.4mmol/L;立即给予患者维持血压、纠酸、快速输血 补液等综合处置。
补液等综合处置。
半小时后术中出血依旧无法控制,低血压无法纠正,大出血39min时患者突发室颤,立即开始持续胸外按压,冰帽脑保护,给予患者120J双向非同步除颤1次,恢复自主心律,3min后再次转为无脉性室速,间断行120J除颤3次,未恢复窦性心律,此时左侧桡动脉无有效压力波形,考虑置管脱出,重新于超声引导下左、右侧股动脉穿刺置管,均失败,更换超声设备后于右侧肱动脉穿刺成功,见图2。
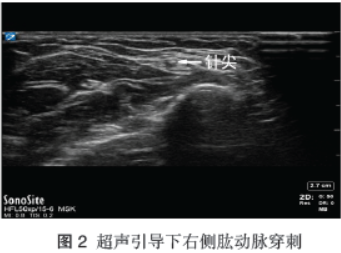
再次行血气分析pH7.222,PaCO2 66.3mmHg,PaO2 22.5mmHg,Hb8.5g/L,K+9.38mmol/L,Glu12.20mmol/L,BE-0.4mmol/L,Lac测不出。继续给予输血、补液、纠酸,积极处理严重高血钾(间断推注钙剂、胰岛素 10U缓慢推注、呋塞米
10U缓慢推注、呋塞米 20mg推注),12min后再次行血气分析pH7.308,PaCO269.7mmHg,PaO2303.6mmHg,Hb5.9g/L,K+6.07mmol/L,Glu9.68mmol/L,BE8.8mmol/L,Lac测不出,此时160J除颤1次后恢复自主心律,大剂量泵注去甲肾上腺素
20mg推注),12min后再次行血气分析pH7.308,PaCO269.7mmHg,PaO2303.6mmHg,Hb5.9g/L,K+6.07mmol/L,Glu9.68mmol/L,BE8.8mmol/L,Lac测不出,此时160J除颤1次后恢复自主心律,大剂量泵注去甲肾上腺素 (0.30μg/kg/min)及肾上腺素(0.15μg/kg/min)可维持平均动脉压50~70mmHg。嘱手术医生纱布填塞止血后关腹送入ICU进一步治疗。
(0.30μg/kg/min)及肾上腺素(0.15μg/kg/min)可维持平均动脉压50~70mmHg。嘱手术医生纱布填塞止血后关腹送入ICU进一步治疗。
2.讨论
直接动脉测压是目前公认的动脉血压监测的参考标准。相比于无创血压来说,有创动脉压力测量能更敏感地了解患者围术期血压的变化情况,方便麻醉医生尽可能早地处理围术期各种原因导致的血压波动。尤其在诱导期和苏醒期,短时间内血压变化幅度大,常规的无创袖带测量相对滞后,对于血压变化不能及时识别和处理,增加了围术期血压剧烈波动相关并发症的发生率。随着对直接动脉压力波形分析研究的深入,动脉压力波形的变化同样也可以为评估患者血容量、液体丢失速度等提供有效依据。
动脉穿刺置管成功后可以反复采集动脉血样进行动脉血气监测,可以全面了解患者的呼吸功能,发现和准确识别低氧血症和高碳酸血症,为及时正确处理围术期电解质紊乱和酸碱失衡提供依据,目前血气分析仪同时也提供血红蛋白 测定、血糖测定
测定、血糖测定 、乳酸测定等检测项目,通过这些检测,我们可以及时发现患者是否出现贫血
、乳酸测定等检测项目,通过这些检测,我们可以及时发现患者是否出现贫血 、低血糖及组织氧供不足等异常情况,为临床麻醉决策提供科学依据。
、低血糖及组织氧供不足等异常情况,为临床麻醉决策提供科学依据。
常规的血氧饱和度监测易受肢体温、血管硬化、末梢循环低灌注、氧饱和度测量夹型号等的干扰,SpO2测量值与实际值常常出现偏差,脉搏 波形漂移、波幅窄、脉搏信号不稳定,这种不稳定可以通过脉搏灌注指数(perfusion index,PI)来识别;而解决这种问题的最好办法便是进行直接有创动脉压力监测。有研究表明,在患者休克或心搏停止时,利用有创动脉压指导的胸外心脏按压效果往往比较好,复苏质量更佳。
波形漂移、波幅窄、脉搏信号不稳定,这种不稳定可以通过脉搏灌注指数(perfusion index,PI)来识别;而解决这种问题的最好办法便是进行直接有创动脉压力监测。有研究表明,在患者休克或心搏停止时,利用有创动脉压指导的胸外心脏按压效果往往比较好,复苏质量更佳。
该案例中,尽管复苏时间超过半小时,但我们通过高效的团队协作,及时重建有创动脉压力监测,指导我们进行了有效的心肺复苏,使整个复苏过程患者的平均动脉压维持≥50mmHg,为后来的成功复苏奠定了基础。超声可视化让麻醉医生有了一双“慧眼”,能够快速准确识别动脉的粗细、位置及走形情况。
目前常用的超声引导下动脉穿刺置管技术主要有两种:①长轴平面内技术,该技术适合于动脉直径较粗,走行较平直的动脉血管,穿刺全程都可在超声下识别,可清晰看到血管及针的走向及位置关系;②短轴平面外技术,对于一些直径较细,走形弯曲的动脉,该技术能实时追踪针尖与血管的位置,动态观察针尖的走向,方便调整进针方向始终位于血管管腔正中,提高穿刺成功率。
无论采用哪种方法,前提都应了解超声成像的原理及基础知识,不仅要根据动脉的深度选择合适的超声探头,根据不同组织结构的回声特点选择合适的模式,也要及时调整聚焦声场的位置,使穿刺针与目标的超声图像更清晰。心搏骤停后需要立即进行心肺复苏,不间断的胸外按压使患者肘部发生牵涉运动,此时进行动脉穿刺往往难度较大,笔者的经验为让一助手帮助固定穿刺侧肢体,利用肩关节、肘关节等的关节活动度来尽可能地减少肢体运动,同时应注意避开穿刺目标的近心端动脉,避免远端动脉受压导致血流减缓或暂停,增加识别及穿刺难度。
手术室内心肺复苏往往启动迅速,原有的动静脉置管尽管进行了妥善固定,在多人心肺复苏时仍有可能因为体位 ,按压等因素致使导管脱出管腔;动脉距离体表的纵向深度越深,意味着进入血管管腔的导管长度越短,轻微的皮肤移位即可能导致导管脱出。心搏骤停后,心泵作用消失,体循环血液瘀滞,代谢产物不断积聚,双重打击使得全身动脉痉挛无搏动,传统触摸盲法动脉穿刺不可行。
,按压等因素致使导管脱出管腔;动脉距离体表的纵向深度越深,意味着进入血管管腔的导管长度越短,轻微的皮肤移位即可能导致导管脱出。心搏骤停后,心泵作用消失,体循环血液瘀滞,代谢产物不断积聚,双重打击使得全身动脉痉挛无搏动,传统触摸盲法动脉穿刺不可行。
超声可视化能够为我们提供动脉的确切位置,但是剧烈萎缩的管腔空间加剧了穿刺的难度。本案例中,患者由于术中大出血导致的严重低血容量进一步使动脉管腔狭窄,因此有效的容量复苏对于穿刺成功也起到了重要作用。除此之外,超声分辨率也是穿刺成功率的重要影响因素,超声的分辨率越低,对于针尖及动脉内膜的成像就越差,尤其对于有动脉血管硬化、反复穿刺后血肿形成或者动脉内膜夹层形成的患者来说,较高的超声分辨率意味着较高的穿刺成功率。
在两次股动脉穿刺失败后,笔者总结经验教训,及时更换分辨率更高的超声设备,并选取右侧肱动脉作为穿刺目标,采用动态针尖法,于肱动脉浅层和深层内膜之间置入套管针,退针芯后可见回血,置管成功。该案例经过40多分钟的抢救最终成功复苏,团队协作起到了不可忽视的作用。
另外,在抢救过程中,麻醉医生应时刻保持头脑清醒,选择熟悉、合适的设备,尽快建立有创动脉血压监测,通过动脉血气检测,快速明确患者心搏骤停的原因,有针对性地进行复苏,同时应注意复苏期间其他脏器功能的保护,尽可能缩短心搏骤停的持续时间,为后续的脑复苏 及综合复苏后治疗赢得宝贵时间。
及综合复苏后治疗赢得宝贵时间。
来源:刘天柱,代金贞. 心肺复苏中超声引导动脉穿刺成功1例[J]. 中国急救复苏与灾害医学杂志,2021(1).
