
肿瘤电场治疗应用胶质母细胞瘤1例
作者:张卫东,张晓东,靳梦瑶,蒿玉兴,袁启友,安徽医科大学第一附属医院神经外科
胶质母细胞瘤 (glioblastoma,GBM)在原发性脑恶性肿瘤中占45.6%,GBM的发病率与年龄相关,随着年龄的增长,儿童的发病率为0.15/100000,到75~84岁老年人的发病率达到峰值,为15.03/100000。GBM的标准治疗方案(Stupp方案)为手术联合术后同步放化疗及辅助化疗,但预后非常差。总生存期(overall survival,OS)1年<30%,3年<5%,5年<3%,且男女无差别。
(glioblastoma,GBM)在原发性脑恶性肿瘤中占45.6%,GBM的发病率与年龄相关,随着年龄的增长,儿童的发病率为0.15/100000,到75~84岁老年人的发病率达到峰值,为15.03/100000。GBM的标准治疗方案(Stupp方案)为手术联合术后同步放化疗及辅助化疗,但预后非常差。总生存期(overall survival,OS)1年<30%,3年<5%,5年<3%,且男女无差别。
在2019年3月发布的《中国脑胶质瘤诊疗规范》中,首次将肿瘤电场治疗(tumor treating fields,TTFields)加入诊疗方案中。Stupp基础上联合TTFields患者的总生存期(OS)和无进展生存期(progression-free survival,PFS)显著延长。本文主要针对1例GBM患者行Stupp方案联合TTFields精准治疗进行讨论,提高医务人员对于TTFields治疗的理解和认识,现报道如下。
1.资料与方法
1.1临床资料
患者,女,68岁。系“头晕头痛 半月余”入院。2020年10月13日就诊于安徽医科大学第一附属医院,行头颅MRI提示:右侧顶枕叶异常信号,考虑胶质母细胞瘤;头颅MRS示:病灶区Cho峰升高,NAA峰下降;头颅ASL示:病灶区灌注较对侧升高。见图1。
半月余”入院。2020年10月13日就诊于安徽医科大学第一附属医院,行头颅MRI提示:右侧顶枕叶异常信号,考虑胶质母细胞瘤;头颅MRS示:病灶区Cho峰升高,NAA峰下降;头颅ASL示:病灶区灌注较对侧升高。见图1。
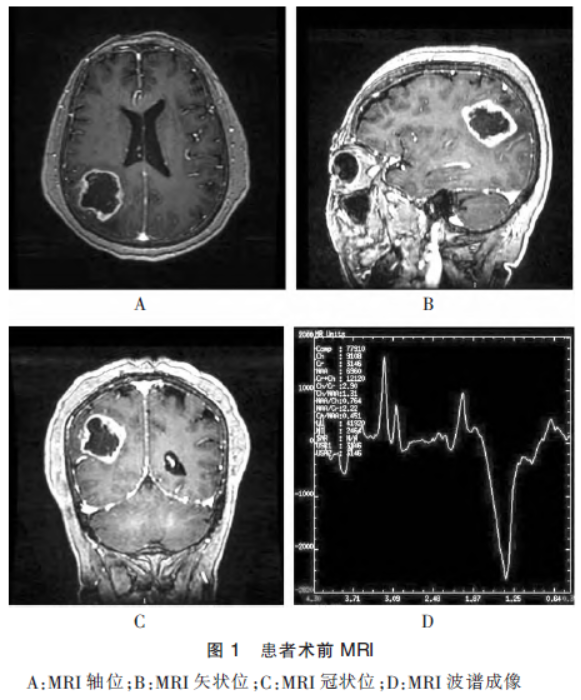
1.2方法
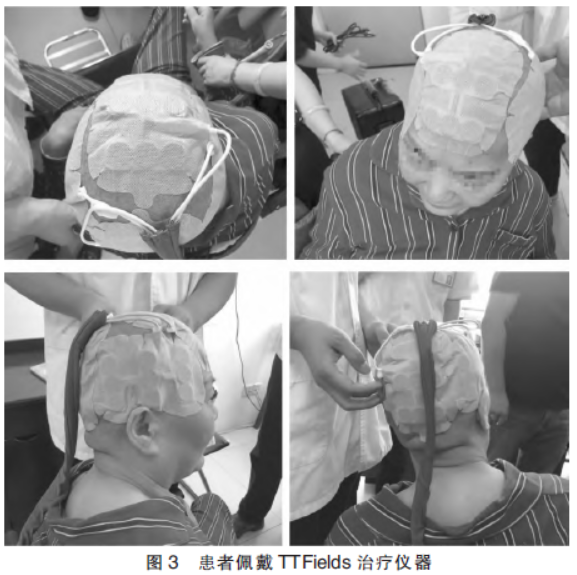
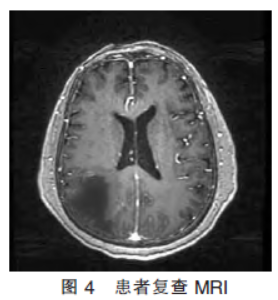
术前完善相关检查,未见手术禁忌证,于2020年10月24日行手术治疗。术后病理(图2)提示:高级别胶质瘤(胶质母细胞瘤,WHOⅣ级)。明确病理性质后立即行胶质母细胞瘤床区“IMRT放射治疗,DT:60Gy/29F”;同步予以“替莫唑胺 140mgD1-5”方案同步化疗。现患者术后半年余,规律行“替莫唑胺化疗”同步TTFields治疗(图3)。持续随访中,2021年4月23日复查头颅MRI(图4)未见肿瘤复发。
140mgD1-5”方案同步化疗。现患者术后半年余,规律行“替莫唑胺化疗”同步TTFields治疗(图3)。持续随访中,2021年4月23日复查头颅MRI(图4)未见肿瘤复发。

2.讨论
GBM在星形细胞肿瘤中恶性程度最高,由低分化的肿瘤性星型胶质细胞组成。它的临床进程取决于肿瘤的位置和在脑内的扩散动力学情况。同时组织破坏,水肿 和癫痫
和癫痫 也会导致部分患者病情迅速恶化。手术是GBM的首要治疗方式,手术的目标是完全切除。然而,由于GBM的浸润性,完全切除几乎不可能,复发不可避免。因此对于绝大多数患者,进行大体积的颅内减压以及随后的脑减压来减轻颅内压(intracranial pressure,ICP)是唯一可行的方案,其目的主要在于提高生活质量,并可能延长生存期。术后放疗现在是GBM的标准辅助治疗。
也会导致部分患者病情迅速恶化。手术是GBM的首要治疗方式,手术的目标是完全切除。然而,由于GBM的浸润性,完全切除几乎不可能,复发不可避免。因此对于绝大多数患者,进行大体积的颅内减压以及随后的脑减压来减轻颅内压(intracranial pressure,ICP)是唯一可行的方案,其目的主要在于提高生活质量,并可能延长生存期。术后放疗现在是GBM的标准辅助治疗。
放射治疗必须在手术后6周内开始,对于几乎所有GBM患者是必须的。对于MGMT启动子高甲基化的GBM患者,术后替莫唑胺化疗是有效的治疗方案,即“Stupp方案”。虽然Stupp方案是治疗GBM的标准治疗方案,但预后极不乐观。TTFields的出现为GBM的治疗提供了一个全新选择,它代表了一种新兴的非侵入性抗癌治疗模式,并在GBM的治疗中显示出了良好的疗效和安全性,同时,由于肿瘤的嗜脑性,通常不会发生远处转移,所以TTFields特别适合GBM患者。
TTFields是将绝缘的电极片贴附于肿瘤周围的皮肤,利用一次性传感器阵列所提供的低强度(1~3V/cm)、中频(100~300kHz)、交变电场,干扰负责有丝分裂关键过程的带电大分子和细胞器,这些细胞成分的结构变化或错位会改变它们的生理功能,并最终破坏正常的有丝分裂,抑制肿瘤细胞的生长,导致肿瘤细胞的凋亡,进而达到治疗的目的。但对静止的细胞没有作用。同时处于有丝分裂期的肿瘤细胞在TTFields的作用下导致免疫反应的激活,触发免疫源性细胞死亡,这是一种高度炎症性的细胞程序性死亡。
此外,TTFields已被证明能够通过诱导更具黏附性的细胞表型来抑制细胞迁移和侵袭。这是通过与上皮间质转化相关的细胞骨架结构和蛋白质的失调来实现的(如肌动蛋白、波形蛋白和钙黏蛋白),这可能会降低复发或转移的可能性。最后,血管生成是肿瘤生长和进展的关键,TTFields通过诱导VEGF和缺氧因子1-ɑ调节通路来损害血管的生成,从而确定了与抗血管生成药物(如贝伐珠单抗 、头孢拉尼、恩扎托林和舒尼替尼
、头孢拉尼、恩扎托林和舒尼替尼 )的潜在协同作用。研究表明,TTFields的抗肿瘤作用具有强度和频率依赖性,与化疗具有相加或协同作用。
)的潜在协同作用。研究表明,TTFields的抗肿瘤作用具有强度和频率依赖性,与化疗具有相加或协同作用。
GBM患者行手术切除联合术后放化疗后再行TTFields联合替莫唑胺化疗,PFS和OS显著延长。TTFields联合替莫唑胺化疗的具体机制尚未明确,其潜在机制可能:①TTFields联合替莫唑胺化疗可降低GBM患者对替莫唑胺的耐药性、减少肿瘤细胞的数量、抑制肿瘤再生;②TTFields联合替莫唑胺化疗可协同杀伤肿瘤细胞;③TTFields与替莫唑胺化疗联用无叠加的毒性效应。
GBM行肿瘤电场治疗的患者,必须每隔3~4d剃一次头,保持传感器阵列于患者头部之间的最佳耦合,只有设备开启的时候才有抗有丝分裂作用,治疗参数是在设备中预先设置的,因此不需要患者或医生进行调整。同时鼓励患者每天至少保持设备使用时间为18h,并根据个人需要(如淋浴)进行短暂的休息,患者在治疗过程中日常活动基本不受限。研究表明,接受TTFields治疗≥18h/d的患者相较于<18h/d的患者,其中位总生存期明显延长。
轻到中度接触性皮炎是设备使用引起的最常见的不良事件,局部使用皮质类固醇或抗菌治疗、定期更换传感器阵列即可改善这种不良反应,多项临床试验均未报告近几年来接受治疗的研究患者发生重大TTFields相关不良事件,表明患者对TTFields的耐受性良好。TTFields为GBM患者的治疗提供了新选择,带来了新希望,是一种无创的癌症治疗方法。TTFields在GBM患者中的疗效和耐受性已经FDA批准用于新诊断和复发性疾病。TTFields的新颖性、有效性和低毒性被美国临床肿瘤学会(ASCO)认为是人类癌症治疗的巨大进步。
在未来,TTFields将继续扩大其使用范围,包括以前未被研究的实体肿瘤。然而,由于大多数接受TTFields治疗的GBM患者最终死于肿瘤的扩散。目前,提高TTFields疗效的方案包括修改所应用的强度和频率,以及进一步优化阵列布局。因此,要充分了解TTFields在实体肿瘤中的作用以及如何最大限度地提高其对患者的益处,仍需做大量工作。
来源:张卫东,张晓东,靳梦瑶,蒿玉兴,袁启友.肿瘤电场治疗应用胶质母细胞瘤1例[J].中国现代医生,2022,60(02):145-147.
