
老年急性腹泻、便血、发热患者,溃疡性结肠炎or感染性肠炎?
作者:镜桨 广州医科大学附属第一医院
本文为作者授权医脉通发布,未经授权请勿转载。
病例资料
患者,男性,66岁,因“腹泻 4周,加重伴发热
4周,加重伴发热 、便血3周”入院。
、便血3周”入院。
患者于2020年4月11日因混合痔于外院行“齿状线上直肠黏膜套扎术”,术后腹泻,10余次/日,每次量少,为深褐色稀糊样,无黏液脓血,无里急后重、便失禁或排便困难。2020年4月20日进食半熟腌鸡蛋后发热,Tmax38.5℃,便次增多至20次/日,伴少量便血、里急后重、乏力、食欲减退、体重下降。外院予头孢克洛 (375mg bid)口服治疗1周,继而左氧氟沙星
(375mg bid)口服治疗1周,继而左氧氟沙星 (0.5g qd)口服治疗5天,症状无改善。
(0.5g qd)口服治疗5天,症状无改善。
血常规 :WBC 8.17x109/L,NEUT% 63.7%,Hb 132g/L;粪便常规示WBC 20~30/HPF,RBC大量/HPF;肝肾功能大致正常;CRP 49.6mg/L,ESR 21mm/h;CEA 28.63ng/ml,CA19-9 59.17U/ml,AFP、NSE、PSA正常;PCT 0.154ng/ml;T-SPOT.TB(A+B)186SFC/106MC;结核抗体、CMV-IgM、EBV-IgM 阴性。
:WBC 8.17x109/L,NEUT% 63.7%,Hb 132g/L;粪便常规示WBC 20~30/HPF,RBC大量/HPF;肝肾功能大致正常;CRP 49.6mg/L,ESR 21mm/h;CEA 28.63ng/ml,CA19-9 59.17U/ml,AFP、NSE、PSA正常;PCT 0.154ng/ml;T-SPOT.TB(A+B)186SFC/106MC;结核抗体、CMV-IgM、EBV-IgM 阴性。
结肠镜:末段回肠黏膜偏粗糙,全结肠黏膜弥漫充血、水肿 、糜烂,覆脓苔,血管纹理紊乱模糊;活检病理:黏膜组织急性及慢性炎、隐窝脓肿。
、糜烂,覆脓苔,血管纹理紊乱模糊;活检病理:黏膜组织急性及慢性炎、隐窝脓肿。
考虑“溃疡性结肠炎 可能”,加用美沙拉秦(1.5g tid)口服,美沙拉秦栓
可能”,加用美沙拉秦(1.5g tid)口服,美沙拉秦栓 剂置肛(1.0g qd);继续头孢克洛(375mg bid)口服治疗1周,症状无好转,更换为头孢他啶
剂置肛(1.0g qd);继续头孢克洛(375mg bid)口服治疗1周,症状无好转,更换为头孢他啶 (1g tid)静脉滴注,2天后Tmax降至37.5℃,便次无改善,未再继续治疗,拟加用泼尼松
(1g tid)静脉滴注,2天后Tmax降至37.5℃,便次无改善,未再继续治疗,拟加用泼尼松 。
。
既往史:高血压病史,胃穿孔修复术后,长期大量吸烟、饮酒史。
体格检查:BMI 23.18kg/m2。双肺呼吸音清,未闻及干、湿哕音,心律齐,腹平软,下腹部、左上腹压痛,无反跳痛、肌紧张,肠鸣音 2~3次/分,直肠指检
2~3次/分,直肠指检 未见异常。
未见异常。
入院诊断:腹泻、便血原因待查。
诊疗思考:患者是否可以诊断为UC?
病例特点:老年男性,急性病程。临床症状分为两个阶段:①病初10余日表现为腹泻、便次增多,无脓血。②可疑不洁饮食后出现发热、黏液血便,粪便常规中可见大量红、白细胞,炎症指标升高,肿瘤标志物CEA、CA19-9 水平升高;外院曾予抗感染治疗,热峰有所下降(Tmax 37.5℃),但腹泻改善不明显。诊断方面,患者第一阶段症状符合肛门刺激表现,不除外手术相关。第二阶段出现发热、黏液脓血便,结肠镜下可见结肠溃疡。
外院考虑诊断溃疡性结肠炎(ulcerative coliti,UC),此诊断是否正确?
针对该患者分析如下:
①其病程尚短(<6 周),病前有不洁饮食的诱因,病程中合并发热,抗感染治疗后热峰下降,故而将感染性肠炎放在首位更为合理,入院后可进一步完善血常规、血液/粪便病原学筛查、PCT、肥达试验、外斐反应等。
②UC:UC的诊断需要结合临床、内镜、病理综合分析,该患者有以下几点不支持UC诊断:病程不足6周,发病前有明确的不洁饮食史,病理未提示隐窝结构改变等慢性病变。当然,有些老年人症状不典型,尚需除外既往有UC,而此次是在UC基础上合并感染所致,可复查结肠镜并完善结肠黏膜活检病理辅助诊断。
③肿瘤:患者老年男性,体重下降,CEA、CA19-9水平明显升高,需要警惕胃肠道肿瘤可能,可复查肿瘤标志物,同时完善结肠黏膜活检病理、必要时行PET-CT。
④缺血性结肠炎:患者老年男性,有高血压、冠心病等危险因素,故缺血性肠病不能除外。该病通常以左半结肠受累为主,内镜下可见受累血管供血部位分界清晰的节段性病变,CTA或造影见明确血管狭窄或堵塞为确诊依据。该患者病变范围过广,病变与正常黏膜间未见清晰界限,证据不足,必要时可行腹盆CTA评估。
入院后完善检查
血常规:WBC 7.77x109/L,NEUT% 42.6%,Hb 112g/L;肝肾功能大致正常,甲状腺功能正常;hs-CRP 24.33mg/L,ESR 26mm/h;免疫球蛋白、补体、RF正常;ANCA阳性(P1:40);CEA 13.98ng/ml,CA19-9 61.6U/ml。
粪便常规:褐色糊便,WBC满视野,RBC5~10/HPF,OB (+),苏丹皿染色(-),抗酸染色、寄生虫及幼虫鉴定(-);PCT (仪器法)0.11ng/ml;血培养 :多枝梭菌,含溶血素厌氧瓶8小时;T-SPOT.TB:(A+B)192SFC/106MC;G试验:49.60pg/ml;肥达试验、外斐反应(-);CMV-IgM (-),CMV DNA和EBV DNA均<500copies/ml;HBV DNA<103copies/ml。
:多枝梭菌,含溶血素厌氧瓶8小时;T-SPOT.TB:(A+B)192SFC/106MC;G试验:49.60pg/ml;肥达试验、外斐反应(-);CMV-IgM (-),CMV DNA和EBV DNA均<500copies/ml;HBV DNA<103copies/ml。
因患者病情较重,故行直乙镜检查:进镜20cm至乙状结肠,所见结肠黏膜弥漫性充血水肿,血管纹理消失,可见小点、片状糜烂和不规则溃疡,脓性分泌物附着(图1)。
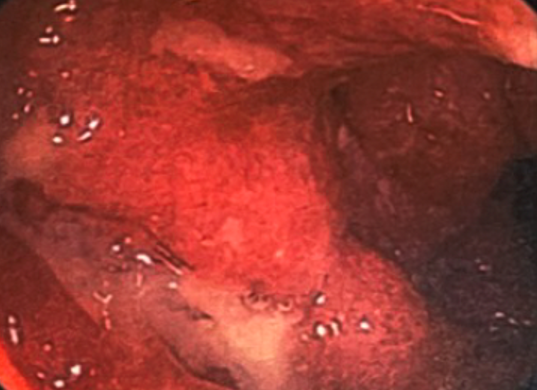
图1 直乙镜检查
活检病理:(直乙交界)结肠黏膜显急性及慢性炎,隐窝结构紊乱,可见隐窝炎及隐窝脓肿,病变示慢性活动性肠炎;原位杂交结果:CMVISH (-),EBER ISH (-);肠黏膜组织细菌涂片 :革兰阴性杆菌偶见;肠黏膜组织细菌培养:大肠埃希菌,粪肠球菌;真菌涂片、抗酸染色、诺卡菌涂片(-)。
:革兰阴性杆菌偶见;肠黏膜组织细菌培养:大肠埃希菌,粪肠球菌;真菌涂片、抗酸染色、诺卡菌涂片(-)。
诊疗思考:肠道细菌感染是否成立?
结合患者临床特点和血培养结果,多枝梭菌感染明确。多枝梭菌是梭茵属的一种,一类产芽胞、革兰阳性杆菌,在废弃物、土壤、植被以及哺乳动物的胃肠道中均有分布。该菌可见于85%正常人肠道菌群,但在儿童、老年人或原发/继发性免疫缺陷人群中可引起肠道感染,出现腹泻、便血等症状。其他肠道感染常见病原体如伤寒杆菌、CMV、难辨梭菌等目前暂无证据。
肠道细菌感染的辅助检查手段包括:抗原/抗体检测(血标本、粪便标本等),病原体培养(血标本、粪便标本、肠黏膜组织标本等)和肠道黏膜组织病理学检查和组织特殊染色。针对该患者,我们完善相关检查后结合血培养结果,多枝梭菌感染明确。
治疗
予头孢他啶1g q8h+甲硝唑 0.5g q12h静脉滴注抗感染,同时美沙拉秦1g qid口服,次日起患者体温恢复正常,便次逐渐减少至2~3次/日,黄色稀糊样,无黏液脓血。2个月后(2020年7月12日)复查结肠镜提示黏膜愈合,遗留瘢痕性改变(图2),病理见黏膜慢性炎及隐窝结构改变。复查肿瘤标志物水平降至正常。
0.5g q12h静脉滴注抗感染,同时美沙拉秦1g qid口服,次日起患者体温恢复正常,便次逐渐减少至2~3次/日,黄色稀糊样,无黏液脓血。2个月后(2020年7月12日)复查结肠镜提示黏膜愈合,遗留瘢痕性改变(图2),病理见黏膜慢性炎及隐窝结构改变。复查肿瘤标志物水平降至正常。
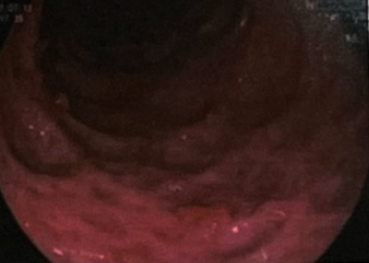
图2 复查结肠镜
诊疗思考:初发型UC与肠道感染的鉴别诊断思路
该患者经抗感染治疗,联合美沙拉秦1g qid 口服,治疗2个月后症状缓解,复查结肠镜见黏膜愈合,肿瘤标志物水平降至正常,故暂无肿瘤证据,感染性结肠炎诊断明确。但结肠活检病理提示慢性损伤、隐窝结构改变,感染性肠炎是否能否解释所有病情?
UC是以局限在黏膜内的结构扭曲和炎性细胞浸润为特点的慢性过程。其显微镜下诊断基于以下改变:广泛的隐窝结构异常(弥漫性隐窝不规则),重度的隐窝密度减少或萎缩,黏膜表面不规则,弥漫性伴有基底浆细胞 增多的全黏膜炎性细胞浸润,这4个特点中,有2个或2个以上,同时缺乏肉芽肿,UC诊断准确率达75%。静止期UC,黏膜可出现与结构损害和愈合相关的组织学特点,如隐窝结构的扭曲(萎缩和分支)以及上皮再生。UC早期也可不出现隐窝结构改变,表现为基底部浆细胞增多,而在发病1年后出现隐窝结构紊乱。与之相比,感染性结肠炎的病理表现为黏膜上1/3的急性浅表性炎症,隐窝结构存在,故仅用感染性结肠无法解释患者隐窝结构的改变。其他如药物性结肠炎、克罗恩病
增多的全黏膜炎性细胞浸润,这4个特点中,有2个或2个以上,同时缺乏肉芽肿,UC诊断准确率达75%。静止期UC,黏膜可出现与结构损害和愈合相关的组织学特点,如隐窝结构的扭曲(萎缩和分支)以及上皮再生。UC早期也可不出现隐窝结构改变,表现为基底部浆细胞增多,而在发病1年后出现隐窝结构紊乱。与之相比,感染性结肠炎的病理表现为黏膜上1/3的急性浅表性炎症,隐窝结构存在,故仅用感染性结肠无法解释患者隐窝结构的改变。其他如药物性结肠炎、克罗恩病 结肠受累等,也可见隐窝结构改变,但该患者病史及临床特点均不支持,故UC仍不能除外,需在后续随访中进一步明确。
结肠受累等,也可见隐窝结构改变,但该患者病史及临床特点均不支持,故UC仍不能除外,需在后续随访中进一步明确。
2021年8月门诊复查结肠镜,见全结肠黏膜血管纹理模糊,多发息肉和淋巴管扩张,未见糜烂、溃疡;活检病理提示黏膜活动性炎,隐窝结构紊乱,可见隐窝炎及隐窝脓肿,固有层淋巴管扩张。考虑患者溃疡性结肠炎诊断明确(全结肠型,Mayo 评分1分),加用美沙拉秦1g qid治疗。
最后诊断为:溃疡性结肠炎(初发型,广泛结肠型,活动期,重度);肠道多枝梭菌感染。
总结
回顾患者病史,有以下几点值得注意:
①患者高龄、术后肠道菌群紊乱、病程中合并不洁饮食史,均为肠道感染的高危因素,提示反复询问并掌握全面的临床病史的重要性。
②患者外院治疗期间曾使用多种抗生素,应用头孢他啶2天后热峰即有所下降,却未能继续坚持。在肠道感染性疾病的经验性治疗时,抗感染治疗建议至少观察3天以明确疗效。而在疾病尚未确诊,肠道感染或其他感染性疾病尚不能除外的情况下,若予患者激素可能会加重病情。
③该患者为中老年男性,肿瘤标志物水平增高,需警惕肿瘤,从本例我们也关注到,炎症性疾病也可能致肿瘤标志物水平轻至中度升高,故需要临床密切随访。
④该患者病理检查 提示“隐窝炎、隐窝脓肿”,部分临床医生将此作为UC诊断标准,但需注意此改变亦可见于肠道慢性感染性疾病,故需临床长期随访明确。
提示“隐窝炎、隐窝脓肿”,部分临床医生将此作为UC诊断标准,但需注意此改变亦可见于肠道慢性感染性疾病,故需临床长期随访明确。
⑤UC诊断虽然没有金标准,但病理表现仍是不容忽略的诊断依据,既要“认识”早期UC病理表现,也要“认识”UC和感染性肠炎病理表现的区别,必要时通过随访进一步明确诊断。
参考文献:
[1] Ordás I, Eckmann L, Talamini M, Baumgart DC, Sandborn WJ. Ulcerative colitis.Lancet. 2012;380(9853):1606-1619.
[2] Du L, Ha C. Epidemiology and Pathogenesis of Ulcerative Colitis.Gastroenterol Clin North Am. 2020;49(4):643-654.
[3] Segal JP, LeBlanc JF, Hart AL. Ulcerative colitis: an update.Clin Med (Lond). 2021;21(2):135-139.
[4] Yang H,Zhou W ,Lv H,et al .The Association Between CMV Viremia or Endoscopic Features and listopathological Characteristics of CMV Colitis in Patients with Underlying Ulcerative Colitis[J]. Inflamm Bowel 0»,2017,23(5):814-821.
[5] Baumler AJ, Sperandio V. Interactions between the mierobiota and pathogenic bacteria in the gut[J]. Na:ure,2016, 535(7610):85-93.
[6] Gardner RC, Feinerman AE, Kantrowitz PA,et al. Serial carcinoembryonic antigen(CEA blood levels in patierto with ulcerative colitis[J].Am J Dig Dis, 1978,23(2):129-133.
