
以喘憋为临床表现的D-二聚体阴性的主动脉夹层1例
作者:张雪阳,朱娅楠,张园园,韩雪等,首都医科大学附属北京潞河医院急诊科
主动脉夹层 (aortic dissection,AD)是由于各种原因导致主动脉内膜撕裂,血液通过撕裂处进入主动脉壁间引起主动脉壁分层、分离,并沿主动脉长轴方向扩展形成真假两腔分离状态[1] 。目前应用广泛的两种分型为DeBakey分型和Stanford分型。AD是心血管系统中的急危重症,发病凶险,病情进展迅速,临床表现多样,病死率高,若未及时诊治,Stanford A型夹层48 h病死率可高达50%,Stanford B型夹层30 d病死率达10%[2] 。本文报道1例以喘憋为主要临床表现并且D-二聚体
(aortic dissection,AD)是由于各种原因导致主动脉内膜撕裂,血液通过撕裂处进入主动脉壁间引起主动脉壁分层、分离,并沿主动脉长轴方向扩展形成真假两腔分离状态[1] 。目前应用广泛的两种分型为DeBakey分型和Stanford分型。AD是心血管系统中的急危重症,发病凶险,病情进展迅速,临床表现多样,病死率高,若未及时诊治,Stanford A型夹层48 h病死率可高达50%,Stanford B型夹层30 d病死率达10%[2] 。本文报道1例以喘憋为主要临床表现并且D-二聚体 (D-dimer,D-D)阴性的病例最终确诊为Stanford B型夹层,希望为临床工作者提供更多的临床思路,减少AD的误诊及漏诊。
(D-dimer,D-D)阴性的病例最终确诊为Stanford B型夹层,希望为临床工作者提供更多的临床思路,减少AD的误诊及漏诊。
1病例资料
患者男性,60岁,主因“突发喘憋伴大汗1 h”入院,患者于入院前1 h无明显诱因突发喘憋,无法平卧,伴大汗,无胸背痛、腹痛,无恶心、呕吐等症状,喘憋持续无法缓解,就诊于本院急诊科。既往史:糖尿病、高血压病史,均规律用药。否认冠状动脉粥样硬化性心脏病(以下简称冠心病)病史,否认药物过敏史。
入院查体:右侧上肢血压168/75 mm Hg(1 mm Hg=0.133 kPa),左侧上肢血压161/80 mm Hg,心率85次/min,指脉血氧饱和度98%,神清,精神差,大汗,端坐呼吸,双肺呼吸音粗,未闻及干湿啰音,心律齐,未闻及心脏杂音 及心包摩擦音。腹膨隆,无压痛、反跳痛及肌紧张。双下肢无水肿
及心包摩擦音。腹膨隆,无压痛、反跳痛及肌紧张。双下肢无水肿 。
。
完善检查:血常规 :白细胞8.88×109/L,血红蛋白
:白细胞8.88×109/L,血红蛋白 155 g/L,血小板199×109/L。生物化学指标未见异常。心功能五项:高敏肌钙蛋白
155 g/L,血小板199×109/L。生物化学指标未见异常。心功能五项:高敏肌钙蛋白 、肌酸激酶同工酶、肌红蛋白
、肌酸激酶同工酶、肌红蛋白 及N末端脑钠肽前体均为阴性,D-dimer<0.2μg/m L。血气分析:pH 7.396,PCO239.8 mm Hg,PO272.2 mm Hg,HCO- 3 24 mmol/L,碱剩余
及N末端脑钠肽前体均为阴性,D-dimer<0.2μg/m L。血气分析:pH 7.396,PCO239.8 mm Hg,PO272.2 mm Hg,HCO- 3 24 mmol/L,碱剩余 (baseexcess,BE)-0.5 mmol/L。心电图
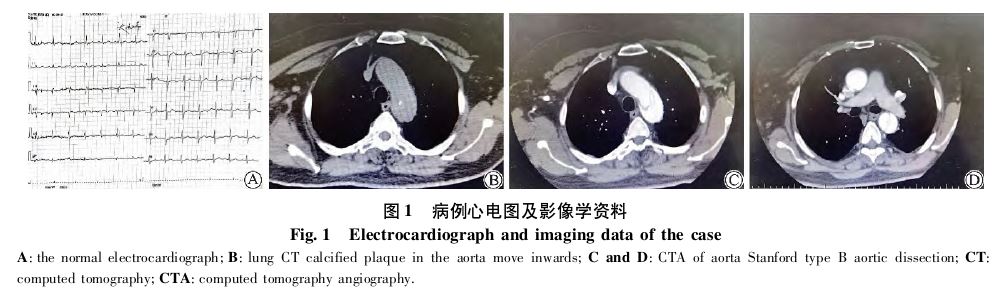
(baseexcess,BE)-0.5 mmol/L。心电图 提示大致正常心电图(图1A)。心脏彩超:左室射血分数73%,结构及功能未见异常。双下肢血管彩超
提示大致正常心电图(图1A)。心脏彩超:左室射血分数73%,结构及功能未见异常。双下肢血管彩超 :双下肢动脉轻度硬化,双下肢深静脉通畅。肺部电子计算机断层显像
:双下肢动脉轻度硬化,双下肢深静脉通畅。肺部电子计算机断层显像 (computed tomography,CT)提示肺间质改变,主动脉弓内钙化斑内移(图1B~D)。初步诊断:喘憋待查:急性心力衰竭
(computed tomography,CT)提示肺间质改变,主动脉弓内钙化斑内移(图1B~D)。初步诊断:喘憋待查:急性心力衰竭 ?急性肺栓塞
?急性肺栓塞 ?主动脉夹层?
?主动脉夹层?
鉴别诊断:(1)急性心力衰竭:患者否认冠心病病史,心电图、心肌酶及N末端脑钠肽前体指标正常,考虑该诊断可能性小。(2)急性肺栓塞:患者喘憋,血气提示低氧血症,低流量吸氧(2 L/min)后指脉血氧饱和度维持在98%左右,心脏彩超未见肺动脉高压表现,双下肢静脉未见血栓,肺栓塞Wells评分0分,D-dimer阴性,考虑急性肺栓塞可能性小。(3)主动脉夹层:患者入院后虽然脉氧维持在98%左右,但仍自觉喘憋无缓解,患者症状与指标不相符,结合肺部CT提示钙化斑内移,考虑主动脉夹层可能,完善主动脉CT血管成像 (computed tomographyangiography,CTA),明确Stanford B型主动脉夹层。
(computed tomographyangiography,CTA),明确Stanford B型主动脉夹层。
治疗:患者收入重症监护室,入室血压189/103 mm Hg,心率90次/min,给予艾司洛尔 、地尔硫卓
、地尔硫卓 及乌拉地尔
及乌拉地尔 控制心率及血压、芬太尼
控制心率及血压、芬太尼 镇痛治疗,收缩压
镇痛治疗,收缩压 控制在110~120 mm Hg,心率控制在60~70次/min。住院后监测D-dimer变化,发病6 h D-dimer0.429μg/m L,发病10 h完成胸主动脉覆膜支架腔内隔绝手术。术后1 h、17 h、4 d、8 d,D-dimer分别为0.785、0.943、1.841、0.363μg/m L。患者恢复良好出院,出院后继续口服降压药,嘱严格控制血压,出院后规律随访中。
控制在110~120 mm Hg,心率控制在60~70次/min。住院后监测D-dimer变化,发病6 h D-dimer0.429μg/m L,发病10 h完成胸主动脉覆膜支架腔内隔绝手术。术后1 h、17 h、4 d、8 d,D-dimer分别为0.785、0.943、1.841、0.363μg/m L。患者恢复良好出院,出院后继续口服降压药,嘱严格控制血压,出院后规律随访中。
2讨论
AD是临床中的致命性心血管危重症,早期诊断及治疗可以明显降低患者的死亡风险,改善预后。国内目前仍缺乏AD的流行病学数据,欧美国家AD发病率为(2.6~6.0)/10万[3] ,平均年龄为63.1岁,男性居多(约65%),其中Stanford B型AD占比33%[4 ] 。我国AD发病年龄偏小,平均年龄51.8岁,考虑与高血压控制率低于国外有关[5] 。高危因素主要包括高血压、动脉粥样硬化、基因突变引起的主动脉疾病、创伤等。AD患者常表现为突发胸腹痛或后背痛等,该患者特殊之处在于主要表现为突发喘憋无法缓解,无胸背痛、腹痛等症状,患者的临床表现造成初诊困难,但经过相关检查及鉴别诊断后仍高度怀疑AD进而完善主动脉CTA以明确诊断。无独有偶,赵运海等[6] 也曾有相关病例报道,以胸闷、呼吸困难 及晕厥
及晕厥 为主要表现,最终确诊为急性主动脉根部局限性夹层。笔者认为AD患者呼吸困难考虑可能与肺灌注不良引起通气血流比例失调有关,相关研究文献较少,有待进一步研究。
为主要表现,最终确诊为急性主动脉根部局限性夹层。笔者认为AD患者呼吸困难考虑可能与肺灌注不良引起通气血流比例失调有关,相关研究文献较少,有待进一步研究。
2022年AD中国专家共识[2] 提出,D-dimer可作为急性AD诊断的排除标准,相关Meta分析[7] 表明,D-dimer以0.50μg/m L为界限值,D-dimer阴性作为低风险人群诊断AD的排除指标或许是受益的。该病例特殊之处在于发病1 h D-dimer<0.2μg/m L,发病6 h D-dimer 0.429μg/m L,发病10 h完成手术治疗,发病16 h D-dimer 0.785μg/m L。可见,该患者发病6h内D-dimer均呈阴性,随着发病时间延长Ddimer才逐渐升高。相关研究[8] 也显示Stanford B型AD可以出现D-dimer阴性,而高血小板计数是Ddimer阴性的独立相关因素[9] 。因此,D-dimer阴性作为AD的排除指标不是绝对的,Koch等[10] 研究也
表明D-dimer以0.5μg/m L为截断值,用于AD诊断的灵敏度较高,特异度较差,提示D-dimer阴性可造成AD漏诊,而D-dimer联合其他筛查手段如主动脉夹层检测评分系统可提高AD诊断的准确性[11] 。
AD确诊后需立即给予药物治疗,治疗原则主要是镇静镇痛、降低心率和血压,在充分药物治疗基础上尽快手术干预,而血压管理在AD治疗中贯穿始终,即在保证器官灌注充足的前提下迅速将血压降至安全目标范围[12] ,通过降低血压及心肌收缩力减少主动脉壁病变部位的剪切应力,抑制夹层假腔进一步扩大。急诊科常常为AD患者发病就诊的第一站,因此快速控制血压和心率是急诊科医师的必备能力。目前推荐AD患者在保证器官灌注前提下30 min内将血压及心率控制至初始目标值[1,13] ,即血流动力学稳定且患者可耐受情况下收缩压为100~120 mm Hg,心率为60~80次/分;血流动力学不稳定者收缩压维持在80~100 mm Hg。β受体阻滞剂(如艾司洛尔等)或α受体阻滞剂(如乌拉地尔等)是最基础用药,降压效果不佳者可联用钙通道阻滞剂药物(如地尔硫卓等)。在心率未控制前,单纯应用血管扩张剂(如硝普钠 等)可引起反射性儿茶酚胺
等)可引起反射性儿茶酚胺 释放,增加左心室收缩力反而可能导致夹层恶化。研究[13] 表明,血压管理不良的AD患者5年生存率约为60%,控制良好者生存率高达95%,故而AD患者的药物治疗也是重中之重。
释放,增加左心室收缩力反而可能导致夹层恶化。研究[13] 表明,血压管理不良的AD患者5年生存率约为60%,控制良好者生存率高达95%,故而AD患者的药物治疗也是重中之重。
从本病例可总结相关经验,急诊接诊表现为胸闷、喘憋等症状的患者,即使无胸背痛、腹痛等表现,除筛查心肺相关疾病外,也应考虑AD可能,可完善心电图、心肌酶、D-dimer、胸部CT、心脏彩超等检查,D-dimer阴性也无法完全排除AD的可能,需综合评估患者病情,必要时完善主动脉CTA明确诊断。AD发病凶险,希望该病例报道能提供相关临床经验,减少误诊可能,尽快确诊并早期进行干预治疗。
参考文献略。
来源:张雪阳,朱娅楠,张园园,韩雪,李凤杰.以喘憋为临床表现的D-二聚体阴性的主动脉夹层1例[J].首都医科大学学报,2022,43(06):966-968.
