
多囊肾患者辅助生殖前基因检测误诊1例
作者:柏海燕,魏莲花,李晓芳,师娟子,西北妇女儿童医院生殖中心
一、病例资料
患者男,32岁,2022年1月2日以“婚后未育5年,男方有多囊肾家族史”主诉来我院生殖中心就诊。2022年1月4日精液化验提示严重少弱畸精子症,因男方因素拟行卵细胞浆内单精子注射(ICSI)助孕。患者及其父(67岁)均患多囊肾(临床诊断),其母亲(65岁)与弟弟(30岁)无多囊肾表型。
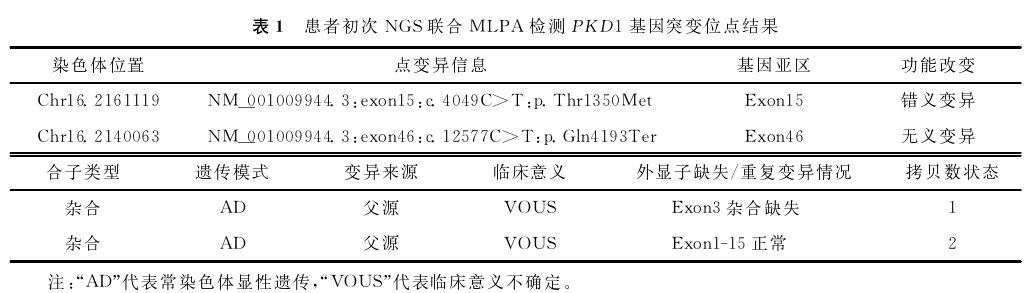
考虑到多囊肾为遗传性疾病,最终确诊需要进行基因检测[1]。患者随即在第三方检测机构采集外周血,采用下一代测序(NGS)与多重连接探针扩增技术(MLPA)相结合的方法,进行多囊肾相关基因组合检测[2-3]。NGS方法检测到患者PKD1基因有2个位点变异,分别为NM_001009944.3:exon15:c.4049C>T:p.Thr1350Met和NM_001009944.3:exon46:c.12577C>T:p.Gln4193Ter变异。MLPA结果提示,PKD1基因3号外显子杂合缺失。根据美国医学遗传学与基因组学学会(ACMG)对基因变异临床意义的分类标准,结合上述变异人群频率、遗传模式、文献报道及蛋白功能影响信息,该PKD1基因2个位点变异依据评级证据PS4_Supporting+PM2_Supporting+PP1[4 ]和PVS1_Moderate+PS4_Sup-porting+PM2_Supporting[5-6],均评为临床意义不确定(VOUS);第3号外显子杂合缺失评级为致病性变异(Pathogenic,P)[7]。检测报告见表1。
据人类孟德尔遗传学(OMIM)数据库中记载,PKD1基因的杂合致病性变异可导致成人型多囊肾,该疾病呈常染色体 显性遗传模式[8-9]。患者主要表现为肾囊肿、肝囊肿
显性遗传模式[8-9]。患者主要表现为肾囊肿、肝囊肿 和颅内动脉瘤
和颅内动脉瘤 [10-11],常见急/慢性疼痛及肾结石等并发症[12],约50%的患者会在60岁左右进展为终末期肾病[13]。
[10-11],常见急/慢性疼痛及肾结石等并发症[12],约50%的患者会在60岁左右进展为终末期肾病[13]。
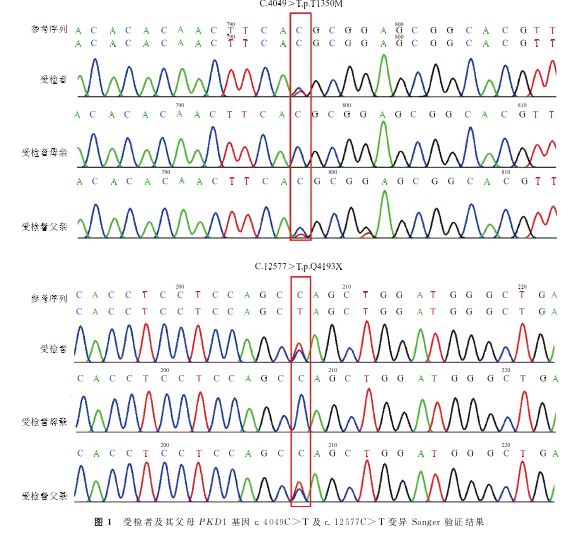
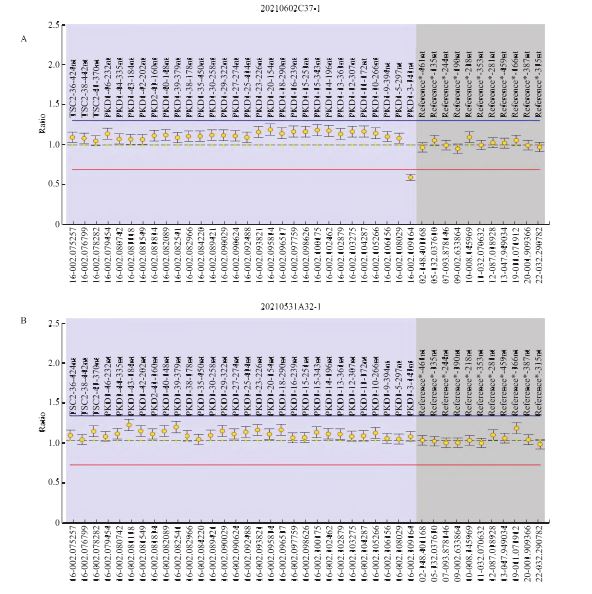
经遗传咨询后患者夫妇决定行单基因病胚胎植入前遗传学检测(PGT-M)助孕[14]。遂采集家系成员的外周血标本进行家系验证并构建单体型。点突变家系Sanger验证及构建单体型结果提示,本例患者的2个VOUS点变异均遗传自其父,其无表型母亲未携带突变位点(图1)。对PKD1基因杂合缺失变异进行MLPA法验证时发现,该患者携带的3号外显子缺失遗传自无表型的母亲,而非有表型的父亲(图2)。考虑到PKD1基因与多囊肾表型关联度高且外显度较高,理论上受检者母亲携带1个外显子缺失但无表型的可能性较低,遂对上述检测结果产生怀疑,展开进一步排查。
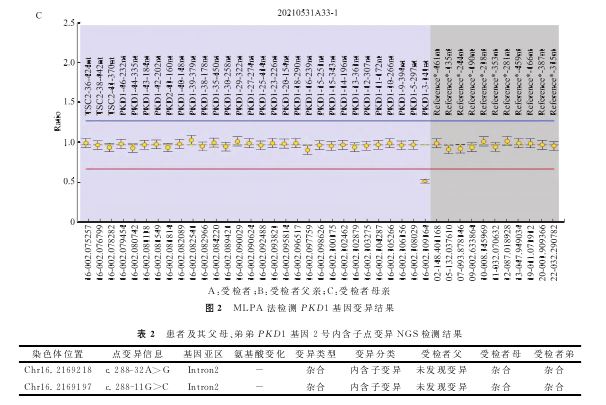
经分析MLPA探针设计原理,怀疑PKD1基因2号内含子(近3号外显子处)存在的点突变干扰了3号外显子的探针信号,从而拉低了信号值,呈现假性缺失的状态。经Sanger验证进一步证实,发现受检者及其母亲在2号内含子区携带了两个杂合变异,分别为chr16:2169218.c.288-32A>G和chr16:2169197.c.288-11G>C,均评估为临床意义不明-偏良性(VOUS-LB)。经Sanger验证受检者弟弟发现其同样携带上述两个杂合内含子变异(表2、图3)。利用探针法验证受检者及其母亲的PKD1基因3号外显子的拷贝数结果也显示未见明显缺失(图4)。进一步分析原检测报告中的2个点变异,针对受检者遗传自有相似表型父亲的两个杂合位点,对受检者弟弟进行Sanger验证,结果显示其无相关临床表型的弟弟并未携带这两个变异位点(表3、图5)。该家系中两个变异位点符合变异-表型共分离机制。
结合本例患者多囊肾家系中变异与表型共分离证据(证据等级PP1),及该受检者的临床症状和家族史高度符合多囊肾主要表型证据(证据等级PP4),给出受检者修正后的基因检测报告如下:受检者样本检测到PKD1基因变异c.4049C>T和c.12577C>T,c.4049C>T评估为VOUS(PS4_Supporting+PM2_Supporting+PP1+PP4),
c.12577C>T评估为可能致病变异(LP,PVS1_Moderate+PS4_Supporting+PM2_Supporting+ PP4+PP1)。NGS联合MLPA检测PKD1基因点变异及拷贝数变异结果显示,未检测到可以明确解释受检者表型的拷贝数变异(表4)。
二、讨论
本例患者行PGT-M的目的是剔除携带有与其相同的致病变异基因胚胎,避免同疾病患儿出生,因此PGT-M助孕前对致病位点的认定需慎之又慎。基因层面的检测方法有很多,均有各自的优点和局限,常见的NGS主要针对点变异进行检测,而MLPA则对拷贝数变异的检测更准确[15]。不同单基因病基因变异类型有其特异性,检测机构也需要相应个体化、采用有针对性的检测方法。针对常见高发的单基因疾病,如果需要针对大片段缺失/重复进行检测,一般综合采用NGS联合MLPA方法[16]。如常见的脊髓性肌萎缩 症(SMA)、杜氏肌营养不良(DMD),其大片段缺失/重复所占比例非常高(SMA为95%,DMD约为50%),需要做NGS联合MLPA(或者PCR)检测,同时对点变异和缺失/重复变异进行检测。但对于苯丙酮尿症
症(SMA)、杜氏肌营养不良(DMD),其大片段缺失/重复所占比例非常高(SMA为95%,DMD约为50%),需要做NGS联合MLPA(或者PCR)检测,同时对点变异和缺失/重复变异进行检测。但对于苯丙酮尿症 和丙酸血症
和丙酸血症 等,大部分都是点变异或者几个碱基的缺失,大片段缺失/重复的比例比较低(5%左右),一般检测部门可能只做NGS检测。PKD1和PKD2基因的致病性变异可导致常染色体显性遗传的多囊肾(ADPKD)。根据文献资料,约85%的ADPKD患者为PKD1基因致病性变异所致,约15%的患者为PKD2基因致病性变异所致,致病性变异以点突变为主,单个或多个外显子的缺失和/或重复仅约占所有致病性变异的2%~4%[4-5]。具体到本病例患者,检测机构对其第1次基因检测即很谨慎,采用NGS联合MLPA综合解决方案,但仍误诊,误诊的原因与变异位点位于基因外显子边缘、引物设计受内涵子变异干扰有关。NGS检测到内含子边缘处2个变异,因无致病性一般忽略不计,巧合的是这两个变异位点影响了MLPA结果。引物会延伸至外显子两端的内含子区域,如果引物结合的内含子区域恰好存在变异,则可能拉低外显子整体的杂交信号值,造成假阳性结果,这种假阳性尽管是小概率事件,但可能发生。
等,大部分都是点变异或者几个碱基的缺失,大片段缺失/重复的比例比较低(5%左右),一般检测部门可能只做NGS检测。PKD1和PKD2基因的致病性变异可导致常染色体显性遗传的多囊肾(ADPKD)。根据文献资料,约85%的ADPKD患者为PKD1基因致病性变异所致,约15%的患者为PKD2基因致病性变异所致,致病性变异以点突变为主,单个或多个外显子的缺失和/或重复仅约占所有致病性变异的2%~4%[4-5]。具体到本病例患者,检测机构对其第1次基因检测即很谨慎,采用NGS联合MLPA综合解决方案,但仍误诊,误诊的原因与变异位点位于基因外显子边缘、引物设计受内涵子变异干扰有关。NGS检测到内含子边缘处2个变异,因无致病性一般忽略不计,巧合的是这两个变异位点影响了MLPA结果。引物会延伸至外显子两端的内含子区域,如果引物结合的内含子区域恰好存在变异,则可能拉低外显子整体的杂交信号值,造成假阳性结果,这种假阳性尽管是小概率事件,但可能发生。
本病例之所以能及时发现诊断错误,幸运之处在于PKD1基因与多囊肾表型关联度高且外显度较高,理论上其母亲携带1个“致病”外显子缺失但无表型的可能性较低,提醒我们进行反思;又有其健康弟弟的测序结果提供了进一步的验证数据。该病例提示我们,当无症状个体筛查出已知致病性变异时,除了对疾病特点进一步了解外,还需要对检测结果各方面进行探究分析,以明确检测是否准确。
综上所述,家系验证在基因诊断中具有重要性,提醒我们在PGT-M临床工作中不能采取拿来主义、直接采信基因报告单结果对胚胎进行检测,而是应该多方评估和验证,避免落入误诊的陷阱。
参考文献略。
来源:柏海燕,魏莲花,李晓芳,师娟子.多囊肾患者辅助生殖前基因检测误诊1例[J].生殖医学杂志,2023,32(04):603-609.
