
尿路源性大肠埃希菌导致经椎间孔腰椎间融合术后感染1例
作者:宁波市医疗中心李惠利医院脊柱外科 何凡
脊柱手术部位感染一类严重并发症,其发生率为0.7%~10.9%,而内置物及特殊的解剖特点导致腰椎后路融合内固定术后深部感染的治疗更加棘手。引起脊柱感染最常见的致病微生物为革兰氏阳性菌,其中以金黄色葡萄球菌 最为常见,约占所有脊柱感染的50%,其次是表皮葡萄球菌。大肠埃希菌引发尿路感染并造成脊柱感染的病例报道较少,也未见因尿路感染导致腰椎术后感染并造成严重后果的报道。笔者于2021-08诊治1例尿路源性大肠埃希菌导致腰椎术后感染,报道如下。
最为常见,约占所有脊柱感染的50%,其次是表皮葡萄球菌。大肠埃希菌引发尿路感染并造成脊柱感染的病例报道较少,也未见因尿路感染导致腰椎术后感染并造成严重后果的报道。笔者于2021-08诊治1例尿路源性大肠埃希菌导致腰椎术后感染,报道如下。
病例报道
患者,男,51岁,因“腰椎术后13年,腰痛伴左下肢疼痛乏力10d”入院。查体:L4、5棘突旁压痛阳性,左下肢直腿抬高试验 30°阳性,左下肢踝背伸及足拇背伸肌力Ⅳ级,左小腿前外侧皮肤感觉减退。MRI显示L4、5椎间盘变性,髓核偏左后上方脱出,椎管狭窄。患者23年前曾因L4、5椎间盘突出症行椎板开窗单纯髓核摘除术,存在双肾结石、右侧输尿管结石及尿路感染病史,曾进行药物排石治疗。患者诊断为腰椎间盘突出症术后复发,排除手术禁忌证后行L4、5经椎间孔腰椎间融合术治疗,术前0.5h及术后12h内静脉滴注头孢呋辛
30°阳性,左下肢踝背伸及足拇背伸肌力Ⅳ级,左小腿前外侧皮肤感觉减退。MRI显示L4、5椎间盘变性,髓核偏左后上方脱出,椎管狭窄。患者23年前曾因L4、5椎间盘突出症行椎板开窗单纯髓核摘除术,存在双肾结石、右侧输尿管结石及尿路感染病史,曾进行药物排石治疗。患者诊断为腰椎间盘突出症术后复发,排除手术禁忌证后行L4、5经椎间孔腰椎间融合术治疗,术前0.5h及术后12h内静脉滴注头孢呋辛 钠1.5g预防感染,术后第2天引流管
钠1.5g预防感染,术后第2天引流管 引流量<50mL时拔除引流管与导尿管。术后第5天患者出现高热寒颤,切口皮下大量浑浊血性分泌物渗出,急诊进行血常规
引流量<50mL时拔除引流管与导尿管。术后第5天患者出现高热寒颤,切口皮下大量浑浊血性分泌物渗出,急诊进行血常规 、超敏C-反应蛋白
、超敏C-反应蛋白 、尿常规
、尿常规 、肝肾功能、电解质、凝血功能等检查,取切口分泌物进行细菌培养、尿培养
、肝肾功能、电解质、凝血功能等检查,取切口分泌物进行细菌培养、尿培养 、血培养
、血培养 及抗菌药物敏感试验,予以物理及药物降温,经验性应用利奈唑胺
及抗菌药物敏感试验,予以物理及药物降温,经验性应用利奈唑胺 0.6g(静脉滴注,1次/12h)抗感染治疗。血培养及分泌物培养结果均显示为产超广谱β-内酰胺酶
0.6g(静脉滴注,1次/12h)抗感染治疗。血培养及分泌物培养结果均显示为产超广谱β-内酰胺酶 大肠埃希菌,尿培养2d无细菌生长。血常规:白细胞计数为10.4×109/L,中性粒细胞分类87.7%,超敏C-反应蛋白105.1mg/L。尿常规结果显示白细胞计数显著升高(79/μL),红细胞计数显著升高(109/μL),白细胞酯酶弱阳性,潜血(+),尿蛋白(++)。腹部CT
大肠埃希菌,尿培养2d无细菌生长。血常规:白细胞计数为10.4×109/L,中性粒细胞分类87.7%,超敏C-反应蛋白105.1mg/L。尿常规结果显示白细胞计数显著升高(79/μL),红细胞计数显著升高(109/μL),白细胞酯酶弱阳性,潜血(+),尿蛋白(++)。腹部CT 显示双肾周渗出改变、盆腔积液、右输尿管上段结石、双肾结石。切口拆线后加强引流,切口皮下组织用稀碘
显示双肾周渗出改变、盆腔积液、右输尿管上段结石、双肾结石。切口拆线后加强引流,切口皮下组织用稀碘 伏和生理盐水冲洗。
伏和生理盐水冲洗。
根据感染科专家会诊意见结合药敏结果更换抗生素为亚胺培南西司他丁 0.5g(静脉滴注,1次/6h),3d后体温恢复正常,复查炎症指标显著下降,复查腰椎CT及MRI未见深部感染表现。泌尿外科会诊后考虑细菌为尿路来源,于腰椎术后第12天行双侧输尿管支架置入术,继续抗感染治疗1周,患者体温正常,切口愈合,复查3次炎症指标均正常后出院。出院后患者继续口服莫西沙星
0.5g(静脉滴注,1次/6h),3d后体温恢复正常,复查炎症指标显著下降,复查腰椎CT及MRI未见深部感染表现。泌尿外科会诊后考虑细菌为尿路来源,于腰椎术后第12天行双侧输尿管支架置入术,继续抗感染治疗1周,患者体温正常,切口愈合,复查3次炎症指标均正常后出院。出院后患者继续口服莫西沙星 片0.4g抗感染治疗2周(1次/d),然后至泌尿外科行镜下双肾结石及右输尿管结石碎石、取石术,术后继续口服莫西沙星片0.4g抗感染治疗4周(1次/d),再次复查炎症指标正常。腰椎手术后4个月患者因腰痛就诊,CT检查
片0.4g抗感染治疗2周(1次/d),然后至泌尿外科行镜下双肾结石及右输尿管结石碎石、取石术,术后继续口服莫西沙星片0.4g抗感染治疗4周(1次/d),再次复查炎症指标正常。腰椎手术后4个月患者因腰痛就诊,CT检查 发现L4、5椎间隙感染,L4椎体及下终板、L5椎体和上终板破坏,椎弓根钉松动,椎间融合器塌陷移位。再次入院治疗,入院时体温正常,白细胞计数为9.94×109/L,中性粒细胞分类66.3%,超敏C-反应蛋白48.1mg/L,降钙素
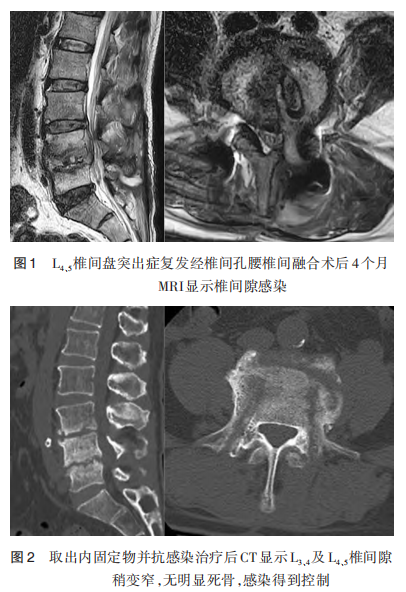
发现L4、5椎间隙感染,L4椎体及下终板、L5椎体和上终板破坏,椎弓根钉松动,椎间融合器塌陷移位。再次入院治疗,入院时体温正常,白细胞计数为9.94×109/L,中性粒细胞分类66.3%,超敏C-反应蛋白48.1mg/L,降钙素 原为0.071ng/mL,红细胞沉降率为97mm/h。血培养、尿培养结果阴性。考虑为大肠埃希菌引发的手术部位深部感染,静脉滴注亚胺培南西司他丁0.5g(1次/6h),查体可见手术切口无破溃及红肿渗出,压痛阳性。B超显示手术部位软组织内脓肿形成,深入椎间隙。腰椎MRI显示手术部位皮下积脓,可见脓肿流注通道深入椎间隙(图1),椎间隙内积脓,L4椎体及下终板,L5椎体和上终板破坏,椎弓根钉松动,椎间融合器塌陷移位。B超引导下脓肿穿刺抽吸并行脓液细菌培养及药敏试验
原为0.071ng/mL,红细胞沉降率为97mm/h。血培养、尿培养结果阴性。考虑为大肠埃希菌引发的手术部位深部感染,静脉滴注亚胺培南西司他丁0.5g(1次/6h),查体可见手术切口无破溃及红肿渗出,压痛阳性。B超显示手术部位软组织内脓肿形成,深入椎间隙。腰椎MRI显示手术部位皮下积脓,可见脓肿流注通道深入椎间隙(图1),椎间隙内积脓,L4椎体及下终板,L5椎体和上终板破坏,椎弓根钉松动,椎间融合器塌陷移位。B超引导下脓肿穿刺抽吸并行脓液细菌培养及药敏试验 ,结果为产超广谱β-内酰胺酶大肠埃希菌。血培养及尿培养结果阴性。继续抗感染治疗1个月,在此期间卧床休息,支具保护。期间出现2次高热寒颤,考虑感染控制欠佳,行清创术并取出椎弓根钉及融合器,术中发现椎弓根钉松动,椎间融合器松动移位。内固定物细菌培养结果同前,术后继续使用敏感抗生素治疗,患者体温恢复正常,复查炎症指标恢复正常,感染控制,切口愈合后出院。出院后继续口服6周莫西沙星片0.4g(1次/d),随访6个月无感染复发(图2)。
,结果为产超广谱β-内酰胺酶大肠埃希菌。血培养及尿培养结果阴性。继续抗感染治疗1个月,在此期间卧床休息,支具保护。期间出现2次高热寒颤,考虑感染控制欠佳,行清创术并取出椎弓根钉及融合器,术中发现椎弓根钉松动,椎间融合器松动移位。内固定物细菌培养结果同前,术后继续使用敏感抗生素治疗,患者体温恢复正常,复查炎症指标恢复正常,感染控制,切口愈合后出院。出院后继续口服6周莫西沙星片0.4g(1次/d),随访6个月无感染复发(图2)。
讨论
脊柱手术部位感染的危险因素中,多节段手术、使用内置物、免疫系统功能不全、糖尿病等已经被证实,而本例除了使用内置物以外并无上述其他危险因素,但是患者合并双肾结石及右输尿管上段结石,而且既往有尿路感染病史。本例术前尿常规检查无异常,无尿路感染症状,可排除无症状性尿路感染。术后患者腹部CT显示双肾周渗出改变,结合尿常规检查结果及寒颤发热 表现,术后尿路感染诊断明确。患者术后第5天突然出现高热寒颤的全身炎症反应,并有局部切口皮下组织感染,若为局部细菌接种后形成的浅表部位感染,不会出现细菌入血导致的脓毒血症表现,而且难以在短时间内造成切口深部的椎间隙感染。相较于手术部位细菌直接接种并局部扩散,最常见的脊柱感染机制仍然是血源性播散,其中两个主要理论是静脉理论和小动脉理论,而皮肤和软组织感染、血管穿刺部位感染、泌尿生殖系统感染可能是病原微生物的潜在来源。由血源性播散引起的化脓性脊柱椎间盘炎主要影响腰椎(58%),其次是胸椎(30%)和颈椎(11%)。病原微生物可通过椎旁的动脉弓或静脉丛引起感染。解剖学研究发现血液可由
表现,术后尿路感染诊断明确。患者术后第5天突然出现高热寒颤的全身炎症反应,并有局部切口皮下组织感染,若为局部细菌接种后形成的浅表部位感染,不会出现细菌入血导致的脓毒血症表现,而且难以在短时间内造成切口深部的椎间隙感染。相较于手术部位细菌直接接种并局部扩散,最常见的脊柱感染机制仍然是血源性播散,其中两个主要理论是静脉理论和小动脉理论,而皮肤和软组织感染、血管穿刺部位感染、泌尿生殖系统感染可能是病原微生物的潜在来源。由血源性播散引起的化脓性脊柱椎间盘炎主要影响腰椎(58%),其次是胸椎(30%)和颈椎(11%)。病原微生物可通过椎旁的动脉弓或静脉丛引起感染。解剖学研究发现血液可由 盆腔静脉丛逆流到椎体周围静脉丛。Batson等研究发现血液从盆腔静脉丛经过无瓣膜的脊膜静脉逆流到椎旁静脉丛。Wiley等指出细菌可以存在于终末端小动脉毛细血管襻。因此可以合理推测本例病原菌并非来自手术部位接种,而是尿路感染导致大肠埃希菌血源性播散造成的手术部位感染,患者既往有尿路感染病史,积存的细菌潜伏于终末小动脉毛细血管襻中,当患者术后免疫力低下、器官机能减退时细菌迅速滋生,经血液循环到达手术部位引发椎间隙感染,进而扩散至腰背部皮下组织。
盆腔静脉丛逆流到椎体周围静脉丛。Batson等研究发现血液从盆腔静脉丛经过无瓣膜的脊膜静脉逆流到椎旁静脉丛。Wiley等指出细菌可以存在于终末端小动脉毛细血管襻。因此可以合理推测本例病原菌并非来自手术部位接种,而是尿路感染导致大肠埃希菌血源性播散造成的手术部位感染,患者既往有尿路感染病史,积存的细菌潜伏于终末小动脉毛细血管襻中,当患者术后免疫力低下、器官机能减退时细菌迅速滋生,经血液循环到达手术部位引发椎间隙感染,进而扩散至腰背部皮下组织。
文献报道后路腰椎融合术后尿路感染发生率为1.77%(统计超10000例),而且腰椎术后发生尿路感染的患者进展为脓毒血症的概率是其他腰椎术后患者的14倍,再住院率是其他腰椎术后患者的6倍。本例术后第5天突然出现高热寒颤、切口炎症渗出,表明大肠埃希菌感染后需要一段时间滋生并释放大量内毒素进入循环系统后才表现出全身炎症反应。患者发热特点为伴发寒颤,热型为弛张热与稽留热,发热过程中偶有体温正常的情况,多在应用抗菌药物治疗3~4d后出现,但是之后1~2d体温再次升高。产生超广谱β-内酰胺酶菌株的大肠埃希菌属于多重耐药菌,但无论大肠埃希菌是否产生超广谱β-内酰胺酶,其对碳青酶烯类抗生素具有较高的敏感性,因此可以考虑选择此类抗生素治疗。本例采用亚胺培南西司他丁钠抗感染治疗的效果较好。对于脊柱内固定术后深部感染的治疗,传统观点认为需去除内置物以控制感染,然而内置物过早取出影响脊柱的稳定性,会导致手术失败,并可能出现腰痛、神经根痛等临床症状。对于急性的脊柱术后感染,一般不建议取出内置物,而迟发性手术部位感染推荐在合适的时间取出内置物。
有学者指出早期脊柱内固定术后深部感染通过积极治疗后内固定物可以保留,若感染深达椎间隙且经抗生素治疗无效则应考虑移除。本例术后第5天初次感染爆发时,采用局部切口冲洗并加强引流,并使用碳青霉烯类抗生素治疗效果好,而术后4个月感染二次爆发时,影像学检查显示椎间隙感染,引起椎体骨质破坏,椎弓根钉松动、融合器移位,在应用抗生素治疗1个月后感染仍持续进展,患者仍反复发热,腰痛症状进行性加重,于是行清创术并取出椎弓根钉及融合器,术后继续进行抗生素治疗,2周后感染得到控制。脊柱术后手术部位感染往往造成灾难性后果,因此需重视术前预防。一项回顾性研究发现在接受腰椎融合手术的老年女性患者中,术前存在无症状性尿路感染者其术后手术部位感染发生率显著升高,而术中使用导尿管可能是主要的危险因素。有学者指出对于需要进行术中导尿的老年女性,在手术前应治疗无症状性尿路感染。因此临床医师需重视患者术前尿常规检查,一旦发现尿路感染应进行及时治疗,待感染治愈后再进行手术,术中及术后需留置导尿管的患者应注意导尿管的护理。Lee等统计分析了超过20000例腰椎手术后发现,存在术前低蛋白血症和C-反应蛋白增高的腰椎手术患者最常见的术后并发症是尿路感染,其发生率为16%。术前低蛋白血症和C-反应蛋白升高是腰椎手术后深部感染和尿路感染的危险因素。因此术前应常规进行C-反应蛋白水平检查,重视改善患者营养状况。Long等回顾性分析6727例脊柱融合手术,其发现贯穿整个躯干背侧造成手术部位感染的细菌分布梯度,颈椎手术部位感染多为表皮菌群(革兰氏阳性菌),而腰骶部手术部位感染多为肠道菌群(革兰氏阴性菌或厌氧菌);检测出高达57.5%的细菌对手术期间使用的预防性药物具有耐药性,头孢菌素耐药的革兰氏阴性菌导致的手术部位感染在腰骶部位手术患者中常见。因此对于脊柱手术患者,术前需要针对手术部位制定个体化的感染预防策略。
来源:中国骨与关节损伤杂志2023年5月第38卷第5期
