
胃肝样腺癌CT表现并文献复习1例
作者:邓相容,彭涛,牛翔科,吕赛群,钟诗雨,成都大学附属医院放射科
1.临床资料
患者,男,57岁,因“左上腹疼痛2周”于2020年12月2日入院。查体见贫血 貌,左上腹部压痛,未查见反跳痛,肌肉紧张。既往无肝炎、肝硬化病史,无饮酒史,无特殊药物服用史,2+年前行腰椎内固定术。
貌,左上腹部压痛,未查见反跳痛,肌肉紧张。既往无肝炎、肝硬化病史,无饮酒史,无特殊药物服用史,2+年前行腰椎内固定术。
家族史:其父因“胃癌 ”去世。腹部、盆腔CT检查
”去世。腹部、盆腔CT检查 提示:在胃小弯处见恶性占位性病灶伴外周淋巴结转移、多发肝转移;实验室检查提示:甲胎蛋白>2479.34IU/ml;胃镜检查
提示:在胃小弯处见恶性占位性病灶伴外周淋巴结转移、多发肝转移;实验室检查提示:甲胎蛋白>2479.34IU/ml;胃镜检查 提示:胃新生物,活检后病理诊断为胃肝样腺癌(hepatoid adenocarcinoma of the stomach,HAS),侵出浆膜、神经、脉管,胃小弯侧淋巴结及肝脏查见转移癌。
提示:胃新生物,活检后病理诊断为胃肝样腺癌(hepatoid adenocarcinoma of the stomach,HAS),侵出浆膜、神经、脉管,胃小弯侧淋巴结及肝脏查见转移癌。
全面评估患者情况先予以1周期辅助化疗,化疗方案为SOX(奥沙利铂 +替吉奥),1个月后改方案为曲妥珠单抗
+替吉奥),1个月后改方案为曲妥珠单抗 (400mg)+FOLFOX(奥沙利铂+亚叶酸钙
(400mg)+FOLFOX(奥沙利铂+亚叶酸钙 +氟尿嘧啶
+氟尿嘧啶 ),继续治疗4周期。胃原发肿瘤经靶向治疗+全身化疗后原发病灶基本稳定,肝脏转移灶部分较前缩小,但是部分病灶较前增大。
),继续治疗4周期。胃原发肿瘤经靶向治疗+全身化疗后原发病灶基本稳定,肝脏转移灶部分较前缩小,但是部分病灶较前增大。
患者于2021年5月17日接受全麻下腹腔镜 胃癌扩大根治术+肝癌切除术+肠粘连松解术,术后继续3周期FOLFOX方案化疗,目前该患者的整体情况良好。CT检查示:胃充盈差,胃小弯侧见大小为20mm×43mm的偏心软组织密度肿块,该肿块向胃腔内生长、密度不均、边界不清。
胃癌扩大根治术+肝癌切除术+肠粘连松解术,术后继续3周期FOLFOX方案化疗,目前该患者的整体情况良好。CT检查示:胃充盈差,胃小弯侧见大小为20mm×43mm的偏心软组织密度肿块,该肿块向胃腔内生长、密度不均、边界不清。
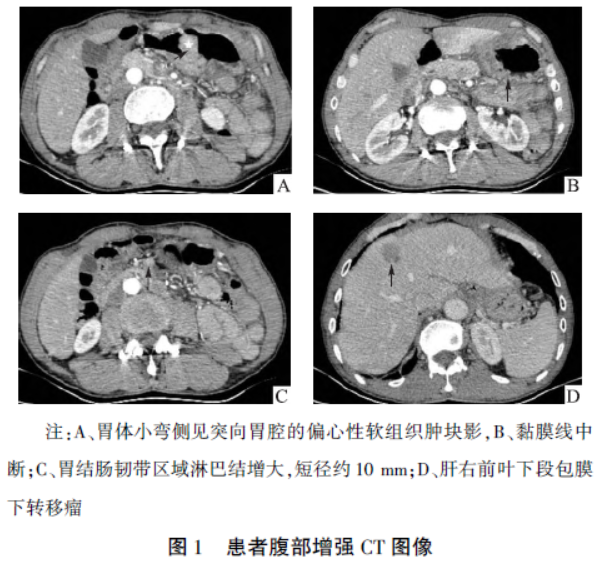
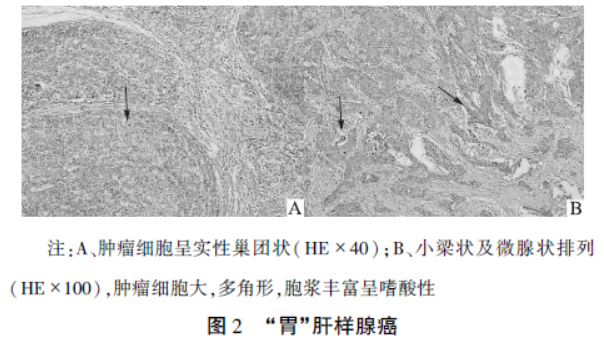
增强扫描病变明显不均匀强化,动脉期示黏膜线中断,门静脉期病灶似可见中央液化坏死(因腰椎金属内固定伪影干扰显示不清),周围脂肪间隙模糊,胃周间隙有多个淋巴结,部分增大;此外,肝脏内可见多个边缘不清、稍低密度结节影,较大者位于肝右前叶下段包膜下,大小约25mm×21mm,该病灶增强扫描显示轻度持续强化,基于以上表现考虑胃癌伴淋巴结转移和肝转移(见图1)。免疫组化结果:Heppar-1(+),AFP(+),SALL4(+),Glypican-3(+),CK19(+)(见图2)。
2.讨论
2.1临床表现:HAS的临床表现缺乏特异性,常与普通胃腺癌(adenocarcinoma,AC)表现类似,患者主要表现为不同程度的贫血、呕吐伴恶心、上腹不适或者腹部疼痛、腹部胀气、黑便等,其中最为常见的是腹痛[1]。本例患者也因左上腹疼痛为主要症状入院,查体未查见反跳痛、肌紧张等其他异常体征。HAS被确诊时通常为晚期,伴有远处的转移。
2.2影像学诊断:HAS的影像学表现具有一定特征性,主要CT平扫 表现为:病变好发于胃窦或胃体小弯侧,局部胃壁偏心性增厚,形成突向腔内生长的不规则软组织密度肿块,表面可形成溃疡,大多数病灶内可见中心坏死区,CT增强扫描显示病变区黏膜中断、破坏,病灶轻-中度不均匀强化,延迟期强化程度无明显降低,而此例肿块的位置和强化方式与文献报道一致。
表现为:病变好发于胃窦或胃体小弯侧,局部胃壁偏心性增厚,形成突向腔内生长的不规则软组织密度肿块,表面可形成溃疡,大多数病灶内可见中心坏死区,CT增强扫描显示病变区黏膜中断、破坏,病灶轻-中度不均匀强化,延迟期强化程度无明显降低,而此例肿块的位置和强化方式与文献报道一致。
HAS易发生肝脏转移、淋巴结转移及周围神经血管侵犯,本例亦发生淋巴结转移及肝脏转移。肝转移灶的表现不尽相同,但大多与肝癌的典型表现相似,表现为“快进快出”的强化模式。但是本病例的强化方式却呈乏血供肿瘤样强化,呈轻度延迟强化,未见造影剂明显退出,这与胃原发病变一致,但强化程度较轻。因此,根据影像学表现(部位、大小、形状、边缘、强化方式、表面溃疡及中心坏死、有无肝脏及邻近淋巴结转移等)是否存在,结合实验室检查(血清AFP水平),可为临床诊断HAS提供重要的诊断依据。
2.3病理组织学及肿瘤标志物:组织病理学是诊断HAS的金标准,光镜下HAS由腺癌及肝细胞癌 样分化区两个区域组成,2种组织细胞在交界区相互移行,免疫组织化学染色可在肿瘤细胞内检测到AFP、Hep-par-1、SALL4、Glypican-3和HSP70等呈阳性表达。
样分化区两个区域组成,2种组织细胞在交界区相互移行,免疫组织化学染色可在肿瘤细胞内检测到AFP、Hep-par-1、SALL4、Glypican-3和HSP70等呈阳性表达。
虽然早期的一些研究表明,大多数HAS病例伴有血清AFP明显升高,但是近年来有研究表明部分患者AFP并未升高,Zhang等报道了13例HAS患者,血清AFP阳性率为53.8%,Fu等报道了11例HAS患者,血清AFP阳性率为90.9%,Chen等报道了41例产甲胎蛋白的胃癌(alpha fetoprotein producing gastric cancer,AFPGC),AFP均为阳性,因此,血清AFP水平增高是HAS的重要特征,但不是必备特征,血清AFP阴性并不能完全排除HAS,血清AFP阳性亦非确诊HAS的特异性因素。
Xia等的研究表明,CEA、CK19和CK20染色在HAS中的染色频率比在肝细胞癌(hepato-cellular carcinoma,HCC)中更高,此外,腭、肺、鼻上皮癌相关蛋白(PLUNC)是区分HAS和HCC的良好标志物。CK19阴性可以排除HAS,而CK19阳性可除外HCC,这对鉴别HAS和HCC有重要的价值。本病例免疫组化结果Heppar-1(+),AFP(+),SALL4(+),Glypi-can-3(+),CK19(+),与文献报道吻合。
2.4鉴别诊断:HAS需要和普通AC,AFPGC、原发性HCC伴胃转移、恶性胃间质瘤(gastric stromal tumor,GIST)等鉴别。
①AC术前血清及免疫组化AFP较HAS低,而表面溃疡在HAS较常发生,HAS主要为动脉期强化明显、强化程度高于AC,而静脉期强化程度显著低于AC,AC主要为渐进性强化。HAS的强化方式与HCC部分相似,这与HAS组织中存在肝细胞癌样分化区有关。
②AFPGC血清或肿瘤组织AFP呈阳性表达(血清AFP指标>20ng/ml或免疫组化AFP阳性),但几乎不伴有肝细胞癌样分化;然而,HAS具有肝细胞癌样分化和腺癌的病理特征,部分患者血清和肿瘤组织中却未检测到甲胎蛋白升高,这两者的概念有一定的重合、也有一定的区别。
③HCC伴胃转移与HAS伴肝转移瘤在肝脏上的病灶表现相似,比如均有AFP升高,增强扫描均可呈“快进快出”方式,但是HCC大多具有肝炎、肝硬化的病史,并且很少出现胃转移瘤;极少数HCC亦可出现为转移,其胃部病灶较大时也可出现中心坏死,病变特点是侵犯胃浆膜层,呈结节状、膨胀性突向黏膜面,而HAS无肝炎、肝硬化的病史,胃部病灶侵犯胃黏膜上皮或腺体,由内到外向浆膜层浸润生长。
④恶性GIST病灶较大,其内可见坏死、囊变以及出血,多为胃壁宽基底相连的类圆形或分叶状软组织肿块,由向腔内或腔外生长,病灶累及黏膜下层、肌壁间或浆膜下层,但不侵犯黏膜层,而HAS是由黏膜层起源的恶性肿瘤;增强扫描GIST常明显强化,HAS轻-中度不均匀强化。
2.5临床治疗:HAS首选治疗方法是根治性手术治疗,根治性手术联合辅助化疗是的最佳治疗方法,可以延长患者的生存期。目前放射治疗、介入治疗、分子靶向药物(索拉非尼 )、免疫治疗等方法疗效无法准确评估,需要进一步的临床试验研究。HAS经过治疗后血清AFP水平通常会降低,如果AFP不降反升则提示肿瘤复发或转移,血清AFP的检测对于诊断、评估疗效及肿瘤复发具有重要意义。
)、免疫治疗等方法疗效无法准确评估,需要进一步的临床试验研究。HAS经过治疗后血清AFP水平通常会降低,如果AFP不降反升则提示肿瘤复发或转移,血清AFP的检测对于诊断、评估疗效及肿瘤复发具有重要意义。
本病例采用根治性手术治疗+靶向治疗+全身化疗,血清AFP水平逐渐下降,由刚开始2479.34IU/ml目前降低至39.67IU/ml,并且该患者治疗期间一般状况良好,预示着该治疗方法有效,这对未来研究HSA治疗方案提供一定的临床证据。
综上所述,HSA是一种罕见的特殊类型胃癌,典型CT表现为胃窦或胃体小弯侧的偏心性、突向腔内生长的软组织肿块,早期肝脏转移及淋巴结转移率高,血清AFP明显升高是其重要特征但不是必备特征,诊断还是依靠组织形态学和免疫组织化学特征来综合确诊。而影像学不一定能够提供有力证据,需要临床上结合患者年龄、CT表现、血清AFP水平、无肝炎及肝硬化病史,综合考虑到发生HAS的可能性,尽快进行组织病理学活检,对患者进行早期干预,提高生存质量。
来源:邓相容,彭涛,牛翔科,吕赛群,钟诗雨.胃肝样腺癌CT表现并文献复习1例[J].四川医学,2022,43(04):412-414.
