
副腮腺低级别导管内癌1例
作者:刘建山,王志兴,天津市第五中心医院口腔科;刘磐,武汉大学口腔生物医学教育部重点实验室;彭利伟,河南省人民医院(河南大学附属人民医院)口腔颌面外科
唾液腺低级别导管内癌(low-grade intraductal carcinoma,LGIDC)是一种罕见且不典型的唾液腺肿瘤 ,主要发生于腮腺,偶发生于颌下腺及小唾液腺。1996年Delgado等首次对此肿瘤描述并将其命名为低级别唾液腺导管癌。然而,大量临床病理报告显示:LGIDC和唾液腺导管癌(salivary duct carcinoma,SDC)在生长方式、细胞学形态、侵袭性等方面存在差异。
,主要发生于腮腺,偶发生于颌下腺及小唾液腺。1996年Delgado等首次对此肿瘤描述并将其命名为低级别唾液腺导管癌。然而,大量临床病理报告显示:LGIDC和唾液腺导管癌(salivary duct carcinoma,SDC)在生长方式、细胞学形态、侵袭性等方面存在差异。
因此世界卫生组织头颈部肿瘤分类(第3版)将其归为囊腺癌的变种——低度恶性筛状囊腺癌(low-grade cribriform cystadenocarcinoma,LGCC);而世界卫生组织头颈部肿瘤分类(第4版)又将LGCC和唾液腺导管原位癌统称为唾液腺导管内癌(intraductal carcinomas,IDC),两者分别为低级别和高级别。迄今为止,关于副腮腺LGIDC,国内外文献鲜有报道。本文报道1例副腮腺LGIDC,并回顾以往文献,探讨LGIDC的临床表现、诊断要点以及治疗方案,为临床诊治及后续研究提供参考。
1.病例报告
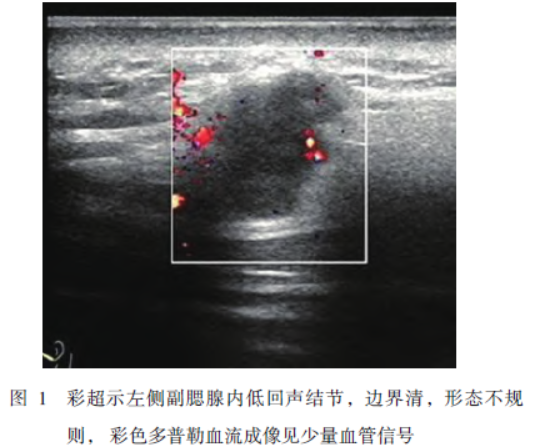
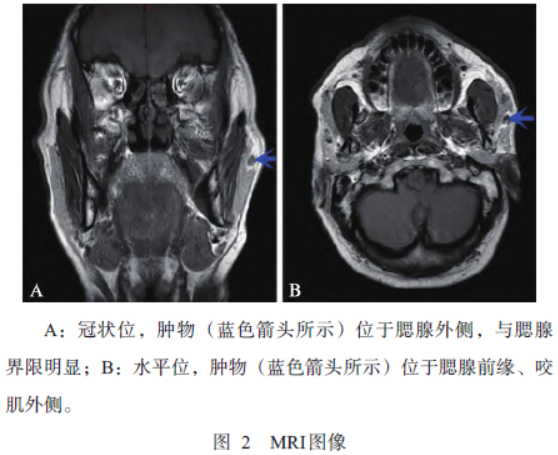
患者男性,48岁,2021年1月因“左面部肿物2月”入院。查体:左腮腺前缘可触及一大小约1cm×1cm的肿物,活动度可,质地中等,轻度压痛;患者无面神经功能障碍,双侧颈部未触及肿大淋巴结。彩超示:左副腮腺肿物(图1);MRI示:左腮腺前外上方小结节、与腮腺界限明显(图2)。
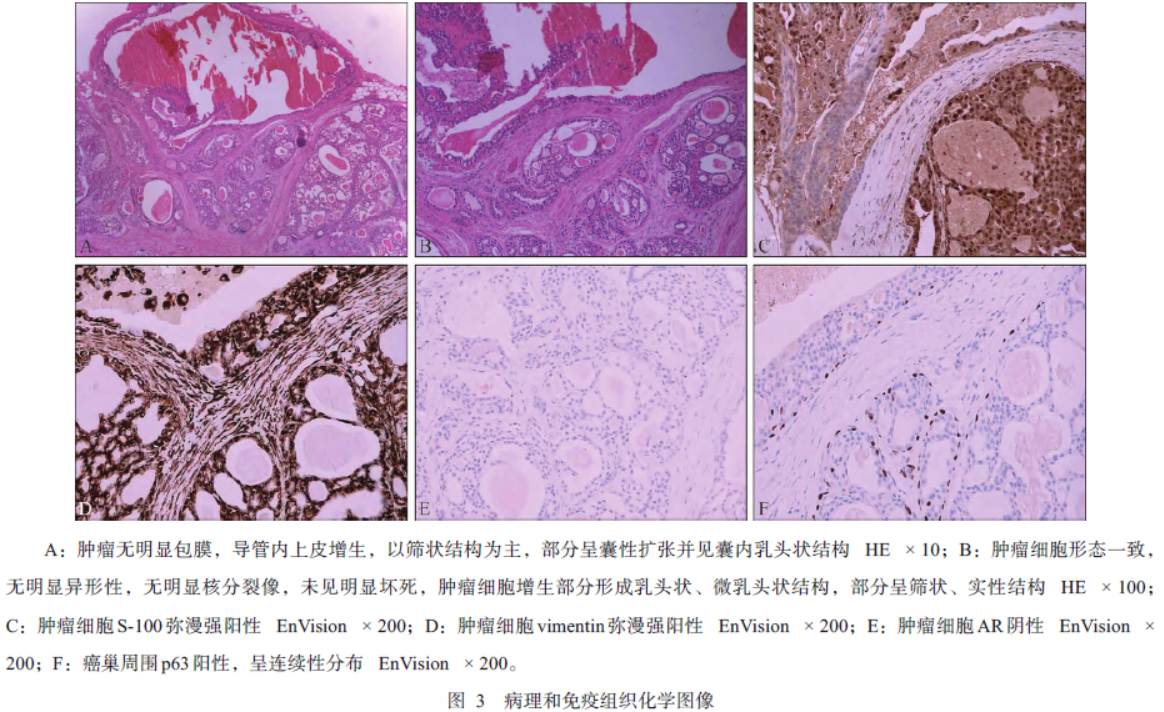
术中采取面中部切口将副腮腺连同瘤体一并切除。术中冰冻示:涎腺源性恶性肿瘤,切缘(-)。与患者家属沟通,进一步将创面周围0.5cm的组织扩大切除。术后病理诊断:低级别导管内癌(图3)。术后随访6月,患者无面神经损伤、涎瘘等并发症,肿物未见复发或转移。
2.讨论
LGIDC曾被命名为低级别SDC和LGCC,而世界卫生组织头颈部肿瘤分类(第4版)将其归为IDC的亚型,即低级别IDC。迄今为止,Pubmed数据库中文献所查询到的LGIDC仅50余例,而关于副腮腺LGIDC,目前尚未见相关报道,仅有1例副腮腺侵袭性腺癌被怀疑由LGIDC转化而来,但不能肯定。
本研究报道了1例副腮腺LGIDC。LGIDC多见于中老年患者,女性多见。系统回顾研究显示:超过80%的LGIDC位于腮腺,仅个别病例发生于颌下腺和小唾液腺。绝大多数LGIDC为局部无痛性包块,活动度良好,患者无明显自觉症状。到目前为止,Pubmed数据库中所报道的LGIDC病例中,仅3例患者伴有局部不适(肿胀、疼痛等)。
本报告中的LGIDC患者除局部轻度压痛外无任何自觉症状,这也与之前的报道一致,提示副腮腺与其他部位的LGIDC在临床表现上可能无差异。因LGIDC较为罕见且缺乏典型的临床表现,其诊断相对困难。以往多于术前行细针穿刺吸取活检(fine needle aspiration biopsy,FNAB)来明确诊断,以便制定手术方案,然而单纯依靠FNAB不足以确诊。
目前,LGIDC的诊断主要依靠组织病理学和免疫组织化学。组织病理学上,LGIDC边界清,无包膜,由紧密连接的导管上皮细胞构成,这些细胞可排列成实性、筛状、囊性,并伴有乳头和微乳头结构,较少侵犯周围组织,一般不发生坏死。细胞核大小一致,呈轻度异型性,但核分裂像罕见,胞质少可呈空泡状,有时肿瘤上皮可鳞状化生。
免疫组织化学方面,绝大多数LGIDC弥散性强表达S-100,雄激素受体(androgen receptor,AR)阴性,围绕囊腔的部位和肿瘤细胞巢的边缘可见肌上皮标志物(p63、SMA、calponin等)呈连续性表达,提示肿瘤周围肌上皮完整,肿瘤无周边浸润。需要说明的是,高级别IDC与LGIDC具有不同的免疫表型,即S-100阴性而AR阳性,可以鉴别。
本报告中的副腮腺肿瘤在组织病理学和免疫组织化学上表现为:肿瘤无明显包膜,由增生的导管上皮细胞构成,以筛状结构为主,部分呈囊性扩张并见囊内乳头状结构,细胞形态一致,无明显核分裂像;肿瘤细胞弥散性强表达S-100,AR阴性,癌巢周围p63阳性且呈连续性分布(图3),因此,可明确诊断为副腮腺LGIDC。手术切除是LGIDC的主要治疗手段。
Giovacchini等于2019年统计了Pubmed数据库中报道的54例LGIDC,有47例报告了治疗方案,均以手术切除为主,有6例涉及颈淋巴清扫或放化疗,术后仅有1例患者因切缘阳性而复发。在接受放化疗或颈淋巴清扫的6例LGIDC中,2例切缘阳性,1例瘤体内含有其他腺上皮癌成分,1例位于颌下腺且术前FNAB诊断为黏液表皮样癌。因此,Giovacchini得出结论:LGIDC预后良好,只要手术切缘阴性,术后无需放化疗;当怀疑有淋巴结转移时方考虑行颈淋巴清扫。
本报告中的LGIDC位于副腮腺,术前检查未发现肿大淋巴结,因此本研究小组采用副腮腺和瘤体一并扩大切除的治疗方案。目前副腮腺肿物的手术入路分为口外入路(S型切口入路、耳前切口入路、沿肿瘤表面的面中部切口入路)和口内入路,这些入路均有各自的优势和不足。
本报告中的病例选择了面中部切口入路,将副腮腺和瘤体一并切除,术中快速冰冻显示切缘阴性。术后随访半年,患者无神经损伤、涎瘘等并发症,肿瘤未见复发,再次验证了面中部切口治疗副腮腺肿瘤的安全有效性。尽管如此,本报告术后随访时间较短,远期疗效有待进一步观察。
世界卫生组织头颈部肿瘤分类(第4版)将LGCC和唾液腺导管原位癌统称为IDC。然而近几年的分子研究显示IDC并不是一个同质的实体,至少含有3个变种:闰管型、顶浆分泌型、混合型。三者具有不同的免疫表型和分子遗传学特点,其中闰管型S100+,AR-,具有NCOA4-RET基因融合;顶浆分泌型S100-,AR+,具有HRAS和PIK3CA点突变的遗传学特点,类似于SDC;混合型具有前两者共同的免疫表型(S100和AR均为阳性)和RET基因融合的分子遗传学特点,但通常是RET-TRIM27融合。
因此,关于IDC的命名和分类有待进一步研究和探讨。此外,分子靶向治疗已成为当下唾液腺肿瘤的研究热点,然而目前很少有研究探讨IDC的分子靶向治疗。相信随着研究的不断深入,将会填补这一空白。
来源:刘建山,刘磐,彭利伟,王志兴.副腮腺低级别导管内癌1例[J].华西口腔医学杂志,2022,40(05):606-609.
