
子宫内膜癌同时合并直肠、输卵管子宫内膜异位症恶变1例报道及文献复习
作者:陈畅乾,卢娟,张文,蒋玲等,南方医科大学附属珠海医院
一、病例资料
患者,女,51岁,体重55kg,身高156cm,体质 量指数(BMI)22.6kg/m2。因“腹痛、便秘 半月余” 于2022年6月27日在南方医科大学附属珠海医院 消化科就诊,末次月经:2022年6月14日。2022年 6月28日行肠镜
半月余” 于2022年6月27日在南方医科大学附属珠海医院 消化科就诊,末次月经:2022年6月14日。2022年 6月28日行肠镜 检查+活检,术后病理:(直肠)镜 下见浅表大肠黏膜组织,大部分腺体结构正常,局灶 见少许异型腺体,结合临床及免疫组化结果,考虑为 腺癌,宫内膜癌转移可能性大。免疫组化标记结果: CDX-2(-)、CK20(-)。妇科彩超:子宫肌层回声 不均,宫腔及宫颈管内见范围约6.7cm×2.3cm 不 均质回声团,内见稍高回声和低回声区,部分切面与 子宫中上段肌层分界不清,可见点条状血流信号,考 虑子宫内膜癌
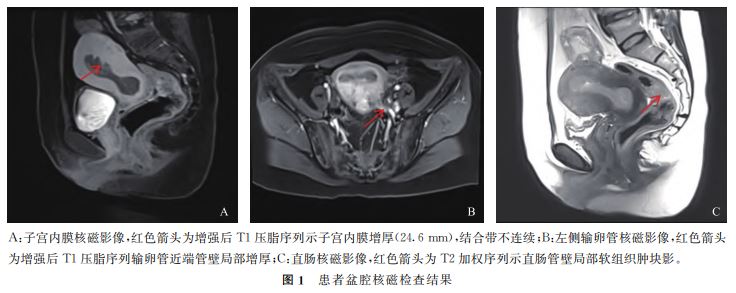
检查+活检,术后病理:(直肠)镜 下见浅表大肠黏膜组织,大部分腺体结构正常,局灶 见少许异型腺体,结合临床及免疫组化结果,考虑为 腺癌,宫内膜癌转移可能性大。免疫组化标记结果: CDX-2(-)、CK20(-)。妇科彩超:子宫肌层回声 不均,宫腔及宫颈管内见范围约6.7cm×2.3cm 不 均质回声团,内见稍高回声和低回声区,部分切面与 子宫中上段肌层分界不清,可见点条状血流信号,考 虑子宫内膜癌 待排。患者盆腔核磁检查结果显示: 子宫内 膜 不 均 匀 增 厚 (图 1A),考 虑 子 宫 内 膜 癌 (FIGOIB期)可能;双侧附件区囊性灶,左侧黄体囊 肿? 右侧系膜囊肿? 左侧输卵管近端增厚(图1B); 直肠-乙状结肠交界区肠壁偏心性环形增厚并占位, 并周围脂肪间隙散在小淋巴结,考虑恶性可能性大 (图1C)。2022年7月6日妇科行宫腔镜
待排。患者盆腔核磁检查结果显示: 子宫内 膜 不 均 匀 增 厚 (图 1A),考 虑 子 宫 内 膜 癌 (FIGOIB期)可能;双侧附件区囊性灶,左侧黄体囊 肿? 右侧系膜囊肿? 左侧输卵管近端增厚(图1B); 直肠-乙状结肠交界区肠壁偏心性环形增厚并占位, 并周围脂肪间隙散在小淋巴结,考虑恶性可能性大 (图1C)。2022年7月6日妇科行宫腔镜 检查+分段诊刮术,术后病理:(宫腔、宫颈管刮出物)宫内膜样腺癌, 高分化,伴鳞化。免疫组化标记结果:CDX-2(-)、 ER(+)、Ki-67(90% +)、MLH1(99% +)、MSH2 (99% + )、MSH6(99% + )、PMS2(99% + )、 PR(+)、Vimentin(+)。 2022年7月13日行腹腔镜
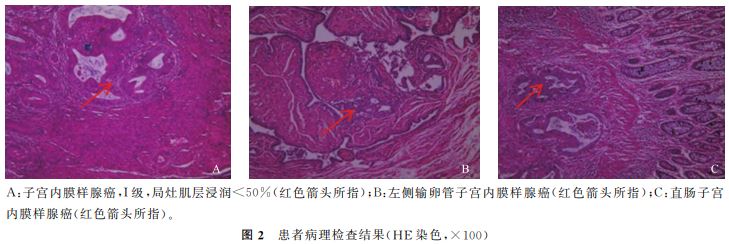
检查+分段诊刮术,术后病理:(宫腔、宫颈管刮出物)宫内膜样腺癌, 高分化,伴鳞化。免疫组化标记结果:CDX-2(-)、 ER(+)、Ki-67(90% +)、MLH1(99% +)、MSH2 (99% + )、MSH6(99% + )、PMS2(99% + )、 PR(+)、Vimentin(+)。 2022年7月13日行腹腔镜 下次广泛全子宫切 除+双附件切除+盆腔淋巴结切除术+腹主动脉旁 淋巴结切除术+腹腔镜直肠切除术+乙状结肠-直 肠吻合术+肠系膜淋巴结清扫术,术后病理:(1)(子 宫)高分化子宫内膜样腺癌,FIGOⅠ 级,伴灶性鳞 化,癌组织大部分局限于内膜层,局灶浸润至浅肌层 0.5mm(<50%(红色箭头所指);B:左侧输卵管子宫内膜样腺癌(红色箭头所指);C:直肠子宫 内膜样腺癌(红色箭头所指)。 图2 患者病理检查
下次广泛全子宫切 除+双附件切除+盆腔淋巴结切除术+腹主动脉旁 淋巴结切除术+腹腔镜直肠切除术+乙状结肠-直 肠吻合术+肠系膜淋巴结清扫术,术后病理:(1)(子 宫)高分化子宫内膜样腺癌,FIGOⅠ 级,伴灶性鳞 化,癌组织大部分局限于内膜层,局灶浸润至浅肌层 0.5mm(<50%(红色箭头所指);B:左侧输卵管子宫内膜样腺癌(红色箭头所指);C:直肠子宫 内膜样腺癌(红色箭头所指)。 图2 患者病理检查 结果(HE染色,×100) 目前子宫内膜异位症恶变
结果(HE染色,×100) 目前子宫内膜异位症恶变 (endometriosis-associated malignancies,EAM)尚无统一的治疗方案,以手术 治疗为主。在卵巢外的 EAM 患者中,特别是直肠 和阴道直肠隔病变的患者,局部病变容易复发,手术 联合术后放化疗是较合理的选择。鉴于该患者盆腔 多处 EAM,2022年9月至2023年5月共进行了6 程化 疗。第 1、2 程 给 予 紫 杉 醇 (380 mg)+ 卡 铂 (500mg),第 3~6 程 给 予 紫 杉 醇 210 mg+ 卡 铂 500mg,其中2022年11月至2023年1月间断进行 放疗25次,放化疗过程顺利。
(endometriosis-associated malignancies,EAM)尚无统一的治疗方案,以手术 治疗为主。在卵巢外的 EAM 患者中,特别是直肠 和阴道直肠隔病变的患者,局部病变容易复发,手术 联合术后放化疗是较合理的选择。鉴于该患者盆腔 多处 EAM,2022年9月至2023年5月共进行了6 程化 疗。第 1、2 程 给 予 紫 杉 醇 (380 mg)+ 卡 铂 (500mg),第 3~6 程 给 予 紫 杉 醇 210 mg+ 卡 铂 500mg,其中2022年11月至2023年1月间断进行 放疗25次,放化疗过程顺利。
二、讨论
子宫内膜异位症虽然是一种良性疾病,但有着 类似于恶性肿瘤的生物学行为,比如增殖过度、侵 袭、黏附、血管生成及容易复发,约0.7%~1%患者 有恶变风险[1]。约1%绝经前子宫内膜异位症妇女 和1% ~2.5% 绝 经 后 子 宫 内 膜 异 位 症 妇 女 会 发 生 EAM [2]。 EAM 的病理组织学诊断标准如下[3]:(1)在同 一器官中,癌组织与异位的子宫内膜组织同时存在; (2)排除原发于其他脏器的恶性肿瘤的转移性病变; (3)子宫内膜基质和周围的特征性子宫内膜腺体均 存在;(4)组织学可见良性的异位子宫内膜组织向恶 性渐进性移行转化的表现。EAM 常发生于性腺, 如卵巢的透明细胞癌、卵巢的子宫内膜样腺癌,性腺 外恶变十分罕见,已有过发生于盆腔腹膜、结直肠和 肝脏的报道[4-5]。 该患者子宫内膜、输卵管、直肠多处存在恶性病 灶,结合免疫组化及基因检测,子宫内膜癌灶和直肠癌 灶排除林奇综合征[6]所致;同时 CDX2 和 CK20 阴性,故直肠癌症排除肠道原发腺癌。本例患者子 宫内膜癌病理结果显示仅仅为局灶浸润至浅肌层约 0.5mm,未见明确脉管内癌栓及神经侵犯,淋巴结 阴性,考虑为子宫内膜癌早期,且宫腔镜术中左侧宫 角未见病灶累及,输卵管开口可见,故输卵管局部癌 灶不考虑是子宫内膜癌直接蔓延所致。由于子宫内 膜癌直接蔓延至肠道的一般表现为直肠浆膜层浸润 生长,内镜下黏膜病变轻微或不存在,而该患者病理 特点为直肠病灶浸润粘膜层至浆膜下层,未突破浆 膜面,故直肠病灶不考虑子宫内膜癌直接蔓延。盆 腹腔淋巴结均未见癌细胞,因此输卵管、直肠病灶不 考虑淋巴转移。此外,早期子宫内膜癌远处血行转 移播散部位主要在肺、肝、脑、骨骼[7],经血行转移至 直肠较为少见,目前尚未见报道。综上,直肠、输卵 管癌灶不考虑是子宫内膜癌转移所致。 目前,虽然子宫内膜异位症和子宫腺肌病被定 义为独立存在的两种疾病,但是基于两者临床表现 和组织病理学特点的相似性,学者们认为子宫内膜 异位症与子宫腺肌病是同一种疾病的不同病理生理 表现[8-9]。本例患者病理报告证实了患者有子宫腺 肌病,故存在子宫内膜异位症发生的可能性。研究 认为源自骨髓或子宫内膜基底层的干细胞可通过血 管或输卵管传播并在不同解剖部位分化为子宫内膜 组织[10]。子宫内膜异位症生殖器官外的受累部位 常见于胃肠道,膀胱、肺等,而卵巢外 EAM 的常见 部位为结直肠和盆腔腹膜[5]。本病例病理结果虽未 明示输卵管及直肠肿瘤组织中存在内膜间质或腺 体,不符合 EAM 第1条诊断标准,但大部分 EAM 病例报告很难满足第1条诊断标准,可能是因为组 织已萎缩或被癌组织破坏[5]。早期子宫内膜癌血行 转移至直肠极为罕见,同时该患者具有直肠子宫内 膜异位症的起始病因,所以左侧输卵管、直肠癌变不 考虑子宫内膜癌转移,而是考虑为多部位 EAM。 发生 EAM 的可能途径有:PI3K/AKT/mTOR 途径、RAS/MAPK 途径、染色质重塑、DNA 修复、 血管生成、表观遗传学和免疫失调等[11-12]。子宫内 膜癌 相 关 的 信 号 通 路 异 常 有:NF-κB 信 号 通 路、 PI3K/AKT/mTOR通路和 Wnt/β-catenin通路等[13-14]。 本病例病理结果为高分化子宫内膜样腺癌,左侧输 卵管、直肠高分化子宫内膜样腺癌(起源于子宫内膜 异位),其 基 因 检 测 结 果 提 示 PIK3CA、KRAS、 PTEN、ARID 基因发生突变。PI3K/AKT/mTOR 信号通路主要具有促增殖、抑凋亡、诱导自噬等作 用,当信号通路被异常激活后往往会导致肿瘤的发 生。PIK3是 P13-激酶的催化亚基,是恶性肿瘤中 最常见的突变基因。PTEN 有助于 PIK3CA 的活 化,PTEN 的编码产物是 PI3K/AKT/mTOR 信号 通路主要的负向调节因子[15],是肿瘤发生的关键因 子之一。PTEN 的突变及下调表达参与了子宫内 膜异位症的恶变,PTEN 突变或缺失也是内膜样癌 最显著的分子特征之一[16]。KRAS 突变可能发生 在子宫内膜癌变的早期阶段,是子宫内膜癌常见的 变异基 因 之 一[16]。突 变 体 KRAS 可 促 进 PI3K/ AKT的下调,导致细胞过度增殖,促进癌症发生[17]。 ARID 影响 DNA 复制、损伤修复及转录,导致染色 质重塑复合物的失调,从而可能以此方式参与 EAM 过程。ARID1A 是子宫内膜癌的潜在驱动基因,其 发生突变会导致PI3K/AKT通路激活[18]。PIK3CA、 PTEN、KRAS、ARID1A 催 化 结 构 域 的 改 变 可 能 导致 PI3K/AKT 通 路 激 活,故 而 推 测 PIK3CA、 PTEN、KRAS 可能通过相同的信号通路或基因靶 点同时参与了子宫内膜癌和EAM 过程。 子宫内膜异位症与卵巢癌的关系已被证实,而 子宫内膜异位症与子宫内膜癌的相关性仍存在争议 且相关研究较少。Painter等[19]对全基因组关联研 究数据集进行了分析,发现子宫内膜异位症和子宫 内膜癌具有相同的分子信号通路。根据该患者的基 因结果及上述分子细胞学研究,均提示子宫内膜癌 和 EAM 可能是具有相同的信号通路及基因位点, 使在位内膜和异位内膜同时癌变,两者可能具有一 定的关系。 EAM 化疗 药 物 的 有 效 性 及 药 物 选 择 尚 无 定 论,目前认为紫杉醇
灶排除林奇综合征[6]所致;同时 CDX2 和 CK20 阴性,故直肠癌症排除肠道原发腺癌。本例患者子 宫内膜癌病理结果显示仅仅为局灶浸润至浅肌层约 0.5mm,未见明确脉管内癌栓及神经侵犯,淋巴结 阴性,考虑为子宫内膜癌早期,且宫腔镜术中左侧宫 角未见病灶累及,输卵管开口可见,故输卵管局部癌 灶不考虑是子宫内膜癌直接蔓延所致。由于子宫内 膜癌直接蔓延至肠道的一般表现为直肠浆膜层浸润 生长,内镜下黏膜病变轻微或不存在,而该患者病理 特点为直肠病灶浸润粘膜层至浆膜下层,未突破浆 膜面,故直肠病灶不考虑子宫内膜癌直接蔓延。盆 腹腔淋巴结均未见癌细胞,因此输卵管、直肠病灶不 考虑淋巴转移。此外,早期子宫内膜癌远处血行转 移播散部位主要在肺、肝、脑、骨骼[7],经血行转移至 直肠较为少见,目前尚未见报道。综上,直肠、输卵 管癌灶不考虑是子宫内膜癌转移所致。 目前,虽然子宫内膜异位症和子宫腺肌病被定 义为独立存在的两种疾病,但是基于两者临床表现 和组织病理学特点的相似性,学者们认为子宫内膜 异位症与子宫腺肌病是同一种疾病的不同病理生理 表现[8-9]。本例患者病理报告证实了患者有子宫腺 肌病,故存在子宫内膜异位症发生的可能性。研究 认为源自骨髓或子宫内膜基底层的干细胞可通过血 管或输卵管传播并在不同解剖部位分化为子宫内膜 组织[10]。子宫内膜异位症生殖器官外的受累部位 常见于胃肠道,膀胱、肺等,而卵巢外 EAM 的常见 部位为结直肠和盆腔腹膜[5]。本病例病理结果虽未 明示输卵管及直肠肿瘤组织中存在内膜间质或腺 体,不符合 EAM 第1条诊断标准,但大部分 EAM 病例报告很难满足第1条诊断标准,可能是因为组 织已萎缩或被癌组织破坏[5]。早期子宫内膜癌血行 转移至直肠极为罕见,同时该患者具有直肠子宫内 膜异位症的起始病因,所以左侧输卵管、直肠癌变不 考虑子宫内膜癌转移,而是考虑为多部位 EAM。 发生 EAM 的可能途径有:PI3K/AKT/mTOR 途径、RAS/MAPK 途径、染色质重塑、DNA 修复、 血管生成、表观遗传学和免疫失调等[11-12]。子宫内 膜癌 相 关 的 信 号 通 路 异 常 有:NF-κB 信 号 通 路、 PI3K/AKT/mTOR通路和 Wnt/β-catenin通路等[13-14]。 本病例病理结果为高分化子宫内膜样腺癌,左侧输 卵管、直肠高分化子宫内膜样腺癌(起源于子宫内膜 异位),其 基 因 检 测 结 果 提 示 PIK3CA、KRAS、 PTEN、ARID 基因发生突变。PI3K/AKT/mTOR 信号通路主要具有促增殖、抑凋亡、诱导自噬等作 用,当信号通路被异常激活后往往会导致肿瘤的发 生。PIK3是 P13-激酶的催化亚基,是恶性肿瘤中 最常见的突变基因。PTEN 有助于 PIK3CA 的活 化,PTEN 的编码产物是 PI3K/AKT/mTOR 信号 通路主要的负向调节因子[15],是肿瘤发生的关键因 子之一。PTEN 的突变及下调表达参与了子宫内 膜异位症的恶变,PTEN 突变或缺失也是内膜样癌 最显著的分子特征之一[16]。KRAS 突变可能发生 在子宫内膜癌变的早期阶段,是子宫内膜癌常见的 变异基 因 之 一[16]。突 变 体 KRAS 可 促 进 PI3K/ AKT的下调,导致细胞过度增殖,促进癌症发生[17]。 ARID 影响 DNA 复制、损伤修复及转录,导致染色 质重塑复合物的失调,从而可能以此方式参与 EAM 过程。ARID1A 是子宫内膜癌的潜在驱动基因,其 发生突变会导致PI3K/AKT通路激活[18]。PIK3CA、 PTEN、KRAS、ARID1A 催 化 结 构 域 的 改 变 可 能 导致 PI3K/AKT 通 路 激 活,故 而 推 测 PIK3CA、 PTEN、KRAS 可能通过相同的信号通路或基因靶 点同时参与了子宫内膜癌和EAM 过程。 子宫内膜异位症与卵巢癌的关系已被证实,而 子宫内膜异位症与子宫内膜癌的相关性仍存在争议 且相关研究较少。Painter等[19]对全基因组关联研 究数据集进行了分析,发现子宫内膜异位症和子宫 内膜癌具有相同的分子信号通路。根据该患者的基 因结果及上述分子细胞学研究,均提示子宫内膜癌 和 EAM 可能是具有相同的信号通路及基因位点, 使在位内膜和异位内膜同时癌变,两者可能具有一 定的关系。 EAM 化疗 药 物 的 有 效 性 及 药 物 选 择 尚 无 定 论,目前认为紫杉醇 联合卡铂
联合卡铂 可应用于卵巢癌外的 EAM 患者。大部分学者认为卵巢外的 EAM 若为 局限于盆腔的病变,可从辅助盆腔放疗中获益[20]。 目前针对 EAM 多为个体化治疗,该患者术后接受 了规范的放化疗,治疗过程顺利,现随访观察中。 多部位 EAM 同时合并子宫内膜癌极其罕见, 通过本病例报道提示 EAM 与子宫内膜癌可能存在 关联性,临床上应对此类患者提高警惕。宫腔内、外 不同部位的子宫内膜组织是否通过相同的分子机制 导致内膜恶变尚有待进一步研究。
可应用于卵巢癌外的 EAM 患者。大部分学者认为卵巢外的 EAM 若为 局限于盆腔的病变,可从辅助盆腔放疗中获益[20]。 目前针对 EAM 多为个体化治疗,该患者术后接受 了规范的放化疗,治疗过程顺利,现随访观察中。 多部位 EAM 同时合并子宫内膜癌极其罕见, 通过本病例报道提示 EAM 与子宫内膜癌可能存在 关联性,临床上应对此类患者提高警惕。宫腔内、外 不同部位的子宫内膜组织是否通过相同的分子机制 导致内膜恶变尚有待进一步研究。
参考文献略。
来源:陈畅乾,卢娟,张文等.子宫内膜癌同时合并直肠、输卵管子宫内膜异位症恶变1例报道及文献复习[J].生殖医学杂志,2024,33(02):243-246.
