
红斑性肢痛症患儿术后持续镇痛治疗一例
作者:东淑珍,石翊飒,张伟,杨波,兰州大学第二医院麻醉手术科
患儿,男,12 岁,150 cm,40 kg,ASA Ⅱ级。因“双下肢红斑水肿 2 年,局部破溃伴疼痛加重3 个月”入院。患儿2 年前无明显诱因出现双足红斑水肿,无疼痛,就诊于当地医院后考虑皮炎待诊,未予特殊处理。
2 年,局部破溃伴疼痛加重3 个月”入院。患儿2 年前无明显诱因出现双足红斑水肿,无疼痛,就诊于当地医院后考虑皮炎待诊,未予特殊处理。
1 年前患儿无明显诱因出现双下肢红斑面积扩大,水肿加重,合并起水泡、破溃、皮温升高、剧烈疼痛,双下肢浸泡于冰水后疼痛明显缓解。患儿于外地就医,基因检测:SCN9A(+)C2572C>T,诊断为“红斑性肢痛症”,予以口服美西律 100 mg,疼痛能暂时缓解,后自行服用加巴喷丁
100 mg,疼痛能暂时缓解,后自行服用加巴喷丁 、普瑞巴林
、普瑞巴林 、卡马西平
、卡马西平 ,剂量不详,效果不佳后自行停药。3 个月前双下肢水肿破溃及疼痛明显加重,就诊于外地专科医院予以抗感染、镇痛、消肿后症状有所缓解,为进一步治疗于我院就诊。
,剂量不详,效果不佳后自行停药。3 个月前双下肢水肿破溃及疼痛明显加重,就诊于外地专科医院予以抗感染、镇痛、消肿后症状有所缓解,为进一步治疗于我院就诊。
既往无糖尿病史、无外伤史。查体:HR 123 次/分,BP 140 /90 mmHg,发育可,黑眼圈。胸部正位DR 片示:双肺未见明显异常,心影增大。ECG 示:窦性心动过速。血常规 示:Hb 99 g /L,Plt 559×109 /L,D-二聚体
示:Hb 99 g /L,Plt 559×109 /L,D-二聚体 1.08 μg /L。
1.08 μg /L。
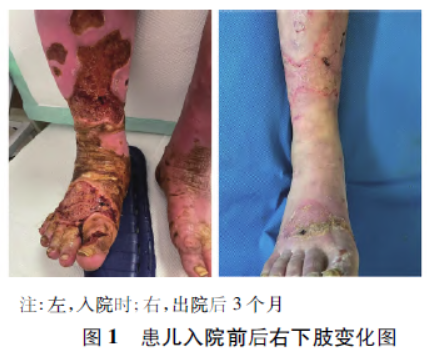
专科检查:双下肢膝关节以下可见非对称性红斑水肿,右下肢更为明显,伴右足背、足底、胫前可见大块不规则皮肤缺损,表面轻度渗出。双下肢中度触痛,皮温稍高,遇热痛觉 加重,VAS 疼痛评分7 分(图1)。诊断为:皮肤破溃,红斑性肢痛症,高血压。拟行“右下肢清创术、人工皮覆盖术”。
加重,VAS 疼痛评分7 分(图1)。诊断为:皮肤破溃,红斑性肢痛症,高血压。拟行“右下肢清创术、人工皮覆盖术”。
术前就诊于麻醉科门诊,考虑患儿病情特殊,疼痛敏感,建议术后予以2 周硬膜外镇痛缓解疼痛。入室时,患儿HR 100 次/分,BP 140 /90 mmHg,SpO2 98%。右侧卧位下行腰-硬联合麻醉,穿刺间隙为L3-4,蛛网膜下腔给予0.5%罗哌卡因 2 ml,硬膜外置管深度为4 cm,麻醉效果满意。术中静脉持续输注右美托咪定
2 ml,硬膜外置管深度为4 cm,麻醉效果满意。术中静脉持续输注右美托咪定 0.2μg·kg-1·h-1,患儿平稳入睡,手术时间2 h,术中出血
0.2μg·kg-1·h-1,患儿平稳入睡,手术时间2 h,术中出血 20ml,术后再次检查硬膜外置管通畅无脱出后清醒送回病房。
20ml,术后再次检查硬膜外置管通畅无脱出后清醒送回病房。
术后采用患者硬膜外自控镇痛(patient-controlled epidural analgesia,PCEA),配方:罗哌卡因75 mg、舒芬太尼 2.5 μg /kg加生理盐水稀释至200 ml,维持剂量8 ml /h,单次追加剂量6 ml,锁定时间15 min,同时口服美西律100 mg,间隔6 h。
2.5 μg /kg加生理盐水稀释至200 ml,维持剂量8 ml /h,单次追加剂量6 ml,锁定时间15 min,同时口服美西律100 mg,间隔6 h。
术后2 h 患儿发生硬膜外导管脱出,灼烧痛剧烈,情绪激动,大汗淋漓,口服美西律及镇痛药物未见缓解,分次给予咪达唑仑 2 mg、舒芬太尼10 μg 后疼痛未见缓解,VAS 疼痛评分10 分,嘱患儿侧卧位后于L2-3重新置管给予试验量1%利多卡因
2 mg、舒芬太尼10 μg 后疼痛未见缓解,VAS 疼痛评分10 分,嘱患儿侧卧位后于L2-3重新置管给予试验量1%利多卡因 3 ml,5 min 后患儿疼痛完全缓解并入睡,增加镇痛泵内罗哌卡因剂量至150 mg,其余剂量及浓度保持不变。
3 ml,5 min 后患儿疼痛完全缓解并入睡,增加镇痛泵内罗哌卡因剂量至150 mg,其余剂量及浓度保持不变。
患儿病情平稳,未出现急性疼痛,VAS 疼痛评分2 ~ 3 分,未出现下肢无力、尿潴留、便秘 等症状,每日对患儿硬膜外置管处予以消毒、重新固定。术后第5 天硬膜外置管处消毒时发现局部红肿并有少量白色分泌物,拔除硬膜外置管并予以消毒及红光照射治疗。
等症状,每日对患儿硬膜外置管处予以消毒、重新固定。术后第5 天硬膜外置管处消毒时发现局部红肿并有少量白色分泌物,拔除硬膜外置管并予以消毒及红光照射治疗。
因患儿和家属强烈要求继续予以镇痛,考虑患儿存在硬膜外置管禁忌证,改为患者静脉自控镇痛(patient-controlled intravenous analgesia,PCIA),配方:氢吗啡酮 0.3 mg /kg、纳布啡
0.3 mg /kg、纳布啡 1 mg /kg 加生理盐水稀释至200 ml,维持剂量2 ml /h,追加剂量2 ml,锁定时间15 min,患儿精神正常,未发生急性疼痛,VAS 疼痛评分2 ~ 3 分,未发生恶心、呕吐、尿潴留、便秘和皮肤瘙痒。
1 mg /kg 加生理盐水稀释至200 ml,维持剂量2 ml /h,追加剂量2 ml,锁定时间15 min,患儿精神正常,未发生急性疼痛,VAS 疼痛评分2 ~ 3 分,未发生恶心、呕吐、尿潴留、便秘和皮肤瘙痒。
术后第8 天全麻下行“右下肢清创术、头部中厚皮片取片术、自体皮移植术”。入室生命体征:HR 95 次/分,BP130 /75 mmHg,SpO2 98%,术中无特殊,手术结束前30 min 予以酮铬酸丁三醇15 mg,术后继续使用上述剂量的PCIA,患儿未发生急性疼痛并入睡良好,黑眼圈明显好转。
术后14 d患儿病情明显好转,VAS 疼痛评分1 ~ 2 分,美西律的服用间隔时间延长为8 h,BP 降至125 /80 mmHg,HR 降至80次/分,减少阿片类药物的使用,PCIA 配方调整为:舒芬太尼2.5 μg /kg、纳布啡1 mg /kg、酮咯酸丁三醇1.5 mg /kg 加生理盐水稀释至200 ml,维持剂量2 ml /h,追加剂量2 ml,锁定时间15 min,VAS 疼痛评分1~ 2 分。术后16 d,PCIA 配方更改为:舒芬太尼1.25 μg /kg、纳布啡1 mg /kg、酮咯酸丁三醇1.5 mg /kg,容量及速度不变,VAS 疼痛评分1 ~ 2 分。术后19 d,PCIA 配方更改为:纳布啡2 mg /ml、酮咯酸丁三醇3mg /ml,容量及速度不变,VAS 疼痛评分1 ~ 2 分,HR、BP 无异常。
术后21 d 镇痛泵配方更改为生理盐水200 ml,患儿当日夜间易醒、轻度焦虑,予以心理安慰治疗。术后23 d 停用PCIA,VAS 疼痛评分1~ 2 分。术后24 d 患儿伤口愈合良好,准予出院。出院后3 个月复查,溃疡面愈合良好,疼痛较以前明显缓解,能穿上鞋袜行走,黑眼圈消失(图1)。
讨论
红斑性肢痛症是一种罕见的疾病,该病的发病率为1.3 /100 000,女性发病率偏高。2004 年Yang 等首次发现致病基因SCN9A 基因定位2 号染色体 7.94 cm 区域,编码电压门控钠离子通道Nav1.7。钠离子通道是一种完整的膜蛋白,它由一个控制电压敏感性及离子通透性的α 大亚基和一个控制电压依赖性及动力依赖性的β 小亚基组成。目前根据α 亚基的构象不同,总共有9 种亚型的Nav(Nav1.1—1.9),每个亚型都具有独特的中枢和外周神经系统分布。
7.94 cm 区域,编码电压门控钠离子通道Nav1.7。钠离子通道是一种完整的膜蛋白,它由一个控制电压敏感性及离子通透性的α 大亚基和一个控制电压依赖性及动力依赖性的β 小亚基组成。目前根据α 亚基的构象不同,总共有9 种亚型的Nav(Nav1.1—1.9),每个亚型都具有独特的中枢和外周神经系统分布。
Nav1.7 在外周神经系统中高表达,包括背根神经节神经元、交感神经节神经元、嗅觉感觉神经元,该通道在传导痛觉及嗅觉信号通路中发挥着重要的作用,故对Nav1.7 编码的基因突变导致了机体对疼痛的感知异常。临床表现为四肢末端皮温升高伴灼烧样疼痛,遇热疼痛加剧,遇冷缓解。目前此病无明确的治疗方案,主要通过药物治疗和非药物治疗联合应用,但个体差异性较大。
另有侵入性治疗如交感神经阻滞、硬膜外阻滞、交感神经离断术等方法可明显缓解疼痛。本例患儿第1 次手术后2 h 由于硬膜外置管脱出,发生剧烈疼痛,静脉推注舒芬太尼10 μg 后疼痛未见缓解,再次硬膜外置管后给予1%利多卡因后患儿的疼痛瞬间缓解并入睡。其原因可能为术后当天,术区因手术应激释放大量炎性因子刺激痛觉伤害感受器,合并红斑性肢痛症疾病的病理性疼痛,导致疼痛信号的持续放大,正常治疗量的镇痛药物对其无效。
而硬膜外注射局麻药后背根神经节的伤害性感受传导及交感神经的兴奋性被阻断,且抑制了疼痛的中枢敏化,表现为患儿的急性疼痛的瞬间缓解、心率和血压的下降。氢吗啡酮复合纳布啡用于术后镇痛可明显减少氢吗啡酮的使用剂量,延长氢吗啡酮的作用时间,减少氢吗啡酮的呼吸抑制作用。Raghav 等研究表明,阿片类长期合用纳布啡可减弱阿片类药物依赖性的发展。
有文献报道,通过鞘内注射氢吗啡酮治疗继发性红斑性肢痛症,但静脉使用氢吗啡酮治疗红斑性肢痛症并未见报道。Balyan 等研究表明,氢吗啡酮用于患儿PCIA,负荷量15 μg /kg,PCA 量为6 μg /kg,间隔时间为20 min 为最有效的安全剂量。患儿此次PCIA 氢吗啡酮的负荷量为6 μg /kg,PCA 量为3μg /kg,远低于Balyan 等的推荐剂量且镇痛效果满意,进一步显示氢吗啡酮复合纳布啡用于术后镇痛可以明显减少氢吗啡酮的用量。
患儿整个病程给予氢吗啡酮24 mg,持续9 d,在停用氢吗啡酮后并未发生戒断反应,表明纳布啡长期与阿片类合用可以减少患者对阿片类药物的依赖性,与Raghav 等研究结果一致。为避免患儿长期使用同一类阿片类药物产生阿片类药物依赖及突然停药后发生戒断症状,术后14 d 将氢吗啡酮换为舒芬太尼0.5 μg /ml,复合应用纳布啡0.2 mg /ml 和酮咯酸丁三醇0.3 mg /ml。
复合应用纳布啡和非甾体类抗炎药可减少舒芬太尼的用量及不良反应,还可避免发生镇痛不足。本例患儿未发生急性疼痛及其他阿片类药物易导致的不良反应,VAS 疼痛评分1 ~ 2 分,HR 和BP 波动在正常范围,停用镇痛药物后患儿有轻度睡眠障碍 和焦虑,但是予以心理安慰治疗后恢复。
和焦虑,但是予以心理安慰治疗后恢复。
原发性红斑性肢痛症是一种难治性的基因疾病,在药物治疗无效的情况下可选择硬膜外置管持续泵注罗哌卡因,本例患儿使用0.075%罗哌卡因复合舒芬太尼0.5 μg /ml,可缓解患儿的急性疼痛并不影响其活动,可以为临床诊疗提供参考。
后期因为硬膜外置管并发症停用PCEA,镇痛方案调整为PCIA 氢吗啡酮复合纳布啡,镇痛效果良好且未出现不良反应,为避免长期使用氢吗啡酮对其产生耐受及依赖,将氢吗啡酮更换为舒芬太尼,复合应用酮铬酸丁三醇,停药后患儿无明显戒断反应,患儿及家属满意度高。对于难治性的红斑肢痛症患者可尝试PCIA,采用阿片类药物(氢吗啡酮或者舒芬太尼)复合纳布啡并联合非甾体类抗炎药物,缓解患者急性疼痛,从而使其配合治疗,提高治愈成功率。
来源:东淑珍,石翊飒,张伟等.红斑性肢痛症患儿术后持续镇痛治疗一例[J].临床麻醉学杂志,2023,39(10):1119-1120.
