
急性感染性心内膜炎儿童的三尖瓣修复术麻醉管理1例并文献复习
作者:石贇,复旦大学附属儿科医院麻醉科
1.病例
患儿,女,11 岁,37 kg。因“体检发现先天性心脏病 4 月余”于2023 年3 月24 日入院。入院后心脏超声显示室间隔缺损、房间隔缺损、三尖瓣瓣膜增厚返流、肺动脉高压,因患儿免疫学检查异常而转入风湿科。临床诊断为系统性红斑狼疮
4 月余”于2023 年3 月24 日入院。入院后心脏超声显示室间隔缺损、房间隔缺损、三尖瓣瓣膜增厚返流、肺动脉高压,因患儿免疫学检查异常而转入风湿科。临床诊断为系统性红斑狼疮 (systemic lupus erythematosus,SLE),狼疮性肾炎,狼疮性血液系统损害(重度活动状态),遂给予规律抗SLE 治疗及其他对症治疗,但效果欠佳,病情反复处于重度活动期。
(systemic lupus erythematosus,SLE),狼疮性肾炎,狼疮性血液系统损害(重度活动状态),遂给予规律抗SLE 治疗及其他对症治疗,但效果欠佳,病情反复处于重度活动期。
术前5 周随访心脏超声检查,提示三尖瓣3 个瓣叶均见赘生物。CT 提示左肺渗出,诊断为急性感染性心内膜炎 (subacute bacterial endocarditis, SBE),予以升级抗生素长疗程足量抗感染治疗。此后患儿免疫指标有所好转,但仍反复高热,随访血常规
(subacute bacterial endocarditis, SBE),予以升级抗生素长疗程足量抗感染治疗。此后患儿免疫指标有所好转,但仍反复高热,随访血常规 C 反应蛋白(CRP)和白细胞持续升高,胸片提示渗出无明显好转。
C 反应蛋白(CRP)和白细胞持续升高,胸片提示渗出无明显好转。
术前3 周患儿出现胸痛 症状,血管超声检查发现右侧颈内静脉与锁骨下静脉交汇处的管壁周围有沉积物、腋静脉内实质占位,CT 发现双侧下肺动脉分支有多发栓塞,遂开始抗凝治疗。术前1 周心脏超声检查发现三尖瓣附着物变大、三尖瓣返流增加、心脏增大
症状,血管超声检查发现右侧颈内静脉与锁骨下静脉交汇处的管壁周围有沉积物、腋静脉内实质占位,CT 发现双侧下肺动脉分支有多发栓塞,遂开始抗凝治疗。术前1 周心脏超声检查发现三尖瓣附着物变大、三尖瓣返流增加、心脏增大 、心包积液(图1),术前1 d 患儿出现心率加快、少尿、呼吸困难
、心包积液(图1),术前1 d 患儿出现心率加快、少尿、呼吸困难 等表现,考虑到内科治疗效果欠佳与持续等待存在的风险,决定行外科手术治疗。
等表现,考虑到内科治疗效果欠佳与持续等待存在的风险,决定行外科手术治疗。
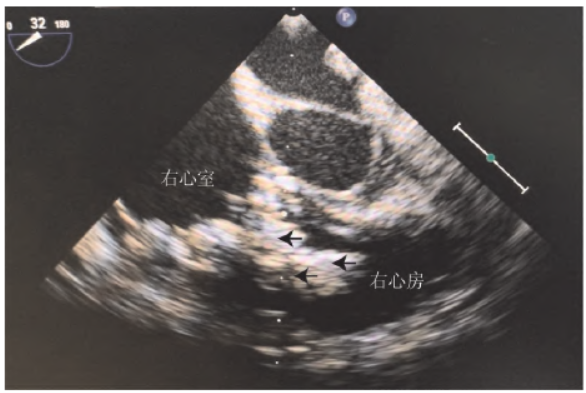
图1 术前超声心动图 检查
检查
由心脏专科麻醉医师携抢救药物将患儿接入手术室,期间持续吸氧和心电监护,换床时避免对患儿产生碰撞。入室后监测经皮氧饱和度95%左右(吸纯氧),心率150 次/ min(窦性心律),无创血压145/98 mmHg,检查并准备血管活性药物:心脏监护病房(cardiac care unit,CCU)带入多巴酚丁胺 5 μg/ kg/ min,奥普立农0.3 μg/ kg/ min,加用多巴胺
5 μg/ kg/ min,奥普立农0.3 μg/ kg/ min,加用多巴胺 5 μg/ kg/ min。
5 μg/ kg/ min。
采用2% 七氟烷 吸入诱导直至患儿瞬睫反射消失,给予1 mg/ kg 罗库锈铵充分肌松后插管,听诊对称后固定气管导管。建立有创监测,心率= 150 次/ min,心排指数(cardiac index,CI) = 3.41,动脉血压波形收缩期最大上升斜率(dP/ dT) = 0.68,有创动脉血压(invasive blood pressure,IBP) = 110 /88 mmHg,中心静脉压(central venous pressure,CVP) = 15cmH2O。
吸入诱导直至患儿瞬睫反射消失,给予1 mg/ kg 罗库锈铵充分肌松后插管,听诊对称后固定气管导管。建立有创监测,心率= 150 次/ min,心排指数(cardiac index,CI) = 3.41,动脉血压波形收缩期最大上升斜率(dP/ dT) = 0.68,有创动脉血压(invasive blood pressure,IBP) = 110 /88 mmHg,中心静脉压(central venous pressure,CVP) = 15cmH2O。
术中2% 七氟烷维持,分次给予芬太尼 达30ug/ kg。在外科医生打开心包时病人发生室上性心动过速,心律220 次/ min,血压60 ~ 70/30 ~40 mmHg,给予心脏表面冷水刺激、按压眼球、静脉利多卡因注射肝素
达30ug/ kg。在外科医生打开心包时病人发生室上性心动过速,心律220 次/ min,血压60 ~ 70/30 ~40 mmHg,给予心脏表面冷水刺激、按压眼球、静脉利多卡因注射肝素 2 mg/ kg,均没有明显改善,在此过程中迅速肝素化、插管建立体外循环注射心脏停跳液。打开心脏见三尖瓣的3 个瓣叶均布满黄白色赘生物与瓣叶无法分离,右心室面也可见赘生物(图2),遂行三尖瓣瓣叶切除、三尖瓣成形、心内结构畸形纠治。
2 mg/ kg,均没有明显改善,在此过程中迅速肝素化、插管建立体外循环注射心脏停跳液。打开心脏见三尖瓣的3 个瓣叶均布满黄白色赘生物与瓣叶无法分离,右心室面也可见赘生物(图2),遂行三尖瓣瓣叶切除、三尖瓣成形、心内结构畸形纠治。
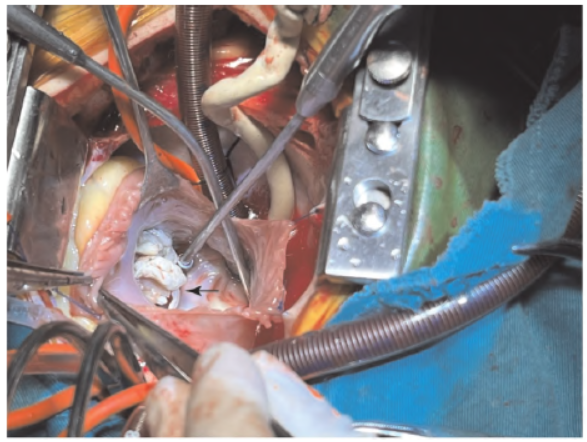
图2 术中暴露三尖瓣上附着的赘生物
开放主动脉后心脏顺利恢复窦性心律,根据监测调节血管活性药物用量:肾上腺素 0.05μg/ kg/ min,多巴胺15 μg/ kg/ min,米力农0.3μg/ kg/ min,维持IBP =90 ~100/50 ~60 mmHg,CI=2.3 ~ 3,CVP = 10 ~ 15 cmH2O,dP/ dT = 0.5 ~0.6,遂关胸转入CCU 继续治疗,手术时间4.5 h,体外循环时间193 min,主动脉阻断时间137 min,输少浆血300 mL、血浆200 mL、冷沉淀100mL。
0.05μg/ kg/ min,多巴胺15 μg/ kg/ min,米力农0.3μg/ kg/ min,维持IBP =90 ~100/50 ~60 mmHg,CI=2.3 ~ 3,CVP = 10 ~ 15 cmH2O,dP/ dT = 0.5 ~0.6,遂关胸转入CCU 继续治疗,手术时间4.5 h,体外循环时间193 min,主动脉阻断时间137 min,输少浆血300 mL、血浆200 mL、冷沉淀100mL。
术后赘生物送宏基因公司检测,发现血链球菌,病理显示符合感染性心内膜炎。术后第2 天拔管,根据病人情况静脉血管活性药物逐渐减停,改口服地高辛 、福辛普利
、福辛普利 呋塞米
呋塞米 、螺内酯、非洛地平
、螺内酯、非洛地平 等药物,术后10 d 从心脏监护病房转入普通心脏科病房,术后17 d 转入风湿科病房。
等药物,术后10 d 从心脏监护病房转入普通心脏科病房,术后17 d 转入风湿科病房。
2.讨论
虽然感染性心内膜炎的发病率仅3 ~ 15/100 000,但其病死率高达8.5%。近年来感染性心内膜炎的发病率有所上升,其中约一半患者具有手术指针。风湿性瓣膜病、先天性心脏病、退化性瓣膜疾病、心脏内人工植入物等是感染性心内膜炎最常见的风险因素。
研究显示抗磷脂抗体 阳性和免疫炎性反应是发生风湿性瓣膜损害的重要风险因素。本例患者诊断为SLE 并长时间反复处于重度活动期,患儿同时具有瓣膜受损、原发与继发免疫功能紊乱、先天性心脏病等感染性心内膜炎风险因素,因此术前尚不能完全确定三尖瓣赘生物的性质,很可能SLE 相关的非细菌性血栓性心内膜炎(Libman-Sacks 赘生物)与感染性心内膜炎两者同时存在。
阳性和免疫炎性反应是发生风湿性瓣膜损害的重要风险因素。本例患者诊断为SLE 并长时间反复处于重度活动期,患儿同时具有瓣膜受损、原发与继发免疫功能紊乱、先天性心脏病等感染性心内膜炎风险因素,因此术前尚不能完全确定三尖瓣赘生物的性质,很可能SLE 相关的非细菌性血栓性心内膜炎(Libman-Sacks 赘生物)与感染性心内膜炎两者同时存在。
在针对SLE 与细菌感染均采取相应治疗后,SLE 疾病活动的相关指标有所好转,但赘生物大小、瓣膜返流、心功能等未改善甚至有所进展,结合感染相关指标持续升高无好转,考虑SBE 为当前主要矛盾。由于患儿临床相关症状并无好转,因此无论赘生物性质如何均应尽快手术。
感染性心内膜炎因累及瓣膜可能造成严重的血流动力学障碍,本例患者由于重度- 极重度三尖瓣返流,右房显著增大,继而出现心功能不全,主要表现为体循环瘀血导致的肝脾肿大、腹水 、心包积液,左心前负荷不足导致的心动过速、少尿等;当病原体(如激活的免疫复合物、炎症细胞、细菌等)聚集附着在受损瓣膜上之后,血小板和纤维蛋白也会附着上去,随着病情的进展,赘生物增大脱落,不仅会毁损周围的心脏组织,其他器官也会因栓子梗塞而被累及,因此本例患儿还表现为部分肺梗塞的症状。
、心包积液,左心前负荷不足导致的心动过速、少尿等;当病原体(如激活的免疫复合物、炎症细胞、细菌等)聚集附着在受损瓣膜上之后,血小板和纤维蛋白也会附着上去,随着病情的进展,赘生物增大脱落,不仅会毁损周围的心脏组织,其他器官也会因栓子梗塞而被累及,因此本例患儿还表现为部分肺梗塞的症状。
急性感染性心内膜炎为严重的全身性疾病,有较高的死亡率,研究认为救治这些患者应当采取多学科综合治疗,成立专门的感染性心内膜炎诊治团队可以改善此类病人的预后。在本例患儿的治疗过程中组织过至少3 次大规模的多学科讨论,风湿科、心内科、感染科、心外科、影像学科、药剂科、麻醉科等均参与了患儿的诊治讨论,以期全面评估患者状况并做最为合理的决策。分析围术期麻醉相关要点如下:
(1)心血管系统:40% SBE 患者可能因心功能不全而出现血流动力学不稳定,常见的原因包括瓣膜关闭不全、瓣叶毁损、瓣环水平的梗阻、传导阻滞、脱落栓子进入冠脉发生急性冠脉综合征,当病人合并感染性休克时,血流动力学指标可能更难以管理。本例患儿发生左右心功能不全可能的原因包括:受累三尖瓣返流、回心血量受阻、肺梗死、左心前负荷不够等。因此在麻醉过程中积极使用肾上腺素、多巴胺、米力农等血管活性药物和正性肌力药,维持CVP 为10 ~ 15cmH2O,改善通气条件避免高碳酸血症、积极纠正酸中毒,从而达到维持心肌收缩力、前负荷,避免后负荷增加、肺动脉高压的目的。
另一方面,本例患儿在开胸后出现了新发的室上性心动过速,可能与显著增大的右心房受手术刺激有关,由于血压尚可维持,且很快建立体外循环和心脏停跳,并未进行电除颤。有研究认为新出现的心律失常是术后心衰与死亡的风险因素,幸运的是本例患儿重新复跳后并未再出现心律失常。
SBE 患者术后发生血管麻痹的风险增加,导致术后血流动力学不稳定、低心排血量和死亡率增加,术前即存在器官功能不全的病人通常术后需要大剂量血管活性药物,本例患儿术前已有心功能不全和呼吸功能不全的表现,入室后即积极使用血管活性药物,出室时患儿仍需要比较大剂量药物维持循环,计算以下公式得出血管活性药物剂量为:多巴胺15 μg/ kg/ min + 米力农0.3 μg/ kg/min ×10 + 肾上腺素0.05 μg/ kg/ min × 100 = 23。但是目前并不清楚哪些正性肌力药或血管加压药在这些病人的循环管理中更具有优势,通常根据各中心的经验或专家共识做出选择。
本例患儿根据心率、ABP、CVP、CI、dp/ dt 等监测结果调整药物剂量,并且准备好体外膜肺支持来应对术后难以纠治的心功能不全。虽然术前的CT、心电图 与心脏超声检查等评估未发现冠状动脉梗塞,由于患儿有房缺,并且右房高压造成房间隔水平的右向左分流,因此三尖瓣赘生物脱落后仍有可能进入冠状动脉,术中应持续关注心电图变化。
与心脏超声检查等评估未发现冠状动脉梗塞,由于患儿有房缺,并且右房高压造成房间隔水平的右向左分流,因此三尖瓣赘生物脱落后仍有可能进入冠状动脉,术中应持续关注心电图变化。
(2)肾脏:大约30% SBE 病人会发生急性肾功能不全或肾功能损伤,这也被认为是不良预后的征兆。常见原因包括免疫复合物引起的肾小球肾炎(占大约80%)、脱落的栓子造成肾梗死、抗生素的肾脏损害等,本例患者术前1 d 的24 h 尿量 330 mL(0.4 mL/ kg/ h),发生了急性肾功能不全。其可能原因:狼疮肾长期处于重度活动期、使用多种抗生素造成肾脏损害,以及术前心功能不全加重肾脏灌注不足。
330 mL(0.4 mL/ kg/ h),发生了急性肾功能不全。其可能原因:狼疮肾长期处于重度活动期、使用多种抗生素造成肾脏损害,以及术前心功能不全加重肾脏灌注不足。
术中肾功能的保护主要是对因治疗,如避免使用具有肾毒性的药物,术前使用免疫制剂控制SLE 活动,维持血压增加肾脏灌注,与药学专家商讨后选择合适的抗生素种类并调整剂量等。
(3)出凝血功能:SBE 与出凝血功能之间有非常复杂的关系:当内皮细胞识别细菌并被激活后,组织因子被释放并激活外源性凝血途径,而凝血因子XII 被激活则激活内源性凝血途径,此后凝血级联反应被激活,凝血酶原、血小板、纤维蛋白原等被依次激活,而血小板和纤维蛋白也是SBE 赘生物的主要组成部分。可见,SBE 与高凝状态可互为因果、互相促进病程的进展,并最终造成栓塞事件。
除了上述术前高凝状态的调整,长时间的手术和体外循环后则可能增加出血、输注血制品(包括血小板)甚至凝血障碍的风险。因此,SBE 患者出凝血的管理通常需要权衡出血和血栓的风险,特别是术前正积极抗凝的病人。据报道某些发生脓毒血症的重症SBE 患者中,高凝状态可能在术后转为弥漫性血管内凝血(DIC),因此,其管理无疑更为复杂并且死亡率也更高,最好根据出凝血时间 结果个体化地制定出凝血治疗方案。
结果个体化地制定出凝血治疗方案。
本例患者术前多次检查出凝血功能,结果显示D2 聚体、纤维蛋白原、纤维蛋白降解产物 均显著升高,提示患儿处于高凝状态,因此在发现瓣膜赘生物与其他血管器官栓塞后,皮下注射低分子肝素钙进行抗凝治疗。在体外循环前给予常规剂量肝素并且间断根据激活全血凝固时间(activated clotting time,ACT)结果追加,使体外循环期间ACT > 480 s,患儿并未有肝素抵抗的表现。据报道,对肝素抵抗的病人可以采取增加肝素剂量、抗凝血酶、新鲜冰冻血浆等方法。体外循环结束后根据血栓弹力图
均显著升高,提示患儿处于高凝状态,因此在发现瓣膜赘生物与其他血管器官栓塞后,皮下注射低分子肝素钙进行抗凝治疗。在体外循环前给予常规剂量肝素并且间断根据激活全血凝固时间(activated clotting time,ACT)结果追加,使体外循环期间ACT > 480 s,患儿并未有肝素抵抗的表现。据报道,对肝素抵抗的病人可以采取增加肝素剂量、抗凝血酶、新鲜冰冻血浆等方法。体外循环结束后根据血栓弹力图 (图3)、ACT 及血气分析的结果给患儿输注了少浆血、血浆与冷沉淀。
(图3)、ACT 及血气分析的结果给患儿输注了少浆血、血浆与冷沉淀。
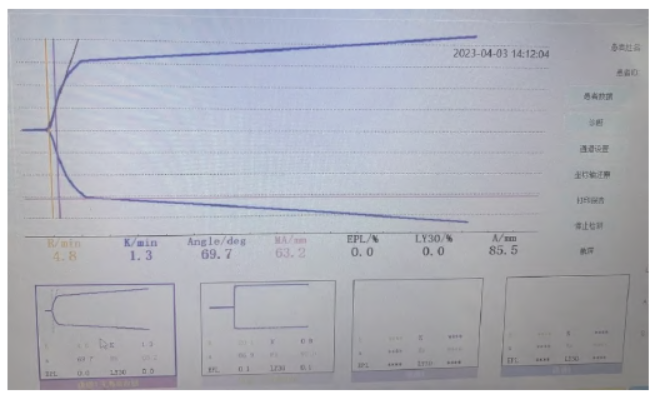
图3 术中血栓弹力图检查结果
(4)脑血管病发症:SBE 患者脑血管并发症的发生率高达25%,通常被认为是最棘手的并发症,最常见的表现包括缺血性卒中、脑出血 、硬膜下出血、脑膜炎、脑脓肿
、硬膜下出血、脑膜炎、脑脓肿 等。当SBE 患者出现脑血管病发症时,治疗将更复杂,如合并缺血性脑卒中的患者可能需要更高的脑灌注压、合并出血时患者应用抗凝药可能加剧出血,因此这些患者手术时机选择可能非常困难。本例患儿的赘生物主要在三尖瓣,因此受累器官均为肺循环系统(包括颈内静脉和肺动脉),术前临床症状与脑CT 均无脑受累表现。但由于心脏超声检查在房缺处探及双向分流,因此须警惕新发生体循环系统的栓塞,特别是脑血管并发症。
等。当SBE 患者出现脑血管病发症时,治疗将更复杂,如合并缺血性脑卒中的患者可能需要更高的脑灌注压、合并出血时患者应用抗凝药可能加剧出血,因此这些患者手术时机选择可能非常困难。本例患儿的赘生物主要在三尖瓣,因此受累器官均为肺循环系统(包括颈内静脉和肺动脉),术前临床症状与脑CT 均无脑受累表现。但由于心脏超声检查在房缺处探及双向分流,因此须警惕新发生体循环系统的栓塞,特别是脑血管并发症。
(5)麻醉药物选择:由于长时间感染、贫血 、心功能不全等原因,SBE 患者对麻醉药物的抑制作用更敏感,无法有效代偿诱导期外周血管阻力,且心肌收缩力改变会导致循环系统衰竭;另一方面,麻醉深度不足时气管插管可能引起严重的心血管反应而加重心脏负担,还可能发生呛咳、体动等气道反射,使静脉回流压力增加而进一步减少心排血量,甚至可能诱发赘生物脱落。因此平稳的麻醉诱导非常重要,既要保证足够的麻醉深度避免循环波动又要避免心肌抑制。
、心功能不全等原因,SBE 患者对麻醉药物的抑制作用更敏感,无法有效代偿诱导期外周血管阻力,且心肌收缩力改变会导致循环系统衰竭;另一方面,麻醉深度不足时气管插管可能引起严重的心血管反应而加重心脏负担,还可能发生呛咳、体动等气道反射,使静脉回流压力增加而进一步减少心排血量,甚至可能诱发赘生物脱落。因此平稳的麻醉诱导非常重要,既要保证足够的麻醉深度避免循环波动又要避免心肌抑制。
本例患儿在麻醉诱导前积极使用多巴胺、米力农等血管活性药物和正性肌力药支持心功能,在此基础上采取低浓度七氟烷与足量肌松药缓慢诱导,在逐步增加麻醉深度的同时避免麻醉诱导剂量过大发生心肌抑制。阿片类药物对心肌收缩的影响明显小于其他静脉药和吸入药,在心功能不全患者中使用也具有较好的循环稳定性。因此本例麻醉维持在小剂量七氟烷与肌松剂的基础上,在切皮、锯胸骨、体外循环前分次追加芬太尼,维持一定麻醉深度的同时,减少麻醉药对心肌抑制作用。
综上所述,SBE 合并SLE 患儿的并发症发生率较高,建议组成多学科组协作诊疗团队来提高患儿的生存率和生存质量,如患儿需要手术,则麻醉科医生也应当参与多学科救治,术前了解患儿的全身状态,参与围术期风险因素评估和临床决策,持续监测与管理患儿抗感染、出凝血状态、心血管功能、其他器官并发症等,动态选择和调整麻醉方案和麻醉药物,从而有效改善此类患儿的预后。
来源:石贇.急性感染性心内膜炎儿童的三尖瓣修复术麻醉管理1例并文献复习[J].暨南大学学报(自然科学与医学版),2023,44(06):658-664.
