
肿瘤电场治疗联合多柔比星及放化疗治疗复发胶质母细胞瘤1例报道
作者:李宏博,蒋念,李学军,中南大学湘雅医院神经外科
Li-Fraumeni综合征是一种罕见的常染色体 显性遗传肿瘤综合征,以多种肿瘤发病高风险为特征。多形性胶质母细胞瘤
显性遗传肿瘤综合征,以多种肿瘤发病高风险为特征。多形性胶质母细胞瘤 (glioblastoma multiforme,GBM)来源于中枢神经系统神经上皮细胞,是最常见、最具侵袭性的颅内原发恶性肿瘤,具有术后高复发率、高死亡率、低治愈率等特点,目前针对胶质母细胞瘤的治疗方法主要为手术结合术后放疗和化疗,尽管有肿瘤电场治疗、免疫治疗等新方案,但其预后依旧不容乐观。
(glioblastoma multiforme,GBM)来源于中枢神经系统神经上皮细胞,是最常见、最具侵袭性的颅内原发恶性肿瘤,具有术后高复发率、高死亡率、低治愈率等特点,目前针对胶质母细胞瘤的治疗方法主要为手术结合术后放疗和化疗,尽管有肿瘤电场治疗、免疫治疗等新方案,但其预后依旧不容乐观。
本文报道了1例Li-Fraumeni综合征患者合并胶质母细胞瘤的诊疗过程,患者采用常规手术并辅助放化疗方案失败后,利用肿瘤电场治疗联合多柔比星 取得较好疗效,具体报道如下。
取得较好疗效,具体报道如下。
1.病例资料
患者女,57岁,已婚。因“反复头晕5月余,加重伴左侧肢体乏力4天”于2019年9月19日住院诊治。患者既往多次肿瘤治疗史:1994年行“结肠癌 部分切除术”;2001年行“右侧乳腺癌
部分切除术”;2001年行“右侧乳腺癌 切除术”;2005年行“左侧乳腺癌切除术”,并行化疗;2013年行“右侧肺癌切除术”,并行4次放疗;现服用“吉非替尼片
切除术”;2005年行“左侧乳腺癌切除术”,并行化疗;2013年行“右侧肺癌切除术”,并行4次放疗;现服用“吉非替尼片 ”250 mg每日一次行靶向治疗;2013年行头部检查发现“大脑中线区脂肪瘤”,每年定期复查,未见明显变化;余无特殊。患者妹妹患肠道肿瘤去世,确诊时年龄低于30岁。个人史、婚育史、月经史无特殊。
”250 mg每日一次行靶向治疗;2013年行头部检查发现“大脑中线区脂肪瘤”,每年定期复查,未见明显变化;余无特殊。患者妹妹患肠道肿瘤去世,确诊时年龄低于30岁。个人史、婚育史、月经史无特殊。
体查:神清语利,KPS评分60分,右侧肢体肌力5级,左上肢4级,左下肢3级 ,四肢肌张力正常。右侧指鼻试验 (-),轮替试验(-),左侧指鼻试验及轮替试验无法配合体查;Romberg征无法配合体查,不能行一字步。克、巴、布氏征阴性。
(-),轮替试验(-),左侧指鼻试验及轮替试验无法配合体查;Romberg征无法配合体查,不能行一字步。克、巴、布氏征阴性。
患者入院后完善相关检查,查MRI提示右顶叶囊实性占位(图1A、B);于2019年9月25日在全麻气管插管下行开颅探查并肿瘤切除术,术后病检结果示(图2A):(颅内占位)圆形细胞肿瘤,瘤细胞丰富,部分胞质红染,核偏位,考虑高级别胶质瘤,结合免疫组织化学倾向胶质母细胞瘤(WHO Ⅳ级)。
免疫组织化学:肿瘤细胞GFAP(+),Ki67(约15%+),S100(+),CKpan(-),Olig-2(局灶+),IDH-1(-),P53(-),Vimit(+),EMA(-),ATRX(+),H3K27M(-),MGMT(-)。分子病理:1p/19q未见缺失;MGMT基因启动子非甲基化;IDH1/2未测及突变;BRAF V600E无突变。肿瘤标本及外周血TP53基因检测提示:TP53存在c.920-2A>G致病性突变。术后复查MRI示肿瘤基本切除(图1C、D)。
患者术后半月行三维放疗+同步化疗。根据治疗方案,于2019年10月29日开始行同步放化疗:替莫唑胺 (TMZ)75 mg/(m2.d);适形调强放射治疗(IMRT),PTV 2.0 Gy/次,共30次。放化疗期间,患者出现头痛
(TMZ)75 mg/(m2.d);适形调强放射治疗(IMRT),PTV 2.0 Gy/次,共30次。放化疗期间,患者出现头痛 、头晕、水肿
、头晕、水肿 等症状,予以脱水等对症处理后好转;并出现二度消化道反应,予以护胃、止呕等对症处理后好转;余无特殊反应。
等症状,予以脱水等对症处理后好转;并出现二度消化道反应,予以护胃、止呕等对症处理后好转;余无特殊反应。
2019年12月18日患者完成全部放疗。后继续口服替莫唑胺(150 mg/(m2.d),连服5天后停药23天为一个疗程),并规律复查MRI,患者左侧肢体肌力渐恢复可达5级。2020年7月21日查颅脑MRI示(图1E、F)未见肿瘤复发征象,停止口服替莫唑胺化疗。
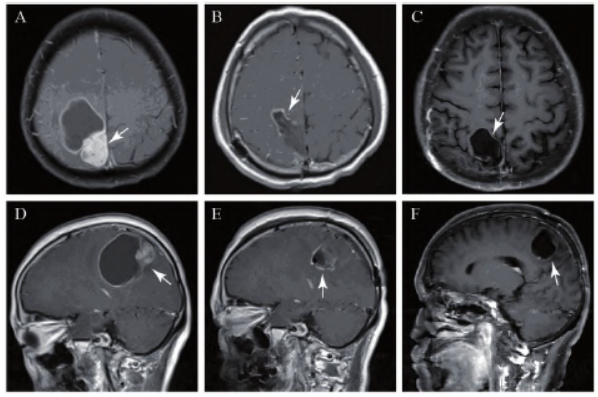
图1 患者第一次手术前后及复查的颅脑MRI
2020年10月29日患者再次复查颅脑MRI(图3A、B)示术区囊性灶范围增大,局部囊壁增厚,肿瘤复发可能性大。患者再次出现左侧肢体乏力(左上肢4级,左下肢3级),头顶部疼痛,并有癫痫 发作一次。患者术前KPS评分60分,于2020年11月12日于全麻下行开颅探查顶叶病变切除术,术中头皮下留置OMMAYA囊,导管尖端放至瘤腔。术后复查MRI示病灶基本切除(图3C、D)。术后病检示(图2B):(右顶叶肿物)高级别胶质瘤,结合病史,考虑为胶质母细胞瘤复发,WHO Ⅳ级。
发作一次。患者术前KPS评分60分,于2020年11月12日于全麻下行开颅探查顶叶病变切除术,术中头皮下留置OMMAYA囊,导管尖端放至瘤腔。术后复查MRI示病灶基本切除(图3C、D)。术后病检示(图2B):(右顶叶肿物)高级别胶质瘤,结合病史,考虑为胶质母细胞瘤复发,WHO Ⅳ级。

图2 患者术后病理检查 结果
结果
免疫组织化学结果:GFAP(+),Ki67(8%+),P53(-),IDH-1(+),H3 K27M(-),Olig-2(-),EGFR(2+),ATRX(+)。分子病理:1p/19q未见缺失;MGMT基因启动子非甲基化;IDH1/2无突变;BRAF V600E无突变。患者术后继续替莫唑胺化疗,方案同前。
因无法忍受放疗所致不良反应,患者分别于2020年12月10日、2021年1月27日及2021年3月19日经OMMAYA囊注射多柔比星(DOX),每次5 mg。同时为进一步控制肿瘤进展,患者于2020年12月10日开始肿瘤电场治疗(tumor-treating fields, TTF),于2021年1月29日开始改变替莫唑胺剂量为50 mg每日一次,并于多柔比星第三针注药后,增加口服替莫唑胺剂量至100 mg每日一次,但患者依从性较差,未规律口服药物,但复查MRI(图3E、F)未见肿瘤复发征象。
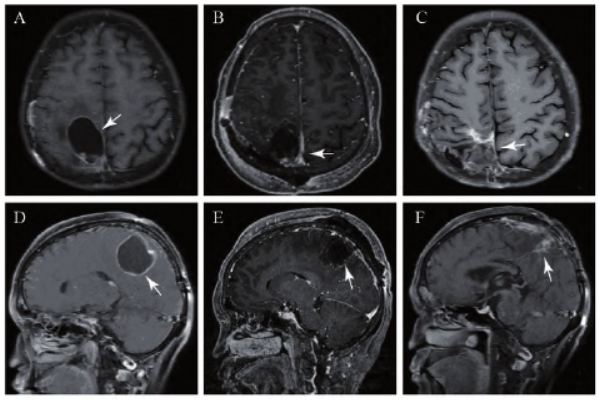
图3 患者第二次手术前后及复查的颅脑MRI
2021年8月25日患者复查MRI(图4A、B)可见右枕叶新发强化灶,考虑复发。由于患者新发灶不大,予以动态观察。患者规律复查MRI,右枕叶新发灶较前增大,考虑复发可能性大。遂于2022年2月22日行立体定向伽马刀放射治疗(6射点,处方剂量14 Gy,最大剂量28 Gy)。
患者伽马刀放射治疗后规律复查MRI,可见右枕叶强化灶增大,考虑放射性坏死形成,肿瘤原发灶基本吸收,后经综合治疗,肿瘤原发灶已痊愈,多次复查原发灶未见复发征象(图4C~F);患者左侧肢体肌力经治疗后亦得到改善可达5级;患者术后KPS评分60分,与术前相当,取得满意疗效。该例患者多次入院治疗,接受手术、放疗、化疗及肿瘤电场治疗等多种治疗方案,诊疗过程复杂。
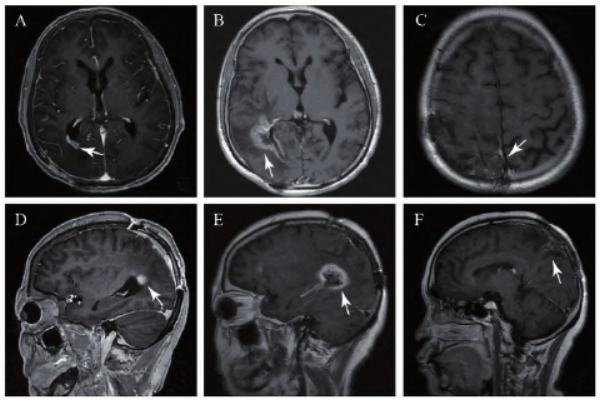
图4 伽马刀治疗前后头部MRI
2.讨论
Li-Fraumeni综合征是一种罕见的因抑癌基因TP53突变所致的遗传性肿瘤综合征,呈常染色体显性遗传,以骨与软组织肉瘤 、乳腺癌(女性绝经前乳腺癌)、中枢神经系统肿瘤、肾上腺皮质肿瘤、支气管肺癌及白血病等肿瘤发病高风险为特征。患者首次确诊肿瘤的平均年龄为25.9岁,41%的患者在18岁前被确诊为肿瘤,其中中枢神经系统肿瘤发生的概率为26%。
、乳腺癌(女性绝经前乳腺癌)、中枢神经系统肿瘤、肾上腺皮质肿瘤、支气管肺癌及白血病等肿瘤发病高风险为特征。患者首次确诊肿瘤的平均年龄为25.9岁,41%的患者在18岁前被确诊为肿瘤,其中中枢神经系统肿瘤发生的概率为26%。
患者携带TP53 c.920-2A>G剪切变异,剪切变异可能导致外显子缺失,影响蛋白功能。ClinVar数据库中记录TP53 c.920-2A>G变异为致病/可能致病突变(变异ID:43595)。该患者罹患结肠癌、乳腺癌、肺癌、胶质母细胞瘤,其中乳腺癌、肺癌、胶质母细胞瘤均属于Li-Fraumeni综合征谱系疾病,患者首次确诊肿瘤时年龄远低于46岁,符合2009年版Chompret的诊断标准中的第二条:先证者罹患多种肿瘤(除外多原发乳腺癌),并且其中2种是Li-Fraumeni综合征谱系疾病,最早发现的肿瘤于46岁前发病。
胶质母细胞瘤来源于中枢神经系统神经上皮细胞,是最常见、最具侵袭性的颅内原发恶性肿瘤,占原发性脑恶性肿瘤的50.1%。GBM具有术后高复发率、高死亡率、低治愈率等特点,患者中位生存期为14.2~16月,无进展生存期仅4个月。
生存期超过3年的GBM患者称为长期幸存者(long-term survival, LTS),仅占GBM患者的3%~5%;生存期超过5年的患者更为罕见,仅占0.5%。目前GBM的主要治疗方式为手术治疗,术后放疗结合化疗,尽管有肿瘤电场治疗、免疫治疗等新的治疗方案,GBM患者的预后依旧不容乐观,手术全切肿瘤后,复发依旧难以避免。
替莫唑胺是一种新型的口服烷化剂类抗肿瘤药,可以将甲基转移至肿瘤细胞DNA上,且避开错配修复系统,使DNA出现缺口,最终导致DNA复制失败而凋亡。多柔比星是一种广谱抗肿瘤抗生素,可抑制RNA和DNA的合成,主要是通过嵌入DNA来抑制核酸合成,进而发挥抗肿瘤疗效。
Horescu等在体外胶质母细胞瘤细胞系中分析了替莫唑胺与多柔比星之间的相互作用,结果发现替莫唑胺与多柔比星均能较好地杀死肿瘤细胞,但联合使用并不能产生协同作用。但Villodre等在体外胶质瘤细胞试验中发现低剂量的多柔比星可以增强替莫唑胺的抗肿瘤效应,联合使用较单用替莫唑胺疗效更佳。
一项Ⅱ期临床试验表明联用替莫唑胺与静脉滴注多柔比星具有良好的耐受性,但患者并不能在半年无进展生存期及OS上获益。Liu等为比较替莫唑胺单药治疗与联合使用经OMMAYA囊泵注多柔比星治疗胶质瘤的疗效,将70名胶质瘤患者随机分为两组,对比发现联合使用替莫唑胺和多柔比星能显著提高临床疗效,降低不良反应发生率,改善患者健康状况。
肿瘤电场治疗是利用特定频率(100~300kHz)的交变电场干扰肿瘤细胞有丝分裂过程中纺锤体的形成,细胞无法完成分裂,从而引起肿瘤细胞调亡,在不破坏正常细胞结构的同时,杀伤肿瘤细胞。
早在2004~2007年Rulseh等在一项20人的临床研究中首次验证了电场治疗的安全性及有效性,该研究中患者被分为两组,一组为替莫唑胺治疗无效的复发GBM患者,单独采用电场治疗(中位OS为14.5个月);另一组为新诊断的GBM患者,采用放疗+替莫唑胺化疗+电场治疗(中位OS为39个月)。两组患者中各有2名患者在随访7年后未见复发征像,且4人均在入组治疗不足2年时已停止一切治疗;2名复发GBM患者在电场治疗后原复发强化灶渐消失。
Stupp等的研究表明较单用替莫唑胺化疗,联用电场治疗和替莫唑胺化疗可延长患者的无进展生存期及总生存期,肿瘤电场治疗可提高化疗疗效及敏感度而不会增加相关药物毒性。基于目前研究显示出的有效性及安全性,2022年《脑胶质瘤诊疗指南》推荐用于新诊断GBM和复发高级别胶质瘤的治疗。
本例患者术前KPS评分<70分、IDH1/2基因野生型、MGMT基因非甲基化、1p/19q未见缺失、第一次术后早期复发均提示患者预后不佳。患者第一次手术全切后采用放疗联合长疗程替莫唑胺化疗,无进展生存期达13个月,肿瘤原位复发后,再次手术安全切除,而采用肿瘤电场治疗联合多柔比星化疗,无进展生存期可长达14个月,远超复发GBM的平均无进展生存期。
因多柔比星为OMMAYA囊内给药,全身不良反应小,电场治疗亦无全身不良反应,所以患者能较好地耐受此治疗方案。考虑到患者第二次术后右侧枕角复发病灶小,且无明显神经功能受累症状,故采用局部伽马刀治疗,病灶得到较好的控制。胶质瘤复发后往往具有更强侵袭性、恶性程度更高、病情进展更快,本案例中根据患者复发情况以及身体状况,第二次术后采用肿瘤电场治疗联合多柔比星及替莫唑胺化疗方案,经过长期追踪复查,并未见原位复发征像,取得了较好的疗效,值得深入研究其机制,为胶质瘤的个性化治疗提供经验和理论依据。
来源:李宏博,蒋念,李学军.肿瘤电场治疗联合多柔比星及放化疗治疗复发胶质母细胞瘤1例报道[J].肿瘤防治研究,2023,50(06):641-645.
