
颌骨Gorham-Stout病1例及文献复习
作者:吴一凡,卢浩,刘胜文,徐万林,杨雯君,上海交通大学医学院附属第九人民医院口腔颌面-头颈肿瘤科
Gorham-Stout病(Gorham-Stout disease,GSD)是一种罕见的以骨骼无痛性、进行性吸收为主要特点的疾病,其病理特点主要为非肿瘤性的血管或淋巴管组织增生和骨溶解。该病在1955年被Gorham和Stout定义为一种独立的疾病,并且描述了其临床病理特点。GSD可发于全身多处骨骼,主要见于下颌骨、肩胛骨、骨盆、股骨和颅骨。颌面部的GSD主要单发于下颌骨,也可多发同时累及其他颌面骨。至今为止GSD的发病机制尚不明确,临床特点多变复杂,其治疗方案也未形成统一标准。现报道1例GSD患者,并结合相关文献进行复习。
1.病例报告
患者男,31岁,2018年因“摄片发现右下颌骨吸收3个月”来上海交通大学医学院附属第九人民医院口腔颌面-头颈肿瘤科就诊,予以摄发射型计算机断层扫描仪(emission computed tomography,ECT) 检查,结果显示“右侧下颌角局部骨质缺损,区域内无核素摄取;右侧下颌骨体部核素浓聚灶,考虑成骨反应活跃,建议手术探查”,遂以“右下颌骨骨吸收待查”收治入院。
查体:患者颌面部左右侧欠对称,右侧下颌角部稍塌陷,扪诊骨质尚连续,但较对侧减小,无明显触压痛;口内恒牙列,咬合关系尚可。CT平面扫描显示:右侧下颌角及右侧髁突骨质吸收破坏,可见局部骨皮质缺失,未见明显骨膜反应,周围未见异常软组织肿块影,增强后未见明显异常强化;右侧下颌体骨质密度欠均匀(图1)。
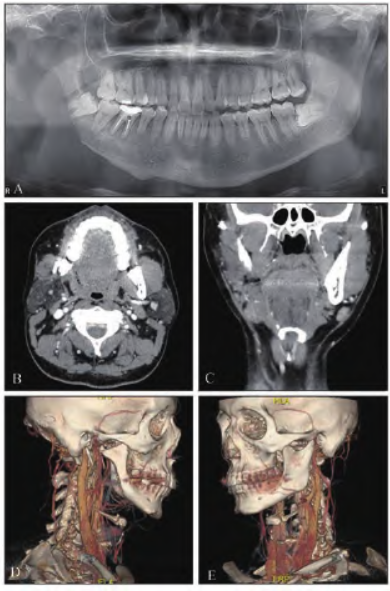
图1 术前影像学照。A:全景片示右侧下颌骨体部及升支处骨吸收显著;B:CT 横断位显示右侧下颌骨骨质吸收破坏;C:CT冠状位显示右下颌骨骨质缺失;D:CT三维重建显示右下颌骨体部及升支骨质吸收;E:CT三维重建显示左侧下颌骨骨质完整,未见明显骨缺失。
根据下颌骨缺损的Urken分类,缺损类型为CRB型。实验室检查:丙氨酸 氨基转移酶,104 IU·L-1;天门冬氨酸
氨基转移酶,104 IU·L-1;天门冬氨酸 氨基转氨酶,46 U·L-1,其余指标均在正常范围内。临床诊断为:右侧下颌骨骨吸收待查。完善相关检查,排除手术禁忌证后,全身麻醉下行“右侧下颌骨病损切除术”,术中采用颌下切口,切开翻瓣后见病灶主要位于翼内肌附近,邻近骨质呈不均匀吸收,切除病灶后修整下颌骨至圆钝。组织学苏木精-伊红(hematoxylin eosin staining,HE) 染色镜下见炎症性纤维组织增生、玻璃样变,伴有少量骨化,部分血管增生,未见明显细胞异性(图2),免疫组织化学β -连环蛋白(Beta-catenin)(胞浆+)、CD34 (+)、平滑肌肌动蛋白(smooth muscle actin,SMA)(+)。
氨基转氨酶,46 U·L-1,其余指标均在正常范围内。临床诊断为:右侧下颌骨骨吸收待查。完善相关检查,排除手术禁忌证后,全身麻醉下行“右侧下颌骨病损切除术”,术中采用颌下切口,切开翻瓣后见病灶主要位于翼内肌附近,邻近骨质呈不均匀吸收,切除病灶后修整下颌骨至圆钝。组织学苏木精-伊红(hematoxylin eosin staining,HE) 染色镜下见炎症性纤维组织增生、玻璃样变,伴有少量骨化,部分血管增生,未见明显细胞异性(图2),免疫组织化学β -连环蛋白(Beta-catenin)(胞浆+)、CD34 (+)、平滑肌肌动蛋白(smooth muscle actin,SMA)(+)。
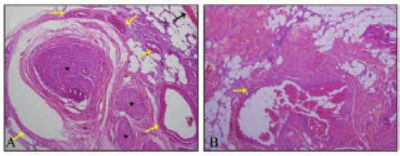
图2 组织学HE染色见血管增生 光学显微镜 × 100。A:骨组织内血管增生,黄色箭头示增生的血管;黑色箭头示骨;星号示骨髓腔内的神经组织; B:软组织内血管增生,黄色箭头示增生的血管。
根据1983年Heffez等提出了8项诊断的标准,患者组织病理学检查显示血管增生,细胞缺乏异形性;影像学、病史以及专科检查显示局部骨进行性吸收,非膨胀、溃疡性病变;无内脏及全身其他组织受累; 家族史排除遗传性疾病引起溶骨;实验室检查指标未见异常,排除代谢、肿瘤、免疫和感染等因素导致溶骨。最终考虑患者诊断为右侧下颌骨的GSD。2020、2021年患者在复查过程中摄片发现右侧下颌骨仍有吸收,遂入院切除病变下颌骨及部分邻近肌肉组织,因考虑到术后仍有复发可能故同期未行骨重建手术,随访至今8个月,目前未见进一步骨吸收(图3)。
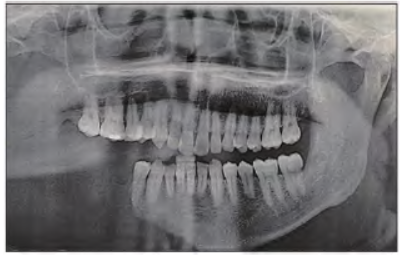
图3 术后随访全景片
2.讨论
GSD是由Jackson于1838年报道,至今为止英文文献报道了约200余例,其中颌面部约60余例。颌面部的GSD发病没有明显的性别和年龄差异,Kim等总结了64例既往报道的颌面部GSD病例,发现男女比例为1∶1.78左右,平均发病年龄为33岁。颌面骨中最常单发于下颌骨,少有病例报道单发于上颌骨,一些学者曾分别报道过多中心的颌骨GSD,同时累及颞骨、额骨、颧骨、下颌骨和上颌骨。本文在Kim等2015年整理的既往64 例颌面部GSD的基础上更新加入了24篇文献报道的33例患者。
目前,GSD的病因和发病机制仍不明确,Gorham和Stout描述GSD的典型组织学特点是血管和淋巴管增生伴有骨质的溶解,他们认为该疾病是由内皮细胞的增殖引起的,通过改变其pH值、施加直接机械力或持续增加血流量来影响局部环境导致最终的骨溶解。
随着对于该疾病的不断研究,目前学者认为GSD的发病机制集中在破骨细胞的作用、血管或淋巴管生成以及成骨细胞功能3个方面,在对GSD溶骨的病变组织行细胞学检查后发现了大量的破骨细胞以及巨噬细胞样细胞,同时GSD患者血清中的白细胞介素6 (interleukin6,IL-6)水平的升高也提示该因子可能通过增加破骨细胞活性从而导致大规模的骨溶解,一些GSD患者血清中升高的Ⅰ型胶原吡啶交联终肽(C-terminal telopeptide of type Ⅰ collagen,ICTP)提示骨吸收活动率的增高。
Rossi等通过对7名GSD患者的破骨细胞进行转录分析后,结果发现了磷脂酰肌醇 3- 激酶(phosphatidylinositol 3-kinase,PI3-kinase) 通路以及表皮生长因子(epidermal growth factor,EGF) 受体信号通路的富集,而他们均参与到破骨细胞的分化和功能。近期学者们发现刺激调节性T细胞可能会抑制GSD中破骨细胞的功能。
3- 激酶(phosphatidylinositol 3-kinase,PI3-kinase) 通路以及表皮生长因子(epidermal growth factor,EGF) 受体信号通路的富集,而他们均参与到破骨细胞的分化和功能。近期学者们发现刺激调节性T细胞可能会抑制GSD中破骨细胞的功能。
越来越多的证据表明,异常增生的淋巴管在GSD的发病过程中起到了重要作用,充满液体的淋巴管的不受控制生长可能会通过压迫骨骼而导致骨溶解,而这种失控的生长往往与局部微环境中存在的生长因子有关,其中A型血管EGF作为主要的淋巴管生成驱动因子,在很多GSD患者的血清中均有检出;另外,淋巴管内皮细胞可能通过分泌巨噬细胞集落刺激因子来激活破骨细胞从而导致骨破坏。
Hagendoorn等在对1例患者血浆中的血小板源性生长因子-BB(platelet-derived growth factor-BB,PDGF-BB) 进行酶联免疫吸附实验分析后发现:循环中的PDGF-BB水平较正常组升高了7倍,进一步提示了血小板源性生长因子受体β(platelet-derived growth factor receptor-beta,PDGFR- β)信号通路可能在疾病的发生发展中起到关键作用。据报道:硬化素被证明能刺激破骨细胞的形成,上调核因子κB受体活化因子配体(receptor activator of NF-κB ligand,RANKL) 表达的同时下调成骨细胞中的骨保护素。
有学者发现:GSD患者血清中的硬化素水平升高,从而导致了骨吸收活性增加和成骨功能的降低。有文献报道:在1例磷酸酯酶与张力蛋白同源物(phosphatase and tensinhomolog, PTEN)错构瘤综合征合并Gorham-Stout现象的患者中,发现了在基因6号外显子上存在c.517 C>T (p.Arg173Cys) 的种系杂合突变,而PTEN基因通过过表达抑制RANKL介导的破骨细胞分化。
对1例GSD患者的样本进行了高通量测序后,在鼠类肉瘤病毒癌基因(kirsten rat sarcomaviral oncogene,KRAS) p.G12V中发现了一个激活的体细胞突变,并通过实验验证了过度激活的KRAS信号刺激了骨组织中淋巴管的形成,且损害了淋巴管瓣膜的发育,进一步揭示了GSD可能存在的发病机制。临床表现方面,累及颌面骨的GSD主要表现为牙齿松动疼痛、错畸形、受累区域肿胀、下颌偏斜和明显的面部畸形;其中,当病变累及到颞骨可出现耳鸣 甚至脑脊液漏,自发性骨折很常见,可能是该病的首发症状,但骨折后缺乏骨愈合是该病的标志。
甚至脑脊液漏,自发性骨折很常见,可能是该病的首发症状,但骨折后缺乏骨愈合是该病的标志。
GSD的死亡病例主要是由于累及肋骨、胸骨、肩胛骨或椎骨进而延伸至纵隔,并侵犯胸腔导管,导致胸膜或乳糜性心包积液,从而引起呼吸衰竭和心力衰竭。Kim等回顾了64例既往颌面部GSD病例,结果发现:其中7名患者死于该病的进展,4名因肺部相关问题死亡,2例死于脊髓受累,1例死于颅内侵犯。因GSD的临床表现多变且复杂,其诊断缺乏特异性,所以该病的诊断多采用排除法。
1983年,Heffez等提出了8项诊断的标准:1) 组织病理为血管增生;2)细胞缺乏异形性;3) 很少或无成骨细胞的反应及营养不良性钙化情况;4) 有局部骨进行性吸收;5) 非膨胀、非溃疡性的病变;6) 无内脏受累;7) 影像学显示有骨溶解;8) 排除遗传、代谢、肿瘤、免疫和感染等病因引起的溶骨。
在组织病理学上GSD存在2个临床的分期:早期骨被血管结缔组织迅速取代,这可以导致不同强度的疼痛和肿胀,晚期存在较为活跃的骨溶解现象,受累的骨质被纤维结缔组织取代。影像学方面,全景片、CT、磁共振成像 (magnetic resonance imaging,MRI)、放射性同位素骨扫描等均可助于GSD的诊断,影像上最初可发现类似骨质疏松症中的斑块状骨质缺失。后期表现为皮质结构部分的完全溶解,导致“消失灶”两侧缩窄形成类似削尖的铅笔。
(magnetic resonance imaging,MRI)、放射性同位素骨扫描等均可助于GSD的诊断,影像上最初可发现类似骨质疏松症中的斑块状骨质缺失。后期表现为皮质结构部分的完全溶解,导致“消失灶”两侧缩窄形成类似削尖的铅笔。
MRI上T1加权图像通常显示受影响骨骼区域的低信号,然而,T2加权图像可能显示中到高信号强度。99m锝标记的五价二巯基丁二酸[99mTc(V) -DMSA] SPECT-CT 也有报道用于GSD的诊断。生物化学检查中,一些学者发现:部分GSD患者的血清中IL-6、VEGF-A、ICTP以及硬化素的水平升高,考虑这些因子对于破骨细胞的分化和功能具有一定的作用,所以建议将其作为诊断的血清学标志。
Rossi等招募了9例GSD患者,并对其骨细胞进行了miRNome分析,结果发现:miR-1246、miR-1-3p以及miR-137-3p在患者破骨细胞中明显表达,并且miR-1246在患者的血清外泌体中上调,这可能作为诊断GSD的新的分子标志物。
GSD的治疗尚未形成统一的标准,目前主要的治疗方式包括手术治疗、放射治疗和药物治疗。颌面部GSD的手术治疗包括病损骨切除、骨移植重建以及假体修复,然而有些作者报道在行骨重建后又出现了进行性的吸收,导致后期的修复失败,因此建议GSD患者的骨移植重建应避免在溶骨活跃期进行,本文报道的1例患者因正处于溶骨活跃期,所以只采用了颌骨病损切除术而未行后期的重建手术,给患者的建议是待骨吸收稳定后再行骨移植修复。
本文报道的病例目前随访8个月未见明显骨吸收,但也有文献报道在手术治疗后的较长时间(6年)后又出现了进展,因此术后的长期随访往往是必要的。放射治疗也被认为是一种有效的治疗方式,放射治疗可以在80%的病例中阻止GSD的进展,放射治疗的剂量建议在基于CT治疗计划后应用30~45 Gy的总剂量。同时,放射治疗可以与手术相结合,在术前或者术后用于缩小病变范围,阻止血管生成从而停止骨溶解的进展。然而对于一些年轻的患者,放射治疗可能会诱发恶性肿瘤,因此对于这类患者一般在药物治疗无法控制骨溶解进展之后再考虑应用放射治疗。
随着技术的进步,在面对外科和内科治疗均无效的一些颅底GSD中,调强放射治疗和图像引导放射治疗可以有效的改善疾病的预后并且减少放射治疗带来的不良反应。药物治疗目前主要是采用双膦酸盐类药物和干扰素;其中,双膦酸盐类药物通过抑制破骨细胞活性来延缓GSD的进展,而干扰素主要通过调节免疫和抗血管生成发挥作用。
Qu等报道了4例口服阿仑膦酸钠片 治疗GSD的患者,病情均得到了一定的控制。西罗莫司
治疗GSD的患者,病情均得到了一定的控制。西罗莫司 是一种雷帕霉素靶点的抑制剂,而哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR) 是磷脂酰肌醇三羟基激酶(phosphoinositide-3 kinase, PI3K) /丝氨酸
是一种雷帕霉素靶点的抑制剂,而哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR) 是磷脂酰肌醇三羟基激酶(phosphoinositide-3 kinase, PI3K) /丝氨酸 /苏氨酸蛋白激酶(Akt) 通路的一种激酶,调节多种细胞过程,其中包括血管生成和细胞生长。目前一项前瞻性临床试验显示:西罗莫司耐受性良好,对于复杂难治的血管畸形具有一定的疗效。
/苏氨酸蛋白激酶(Akt) 通路的一种激酶,调节多种细胞过程,其中包括血管生成和细胞生长。目前一项前瞻性临床试验显示:西罗莫司耐受性良好,对于复杂难治的血管畸形具有一定的疗效。
还有学者成功使用西罗莫司缓解GSD患者的症状,然而该药物治疗方案的推广仍然需要大规模研究得到证实。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK) 信号通路在淋巴管瓣膜的发育中起到关键作用,淋巴管内皮细胞中过度活跃的KRAS信号损害了淋巴瓣膜的发育,而曲美替尼 作为丝裂原细胞外激酶(mitogen-activated extracellular signal regulated kinase,MEK) 抑制剂能够有效地治疗KRAS驱动的GSD小鼠模型,为测试MEK抑制剂在GSD中的治疗提供了基础。
作为丝裂原细胞外激酶(mitogen-activated extracellular signal regulated kinase,MEK) 抑制剂能够有效地治疗KRAS驱动的GSD小鼠模型,为测试MEK抑制剂在GSD中的治疗提供了基础。
综合一些学者以及笔者整理的既往颌面部GSD的治疗经验,手术治疗和药物治疗仍然是优先方案,但是单纯手术或者药物治疗的长期疗效仍有待考察。一些文献报道了手术结合药物的综合治疗方案,在较长的随访时间内未见疾病的进一步发展。有学者报道了1例患者,在既往3年半间注射了11个疗程的帕米膦酸 二钠,而后采用腓骨瓣重建缺损,观察随访6年未见疾病的进一步进展。这提示对于可能存在进展的GSD病例,药物治疗联合手术的综合治疗方案,在控制溶骨,恢复受损的颌骨方面具有一定的价值。
二钠,而后采用腓骨瓣重建缺损,观察随访6年未见疾病的进一步进展。这提示对于可能存在进展的GSD病例,药物治疗联合手术的综合治疗方案,在控制溶骨,恢复受损的颌骨方面具有一定的价值。
综上所述,颌面部的GSD是一种罕见的以进行性骨溶解为主要特征的疾病,其诊断主要依靠影像学联合组织病理学检查,实验室检查无明显的特殊,血清IL-6可能对该疾病有一定的提示作用。进展期的GSD手术治疗应着重于清除病损骨而非骨重建,骨移植重建或假体修复应该在骨吸收稳定期进行。放射治疗和药物治疗可作为辅助治疗以及一些拒绝手术患者的主要治疗方式。部分病例存在自限性,但该病仍有一定的复发可能,所以定期的复查是必要的,尤其是影像学检查可用于监测疾病的进展情况。
来源:吴一凡,卢浩,刘胜文等.颌骨Gorham-Stout病1例及文献复习[J].国际口腔医学杂志,2023,50(04):445-451.
