
颈脊髓损伤后神经病理性疼痛:1例
作者:武汉科技大学附属普仁医院骨科 彭京
神经病理性疼痛(NP)是由物理感觉系统损伤或疾病引起的疼痛,主要特征是自发性疼痛、痛觉过敏和感觉异常,它是脊髓损伤(SCI)后最常见和最具挑战性的并发症之一。神经病理性疼痛还可出现抑郁、睡眠障碍等继发性症状,对患者的生活质量产生严重的负面影响。目前治疗还未取得重大突破,多局限于药物疗法。最近脊髓电刺激(SCS)用于治疗慢性脊髓损伤的全瘫和不全瘫患者,取得了阶段性的效果,通过脊髓刺激和康复训练能使瘫痪患者重新获得站立和行走的能力。尽管SCS的作用和疗效确切,但是目前用于脊髓损伤后上肢疼痛的研究较少。本团队收治1例颈部脊髓损伤后上肢神经病理性疼痛病例,通过SCS治疗得到了缓解。现报告此例患者诊疗过程,并对相关文献进行综述。
病例报告
患者男性,65岁,2021年12月因为车祸导致全身多处损伤,双上肢截瘫伴感觉减退,经救护车急送本院,完善全脊柱MRI检查后提示:急性颈部脊髓损伤,颈椎椎管内血肿(图1a,1b)。于2021年12月3日紧急行颈椎后路单开门椎管减压术+前入路颈椎间盘切除术和颈椎融合术,术后患者一般情况稳定,经康复科行营养神经、针灸、推拿等综合治疗后可独自站立及行走。术后8个月于本院门诊复查,正位X线片示后前联合内固定位置满意,MRI示脊髓血肿信号较前好转(图1c,1d)。但患者自述四肢乏力,麻木疼痛,以左侧上肢症状为重,四肢感觉障碍,痛觉敏感,伤后出现性功能障碍,伴肛周坠胀感。查体体征:右上肢远近端肌力5级,左上肢远近端肌力3/3+级,双下肢肌力5级,左手指精细动作受限,肌张力不高,双下肢无水肿,Babinski(+)。患者手术后,反复左侧上肢痛觉感觉异常,右上肢针刺样烧灼样痛,右侧上肢束缚感,双侧下肢感觉异常,自觉间断麻木、疼痛不适;肩关节活动受限,局部有压痛,先后多次住院治疗,给予普瑞巴林和加巴喷丁、甲钴胺片及阿片类药物治疗,均不能有效控制疼痛。
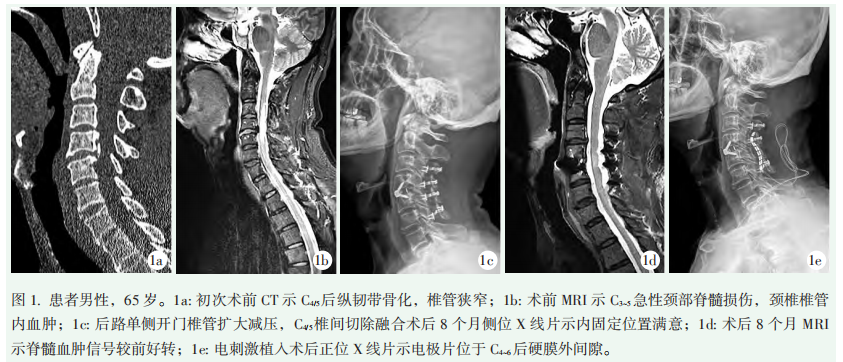
结合患者症状与体征,考虑脊髓损伤后遗症,神经病理性疼痛,疼痛数字评定量表(NRS)8分,药物治疗效果不佳,考虑予以脊髓神经刺激器置入术,先行临时脊髓神经刺激器置入,观察效果,若患者疼痛缓解≥50%或总体功能(包括疼痛、睡眠、行走等)改善≥50%和/或患者对测试效果满意,则视为测试合格,决定置入永久脊髓神经刺激器。若无效,需再次手术取出刺激电极。再次手术沿单开门钢板棘突旁分离颈棘肌,显露C3~6椎板、侧块及单开门钢板,将脊髓神经电刺激电极置于C4及C6钢板下方,电极朝向硬脊膜,随后连接测试装置,测试电极工作正常,测试中可见斜方肌、三角肌、肱三头肌、拇展肌于电极刺激下反应良好,异常感觉可覆盖上肢,在切口旁制作一个囊袋,将电极固定于切口旁囊袋内,随后将电极于切口侧方至少10cm穿出,固定电极导线。术后第3d开始通电刺激,首次电刺激电极刺激电压3.5V,患者诉上肢疼痛好转。但刺激后第2d夜间出现上肢疼痛,影响睡眠,调整电压为3.1V,夜间适当调低电压至2.8V左右后疼痛好转。观察期间,患者述上肢疼痛症状减轻,疼痛平均缓解>50%,患者对疗效满意,拟于初次电刺激后1周再次接受永久性电极置入术(图1e),自术后第3d开始电极通电,期间患者已下地活动。目前已随访8个月,患者现已停用镇痛药物,刺激器工作状态良好,无不良现象发生,每天24h开启,术后6个月开始早晚电压均维持在相对低水平。末次随访时焦虑评分量表(SAS)由术前中度焦虑65分降至正常45分,日常生活活动能力(ADL)评分由术前55分升高至78分,基本实现生活自理,NRS术后降为4分,睡眠明显改善。
讨论与文献综述
神经病理性疼痛 1994年国际疼痛研究协会(IASP)首次提出了神经病理性疼痛的概念。2019年IASP对慢性神经病理性疼痛进行最新分类:(1)周围神经病理性疼痛,包括三叉神经痛、带状疱疹后神经痛和痛性神经根病变等;(2)中枢神经病理性疼痛,包括脊髓或脑损伤后疼痛、卒中后疼痛等。此次新分类脊柱外科最常见的几种相关疾病(疼痛性神经根病、脊髓损伤后神经痛)均被纳入神经病理性疼痛,提示医师应该具备神经病理性疼痛的相关思维,而不是把疼痛简单地认为都是伤害性疼痛。关于脊髓损伤后神经病理性性疼痛,从历史上看,对于如何定义和分类疼痛还没有达成共识,因此导致大量建立在不同定义之上的分类方案和工具,产生了脊髓损伤疼痛患病率的广泛差异,由于缺乏一致的定义和分类,也使得SCI后NP研究之间的比较几乎不可能,导致了该领域内的混淆。
目前主要有Cardenas、国际脊髓损伤疼痛(ISCIP)及IASP分类法等。其中ISCIP分类法是发展起来的第1个通用分类法,也是目前临床上用的最多的分类法。该分类将SCI后疼痛分层为3级:第1级包括伤害性疼痛、神经病理性疼痛、其他类疼痛和未知类型疼痛;第2级包括伤害性疼痛和神经性疼痛类别的各种疼痛亚型,其中神经病理性疼痛又分为:损伤平面型疼痛(疼痛在损伤平面和/或以下3个阶段内)、损伤平面以下型疼痛(疼痛在损伤平面以下3个阶段以下)及其他;第3级用于对已知疼痛确定其在器官水平上和病理上的来源。本病例是典型的脊髓损伤后神经病理性疼痛患者,C3~5脊髓受损,疼痛主要位于C5及以下的皮节,根据ISCIP分类,定义为损伤平面型疼痛。脊髓损伤后NP发病率,目前还存在争议。一项只针对ISCIP分类法的大型荟萃分析,纳入了13项研究,脊髓损伤后NP的合并患病率为58%。而另一项多中心横断面研究中发病率仅为48%。差异可能与采用不同的分类方法相关。药物治疗是长久以来SCI继发NP的首选治疗方案,目前对SCI后NP推荐的一线药物为抗癫痫药(普瑞巴林和加巴喷丁)、三环抗抑郁药(阿米替林或去甲替林)。对于药物选择通常从普瑞巴林或阿米替林开始,如果患者使用其中一种药物疼痛缓解不满意,可以首先从同类别药物转换,如普瑞巴林转向加巴喷丁(或可能是拉莫三嗪),然后跨类别(即抗癫痫药到阿米替林,反之亦然)。尽管药物治疗具有一定的效果,但仅有30%~50%的患者对药物治疗有反应,60%~70%的患者疼痛没有得到缓解,一些患者由于药物的不良反应而停止治疗,药物滥用导致的成瘾性更是难以控制,且与症状的持续时间和严重程度相关。
目前脊髓损伤后的NP治疗还没有单一或明确的治疗计划。一方面,动物模型的研究成果转化为临床研究还存在一定的困难,其中的原因包括动物实验室中研究的损伤类型和疼痛类型并不能完全模仿人类的情况。另一方面,神经病理性疼痛的机制包括了外周和中枢原因,但影响因素较多,尚无法完全探明机制,使得常规止痛药物治疗效果不佳。本研究患者罹患NP后通过8个月的药物治疗(阿米替林、普瑞巴林等),症状仍难以缓解,又经历失眠、焦虑和逐渐丧失日常生活能力。因此下一步治疗方案的制定,对患者后期的生活质量至关重要。
脊髓电刺激 最初是由Shealy在1967年首次提出运用于疼痛的治疗,现在主要用于治疗位于四肢和躯干的耐药慢性神经病理性疼痛。脊髓电刺激用于治疗慢性疼痛已有60余年历史,它是一种非破坏性的神经调节技术,是可逆的和可调节的。因此,对常规治疗无效的NP患者,在充分考虑适应证和排除禁忌证的前提下,尽早置入SCS,患者获益更大。在最近的指南中,SCS被提议作为加巴喷丁类药物和抗抑郁药物失败后的慢性(>1年)神经性疼痛的补充治疗方案。
脊髓刺激器治疗疼痛的确切原理尚未完全阐明,大多数学者仍然认为其治疗机制是1965年Melzack和Wall提出的疼痛“门控理论”。即将刺激电极置入脊柱椎管内硬膜外腔相应节段,通过电刺激激活脊髓后柱粗大Aβ纤维,此时会产生异常感觉,如麻木感、针刺感、挤压感等,然后再激活脊髓背角胶质区抑制性中间神经元,从而逆行抑制脊髓节段细小纤维痛觉信息接收,并缓解和阻断疼痛感觉经脊髓丘脑束传入高级中枢,激活高级中枢下行抑制通路,从而缓解疼痛,这主要是解释传统电刺激的镇痛机制。
然而随着技术的进步,人们发现依靠门控理论并不能完全解释SCS的镇痛原理,有待进一步深入研究SCS的镇痛机制。最近Dorrian等对电刺激改善脊髓损伤后结果的机制进行了总结:(1)电刺激可以通过激活局部神经回路并促进脊髓下方保留的、残余的输入,从而恢复病变下方的功能控制;(2)电刺激也可能调节神经胶质细胞(调节神经生理电信号传递中发挥重要作用)和神经炎症;(3)上调神经营养因子;(4)当结合长期刺激和康复时,可能促进脊髓的神经可塑性重塑和可能的轴突再生,促进损伤下的脊髓上控制。以上通过协同作用,以增强脊髓微环境,促进功能恢复。从而解释了在电刺激研究中观察到功能的恢复和疼痛的缓解。
脊髓电刺激的临床应用及前景 脊髓刺激器对下肢疼痛的治疗取得了令人鼓舞的成就,有大量研究报告SCS作为腿部疼痛的治疗。虽然同样有效,但只有少数和小型的研究专门报道了用于治疗上肢神经性疼痛。这可能与不同的患病率相关。传统的电刺激主要是紧张性电刺激,有效性已被证实,但是会产生诸如躯干或下肢不必要的感觉异常、头部运动时的感觉异常变化和上肢区域难以获得感觉异常覆盖等一系列问题。因此,新型无感觉异常刺激模式被提出来克服此问题,包括:高频SCS(high-frequencySCS)和簇状SCS(burstSCS)。目前新型刺激模式用于神经病理性疼痛相关的研究还较局限。高频SCS的电脉冲频率为5~10kHz,产生的刺激幅度低于异感阈值,故不产生异感。高频顾名思义产生的频率高于传统SCS模式,在高频率中10000Hz(10kHz或HF10)研究最多。CorderoTous等认为10kHz高频刺激可作为救治手段,有效治疗未能对传统SCS疗法作出反应的顽固性慢性疼痛患者,且无需改变脊髓硬件。有61%的患者成功通过HF10-SCS获得救助,肥胖可能限制治疗成功。
而在一项接受10kHzSCS的多中心研究中发现,经过1年的评估,89.2%的颈痛和95.0%上肢痛的受试者,疼痛较基线水平缓解≥50%,同时95.0%的受试者表示“满意及非常满意”,30.0%的受试者取消或减少了阿片类药物的摄入,受试者获得了稳定且长期的效果。此外,Hoelzer等对多个随机对照试验进行合并后发现,与传统低频脊髓刺激相比,无痛觉的10kHz脊髓刺激对于难治性糖尿病性神经病痛患者的疼痛缓解和反应率更优。簇状SCS主体为40Hz的刺激簇,每个刺激簇由5个500Hz的尖波脉冲构成,簇状SCS同样在不引起感觉异常的情况下减轻疼痛,并可能起到比传统SCS更好的神经性疼痛抑制。尽管簇状SCS近几年来才逐渐被引入临床,但因为其特有的效果,已经迅速开展起来。Deer等研究证实了burst刺激在治疗躯干和/或四肢慢性疼痛方面的安全性和疗效。该研究包括100例受试者,在12周内分别接受两种不同刺激,结果显示,burst刺激不仅不劣于传统刺激(P<0.001),而且在疼痛治疗方面更具优势(P=0.017)。70.8%的受试者更喜欢burst刺激,并且该偏好在1年后仍然持续,且安全性与其他脊髓刺激研究相似。在一项前瞻性、多中心、随机试验中,簇状和传统SCS都可显著降低慢性躯干和/或肢体疼痛患者的阿片类药物消耗量,并有15.9%的患者完全停用阿片类药物,但65.2%人群更喜欢burstSCS,仅有21.7%的人更喜欢传统性SCS(P<0.001)。burst电刺激进一步的研究还在持续进行中。目前尚缺乏比较SCS和假刺激的对照试验。假性刺激引起的短期疼痛改善率可达38%,这表明与SCS相关的安慰剂效应是不可忽视的,在未来的临床试验设计时应注意。另一项试验中,观察到burst刺激组与假刺激组相比疼痛缓解率相近。尚需要更多的研究验证。本研究患者疼痛位于C5及以下的皮节,在C4~6行传统电刺激置入,术后异感覆盖疼痛区域,但前期电压偏高患者稍有不适感,通过调整减低电压获得了满意效果,生活自理能力也得到显著改善。目前随访时间较短,尚需观察远期效果。
总之,对于颈部脊髓损伤后神经性疼痛经过长期康复及药物治疗无效的情况下,可以行脊髓电刺激,在现有科学理论上其效果安全有效,是一种理想的慢性疼痛的治疗方案。此外新型的刺激模式相较传统模式因其不会产生感觉异常,未来将会更多地运用于临床。
来源:中国矫形外科杂志2024年7月第32卷第14期
