
垂体细胞瘤2例并文献复习
作者:李政,牛朝诗,梅加明,王宣之,陈鹏,中国科学技术大学附属第一医院(安徽省立医院)神经外科
垂体细胞瘤是起源于垂体柄或神经垂体的低级别胶质瘤,其发病率低,临床上罕见。垂体细胞瘤发病以成年人居多,国外文献报道男女发病差别不显著,男女比例为1.2∶1.0。这类肿瘤生长缓慢,是良性肿瘤,WHO根据其特点归类为I级。垂体细胞瘤由于其占位效应可引起头痛 、视力
、视力 下降、视野缺损以及垂体功能低下等症状,部分病人可出现垂体功能亢进如Cushing病的变现等。
下降、视野缺损以及垂体功能低下等症状,部分病人可出现垂体功能亢进如Cushing病的变现等。
垂体细胞瘤影像学表现不典型,诊断困难,即使对于有经验的临床医生也容易误诊。目前对于其报道也局限于病例报告,本文报告2019年1月至2023年10月我科二例垂体细胞瘤的临床病例,旨在为今后此类病例的诊断和治疗带来帮助,提高对此类肿瘤的认识程度。
1.病例报道
病例1 患者,女,57岁,因“头痛5月”入院,既往有高血压病史,查体:神志清楚,精神可,对答切题,左眼视力0.5,右眼视力0.6,粗测双侧视野未见明显缺损,双侧瞳孔等大等圆,直径约3mm,光反射灵敏,四肢肌力Ⅴ级。入院时血清激素检查(见表1)。
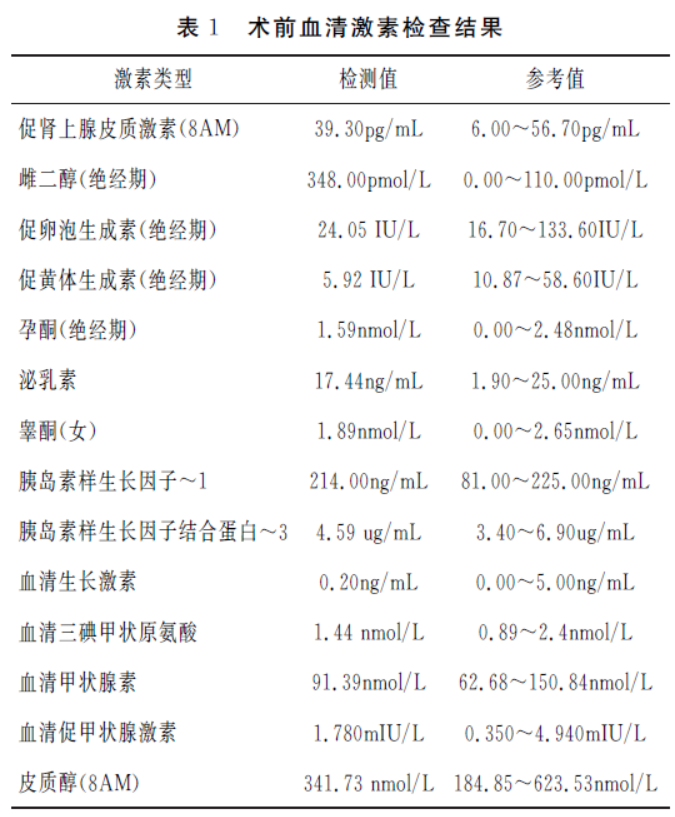
2019年11月27日我院垂体MRI平扫+增强提示:垂体上缘膨隆,垂体前上缘见一结节等T1、等T2信号,信号均匀,边界清晰,大小约1.2cm×1.1cm×1.0cm,增强后明显强化,垂体柄大致居中,双侧海绵窦内侧壁分界欠清,视交叉无明显异常;诊断意见。鞍区占位,考虑垂体瘤可能(见图1)。

术前诊断:鞍区占位:垂体腺瘤 入院后完善相关检验和检查,于2019年12月3日行CT 导航显微镜下经鼻蝶入路鞍区病变切除术。术中见:肿瘤组织呈灰白色,质地韧,血供一般,用刮匙、吸引器分块吸除肿瘤,达到镜下全切,无脑脊液鼻漏。
入院后完善相关检验和检查,于2019年12月3日行CT 导航显微镜下经鼻蝶入路鞍区病变切除术。术中见:肿瘤组织呈灰白色,质地韧,血供一般,用刮匙、吸引器分块吸除肿瘤,达到镜下全切,无脑脊液鼻漏。
术后病理:(肿瘤组织)灰红碎,径0.8cm。病理:(鞍区)符合垂体细胞瘤,WHO Ⅰ 级。免疫组化(IHC19-04243):GFAP(点状+),TTF-1(+),Vim(+),EMA(部分+),S100(+),Syn(+),CgA(-),NF(-),CK(pan)(-),Ki-67(+约1%)。患者术后门诊及电话随访4年未见复发。垂体MRI检查(2019年11月27日)提示:垂体上缘膨隆,垂体前上缘见一结节等T1、等T2信号,信号均匀,边界清晰,大小约1.2cm×1.1cm×1.0cm,增强后明显强化,垂体柄大致居中,双侧海绵窦内侧壁分界欠清,视交叉无明显异常;
病例2 患者,男,63岁,因“检查发现鞍区占位3天”入院,既往病史:发现血糖升高一周,服用二甲双胍 、阿卡波糖
、阿卡波糖 、达格列净
、达格列净 ,有右上肢骨折手术史30年,有阑尾炎手术史40年,体格检查:神志清楚,精神一般,对答切题,右眼视力0.4,左眼视力0.25,双眼视野未见明显缺损,双侧瞳孔直径约3mm,光反射灵敏,颈软,右上肢可见陈旧性手术疤痕,四肢肌力Ⅴ级、肌张力正常,双侧病理征(-)。入院时血清激素检查及糖化血红蛋白
,有右上肢骨折手术史30年,有阑尾炎手术史40年,体格检查:神志清楚,精神一般,对答切题,右眼视力0.4,左眼视力0.25,双眼视野未见明显缺损,双侧瞳孔直径约3mm,光反射灵敏,颈软,右上肢可见陈旧性手术疤痕,四肢肌力Ⅴ级、肌张力正常,双侧病理征(-)。入院时血清激素检查及糖化血红蛋白 (见表2)。
(见表2)。
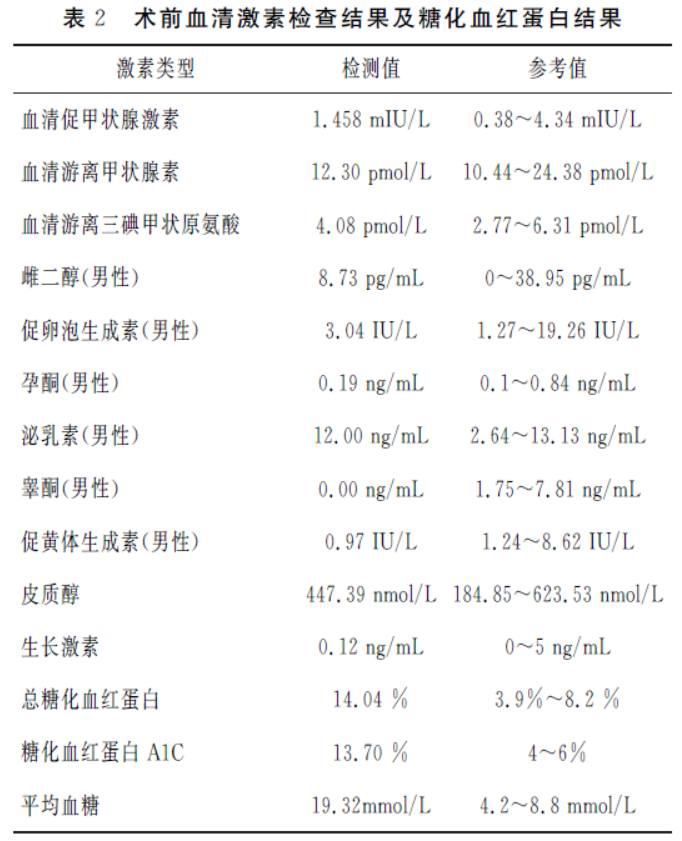
2023年6月20日我院头颅MRI平扫+增强+MRA:鞍上见一不规则等T1、稍短T2信号,信号欠均匀,边界清晰,大小约2cm×1.6cm×1.9cm,增强后明显强化,垂体柄显示不清,双侧海绵窦未见明显受累,颈内动脉海绵窦段受包绕,视交叉受压。TOF法颅脑MRA 示双侧颈内动脉显示清晰,未见狭窄与扩张。大脑动脉环完整,双侧大脑中动脉、大脑前动脉及大脑后动脉及分支走行正常,无明显局限性增粗或变细。
诊断意见:1、鞍区占位,实性颅咽管瘤可能,垂体瘤不完全除外(见图2A、B、C);术前诊断:鞍区占位:1、垂体腺瘤?2、颅咽管瘤?
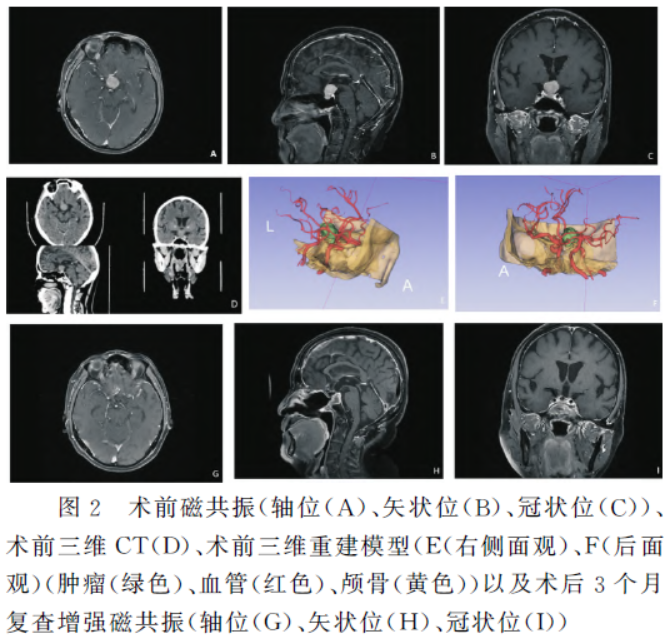
患者入院后完善术前准备,于2023年6月21日行神经内镜下经鼻蝶入路鞍区病变切除术,术中见:视交叉下方增粗的垂体柄,肿瘤以垂体柄为中心向下丘脑和三脑室生长,分离肿瘤周围蛛网膜,切开增粗的垂体柄,见肿瘤组织与垂体柄粘连紧密,先瘤内减压并留取标本,肿瘤血供非常丰富,质地稍韧,待瘤内减压后,吸除包膜内实体肿瘤组织。术中见病变与下丘脑和三脑室底粘连,予以仔细分离并切除肿瘤组织,术中三脑室开放,肿瘤组织镜下全切,垂体柄右侧部分保留(图3)。术后予以监测及控制尿量 、控制血糖、抗感染、激素等对症治疗。
、控制血糖、抗感染、激素等对症治疗。

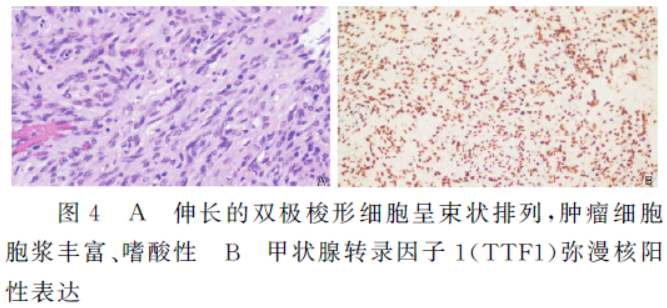
术后病理(图4):肉眼见灰黄、灰褐色碎组织,镜下见梭形肿瘤细胞条状排列;免疫组化:垂体细胞瘤(WHOI级),TTF-1(+),S100(弱+),GFAP(-),STAT-6(-),Syn(-),CK(-),EMA(-),NF(-),Ki-67(+,约2%)。病理诊断:垂体细胞瘤(WHOI级)。患者三个月后复查磁共振增强未见肿瘤复发。
2023年6月20日 术前我院头颅MRI:鞍上见一不规则增强病灶,垂体柄显示不清,双侧海绵窦未见明显受累,颈内动脉海绵窦段受包绕,视交叉受压。2023年9月23日 术后3个月我院头颅MRI:鞍底部骨质及蝶窦部分骨质缺如,蝶窦明显扩大,呈术后改变,垂体窝体积扩大,内部结构缺如,增强后残余垂体明显强化;未见肿瘤复发。
2.讨论
垂体细胞瘤这个名词是1958 年由Liss 和Kahn首先提出,2000年Brat提出了垂体细胞瘤的病理学诊断标准。随着对垂体细胞瘤的进一步研究,垂体细胞瘤被认为是一个不同于颅咽管瘤、颗粒细胞瘤、梭形嗜酸细胞瘤的实体肿瘤,并在WHO分级中划分为一种良性的鞍区胶质肿瘤(WHOI级)。根据免疫组化,垂体细胞瘤被认为由神经垂体和垂体中的特殊胶质细胞发育而来。
垂体细胞瘤是起源于神经垂体或漏斗部的一种界限清楚的低级别胶质肿瘤,由梭形细胞交错排列形成。2017年WHO垂体肿瘤分类中,垂体细胞瘤与垂体颗粒细胞瘤、梭形细胞嗜酸细胞瘤以及鞍区室管膜瘤统称为垂体后叶肿瘤。2022年第五版WHO垂体肿瘤分类将旧版分类的鞍区颗粒细胞瘤、梭形细胞嗜酸细胞瘤、鞍区室管膜瘤归类为垂体细胞瘤的亚型,重新命名为颗粒垂体细胞瘤、嗜酸细胞垂体细胞瘤和室管膜垂体细胞瘤,它们分别对应正常垂体后叶细胞的嗜酸性细胞、颗粒细胞和类似于室管膜细胞表达的细胞亚型。垂体细胞瘤都表达甲状腺转录因子1(TTF1),该基因是内侧下丘脑和垂体后叶的标志物。
垂体细胞瘤患者的临床症状主要根据肿瘤的大小和位置不同而异。肿瘤的占位效应可以引起视力或视野的缺损、垂体柄受压会引起垂体功能低下、高泌乳素血症等内分泌紊乱。患者还可有头痛、恶心、呕吐、头晕、乏力等症状,部分病例可有肿瘤卒中的变现,如视力急剧下降甚至失明、剧烈头痛,激素水平低下等。
在大多数患者中发现存在部分或完全的垂体功能低下,但没有尿崩症 。这可能由于肿瘤起初在垂体柄的底部,逐渐向背侧、非破坏性的进展,影响下丘脑神经垂体束,会使垂体后叶素
。这可能由于肿瘤起初在垂体柄的底部,逐渐向背侧、非破坏性的进展,影响下丘脑神经垂体束,会使垂体后叶素 渗漏进入循环之中。
渗漏进入循环之中。
本研究中第二例患者虽然由于偶然检查发现鞍区占位入院,但入院时检查发现双眼视力下降,磁共振检查提示视神经受压,视力下降与肿瘤的占位效应有关。患者入院时检查发现性激素全套检查提示睾酮(男性)0.00ng/ml,考虑肿瘤引起内分泌紊乱。此外,垂体细胞瘤与垂体高分泌综合征存在一定的关系,这主要下丘脑——垂体——肾上腺皮质轴受到影响,肿瘤可引起微环境变化导致垂体细胞分泌过度活跃。
当肿瘤侵犯到鞍旁结构以及颞叶时,患者可出现动眼神经麻痹 、癫痫
、癫痫 等症状。当三脑室底受到波及可出现下丘脑综合征,有垂体功能障碍、尿崩症、体温不稳定、睡眠障碍
等症状。当三脑室底受到波及可出现下丘脑综合征,有垂体功能障碍、尿崩症、体温不稳定、睡眠障碍 、体重增加等表现。同时,下丘脑综合征也提示肿瘤可能起源或邻近下丘脑-垂体轴。垂体细胞瘤是鞍内或鞍上的实性肿瘤,CT 或磁共振上表现为界限清楚、密度或信号均匀,部分病例可有蝶鞍的扩大和骨质破坏或增生。这些影像学表现和垂体腺瘤类似。垂体细胞瘤的MRI表现为T1低信号或等信号,T2 高信号,肿瘤均匀强化,这提示肿瘤血供丰富。
、体重增加等表现。同时,下丘脑综合征也提示肿瘤可能起源或邻近下丘脑-垂体轴。垂体细胞瘤是鞍内或鞍上的实性肿瘤,CT 或磁共振上表现为界限清楚、密度或信号均匀,部分病例可有蝶鞍的扩大和骨质破坏或增生。这些影像学表现和垂体腺瘤类似。垂体细胞瘤的MRI表现为T1低信号或等信号,T2 高信号,肿瘤均匀强化,这提示肿瘤血供丰富。
垂体腺瘤的强化往往出现在晚期,而垂体细胞瘤早期快速、动态强化。Gibbs等发现病灶强化的速度与肿瘤供血血管增加有关。大多数肿瘤信号均匀,也有部分呈混杂信号。有研究报道垂体细胞瘤若血供丰富在T2加权相上可以看到血管流空影,这值得我们注意。
在影像学上需要与脑膜瘤 、颅咽管瘤、胶质瘤、血管外皮细胞瘤相鉴别。由于垂体细胞瘤的影像学表现没有特异性,术前鉴别这些肿瘤相对困难。影像学表现上,小的鞍区垂体细胞瘤容易与垂体微腺瘤混淆,尤其是当患者存在激素分泌过多的情况。本研究中病例一患者肿瘤局限于鞍内,术前诊断为垂体腺瘤,通过病理诊断才确诊为垂体细胞瘤。鞍区炎性病变(淋巴细胞性垂体炎、肉芽肿性垂体炎)也需要鉴别,这好发于30岁以内,临床表现一般以尿崩症为首发症状,并伴有全身性炎症(肉芽肿病、感染和自身免疫性疾病)。
、颅咽管瘤、胶质瘤、血管外皮细胞瘤相鉴别。由于垂体细胞瘤的影像学表现没有特异性,术前鉴别这些肿瘤相对困难。影像学表现上,小的鞍区垂体细胞瘤容易与垂体微腺瘤混淆,尤其是当患者存在激素分泌过多的情况。本研究中病例一患者肿瘤局限于鞍内,术前诊断为垂体腺瘤,通过病理诊断才确诊为垂体细胞瘤。鞍区炎性病变(淋巴细胞性垂体炎、肉芽肿性垂体炎)也需要鉴别,这好发于30岁以内,临床表现一般以尿崩症为首发症状,并伴有全身性炎症(肉芽肿病、感染和自身免疫性疾病)。
对于位于鞍区的大型垂体细胞瘤,伴有骨质的破坏和鞍上、海绵窦的扩张,容易与垂体大腺瘤混淆。位于漏斗处的大型垂体细胞瘤需要与星形细胞瘤、三脑室脊索样胶质瘤和颅咽管瘤鉴别。垂体细胞瘤没有钙化表现,并很少有囊变,这可以帮助我们与鞍区的颅咽管瘤区分。本研究中病例二患者术前影像学资料未见钙化表现,肿瘤呈实性均匀性病灶,术前诊断考虑存在鳞状乳头型颅咽管瘤的可能。垂体细胞瘤通过影像学确诊困难,最终诊断需要由组织病理和免疫组化决定。
2016年WHO 神经系统肿瘤分类中垂体细胞瘤是一种低级别的实性胶质细胞瘤,它起源于神经垂体和漏斗部,来源于垂体细胞。垂体细胞瘤由双极梭形细胞交错排列成栅栏、成束状或漩涡状结构形成。垂体细胞瘤的免疫组化,TTF-1表达呈强阳性,GFAP 表达为阴性或低- 中阳性染色。TTF-1、S-100、Vim 弥漫表达为垂体细胞瘤的主要免疫表型。近年来研究发现垂体细胞瘤细胞核弥漫表达TTF1。垂体后叶肿瘤如鞍区垂体细胞瘤、梭形细胞嗜酸细胞瘤和颗粒细胞瘤均一致表达TTF1,表明肿瘤起源一致。2016版WHO 中枢神经系统肿瘤分类中也接受了三者同源的观点。
有研究总结垂体细胞瘤的形态学结构特点如下:①梭形细胞弥漫性束状;②上皮样细胞假腺样或裂隙状;③围血管乳头状、菊形团状室管膜样结构。这些鉴别诊断中最主要是与同为中枢神经系统肿瘤的TTF-1阳性的鞍区颗粒细胞瘤和梭形细胞嗜酸细胞瘤的区分。
垂体细胞瘤细胞一般异型性小,细胞质丰富、弱嗜酸性,核卵圆形,核分裂象罕见。组织内可见微囊形成,间质小血管丰富,内皮细胞无增生。免疫组织化学标记肿瘤细胞表达S-100蛋白、波形蛋白,可不同程度表达GFAP,这证实了肿瘤神经胶质起源。50%垂体细胞瘤可出现突触素阳性表达。部分典型的垂体细胞瘤表达EMA。
垂体腺瘤激素(如促肾上腺皮质激素 、泌乳素等)均呈阴性,Ki-67阳性指数低。垂体细胞瘤的治疗手段首选手术治疗,辅助放疗的疗效尚不清楚,还需要进一步研究。Chen等报道,非肉眼全切除是肿瘤复发的唯一显著的预后因素。垂体细胞瘤全切后复发率低,尚且没有恶性转化或脑脊液播散的报道。手术的策略主要根据肿瘤的大小、肿瘤对周围重要组织是否有侵袭以及手术医生擅长的手术方式决定。
、泌乳素等)均呈阴性,Ki-67阳性指数低。垂体细胞瘤的治疗手段首选手术治疗,辅助放疗的疗效尚不清楚,还需要进一步研究。Chen等报道,非肉眼全切除是肿瘤复发的唯一显著的预后因素。垂体细胞瘤全切后复发率低,尚且没有恶性转化或脑脊液播散的报道。手术的策略主要根据肿瘤的大小、肿瘤对周围重要组织是否有侵袭以及手术医生擅长的手术方式决定。
目前的手术方式有开颅翼点入路、内镜下或显微镜下经鼻蝶入路,术后有感染、神经血管损伤、脑脊液漏、垂体功能低下等风险。术中切除肿瘤时应考虑垂体功能的保护,对于肿瘤无法全切的病例应考虑术后进行放疗。对于无症状的患者也可考虑定期随访,当出现症状时可考虑进行手术。由于肿瘤对周围结构的侵袭,手术风险和难度较早期手术增加。
垂体细胞瘤全切难度大,主要在于:①肿瘤与邻近结构界限不清晰,全切可能会导致术后内分泌功能障碍;②肿瘤血供丰富,术中可能会大出血。术前进行栓塞对全切肿瘤有一定的帮助。病例二报道中发现病灶时肿瘤体积大,术中血供丰富,尽管术中全切肿瘤,但术中出血多,术后患者存在垂体功能低下、尿崩症等并发症出现,术后予以激素替代等治疗。对于巨大的垂体细胞瘤,可以通过双镜联合的方式(经鼻内镜和开颅联合)切除肿瘤,从而更加彻底的切除肿瘤,降低肿瘤复发的几率。
经鼻蝶内镜手术可以提供更宽阔的手术通道及手术视野,可以更好的切除显微镜下切除困难的肿瘤。但是当肿瘤在手术通道视野旁时,由于视野差,经鼻蝶手术切除肿瘤变得困难。在视野不充分的情况下切除肿瘤,可出现出血、肿瘤残留等。
开颅同时联合内镜手术,可以为切除肿瘤提供更好的安全性:①内镜无法观察到的肿瘤,通过开颅手术的视野进行切除;②对于关键的神经血管结构上的肿瘤可以更好的剥离;③经颅侧手术医生可以通过经颅侧手术视野为经鼻侧手术视野提供目标引导,避免不必要的神经、血管损伤。④即使肿瘤不能完全切除,对于肿瘤出血,开颅联合经鼻可以更好的止血。
垂体细胞瘤发病率低,国内外目前有许多病例报道,仍没有大规模的临床研究。目前术前对垂体细胞瘤的诊断及认识仍不够,多数在术后才能确定。垂体细胞瘤由于其解剖位置以及临床表现容易误诊为垂体腺瘤。目前报道垂体细胞瘤复发率低,预后良好。手术是主要的治疗方法,手术应力求全切肿瘤。若肿瘤血供丰富,可术前行肿瘤部分栓塞。对于次全切的肿瘤,应定期随访。
来源:李政,牛朝诗,梅加明,等.垂体细胞瘤2例并文献复习[J].立体定向和功能性神经外科杂志,2024,37(01):48-53.
