
子宫内膜中肾样腺癌累及宫颈管间质一例
作者:饶慧,卢娇兰,周欢,李雄等,江汉大学医学部,华中科技大学同济医学院附属武汉中心医院妇科
子宫内膜癌 (endometrial carcinoma)又称子宫体癌,是发生于子宫内膜的一组上皮性肿瘤,发病率居女性生殖器官恶性肿瘤第2位[1] 。中肾样腺癌(mesonephric-like adenocarcinoma,MLA)于2016年首次被报道,是一种主要发生于子宫内膜和卵巢的特殊类型腺癌,因其组织形态、免疫表型和分子特征等方面与中肾腺癌(mesonephric adenocarcinoma,MA)类似,特此命名[2] 。2020年MLA纳入第5版世界卫生组织女性生殖器官肿瘤组织病理学分类[3] ,约占子
(endometrial carcinoma)又称子宫体癌,是发生于子宫内膜的一组上皮性肿瘤,发病率居女性生殖器官恶性肿瘤第2位[1] 。中肾样腺癌(mesonephric-like adenocarcinoma,MLA)于2016年首次被报道,是一种主要发生于子宫内膜和卵巢的特殊类型腺癌,因其组织形态、免疫表型和分子特征等方面与中肾腺癌(mesonephric adenocarcinoma,MA)类似,特此命名[2] 。2020年MLA纳入第5版世界卫生组织女性生殖器官肿瘤组织病理学分类[3] ,约占子
宫内膜癌的1%[4] 。MLA组织起源不明,目前有两种主流假说:一部分学者认为其直接来源于米勒管;另一部分学者发现其与米勒管肿瘤共存,认为其可能来源于米勒管肿瘤[5] ,关于该病的组织来源需进一步研究。现报道1例华中科技大学同济医学院附属武汉中心医院(我院)收治的子宫内膜MLA累及宫颈管间质的患者的诊疗经过。
1病例报告
患者女,64岁,因阴道流液2次,不规则阴道出血20余天,于2022年11月16日至我院妇科就诊。患者平素月经规则,50岁绝经,孕1产1,自然分娩。自诉2年前无明显诱因出现阴道流液1次,呈淡黄色,有异味,量少,未行诊治,后自行好转。
2022年10月24日再次出现大量阴道流液,呈黄色,随后开始出现阴道出血,量多,呈鲜红色,无血块,未经处理,1 d后出血逐渐减少,呈淡红色血水样。患者未行治疗,阴道出血持续20余天未净,量少于以往月经量,无头晕、心慌,无同房出血等不适。2022年10月26日我院子宫附件彩色超声示:子宫肌层质地不均,宫腔积液(1.9 cm×0.5 cm),双侧附件区未见明显异常,盆腔未见积液。妇科检查 :外阴已婚式,尿道口可见一大小约0.5 cm×0.5 cm新生物,阴道畅,可见少许血液来自宫口,宫颈光滑,子宫前位,正常大小,质中,活动度可,无压痛,双侧附件区未及明显异常。
:外阴已婚式,尿道口可见一大小约0.5 cm×0.5 cm新生物,阴道畅,可见少许血液来自宫口,宫颈光滑,子宫前位,正常大小,质中,活动度可,无压痛,双侧附件区未及明显异常。
入院查血常规 、凝血常规、肝肾功能、电解质、输血
、凝血常规、肝肾功能、电解质、输血 前检查、梅毒螺旋体
前检查、梅毒螺旋体 特异性抗体、肿瘤标志物
特异性抗体、肿瘤标志物 糖类抗原125(CA125)、宫颈液基薄层细胞学检查(TCT)及人乳头瘤病毒(HPV)未见明显异常。CA19-9:56.65 U/mL(升高,↑)。2022年11月18日行宫腔镜
糖类抗原125(CA125)、宫颈液基薄层细胞学检查(TCT)及人乳头瘤病毒(HPV)未见明显异常。CA19-9:56.65 U/mL(升高,↑)。2022年11月18日行宫腔镜 检查术,镜下见:宫腔体积增大,子宫内膜杂乱,可见粗大腺体开口处异形血管;宫腔后壁、前壁及侧壁均可见灰白色新生物,似累及子宫肌层,双侧输卵管开口遮蔽;宫颈管形态正常,未见新生物。术后病理检查
检查术,镜下见:宫腔体积增大,子宫内膜杂乱,可见粗大腺体开口处异形血管;宫腔后壁、前壁及侧壁均可见灰白色新生物,似累及子宫肌层,双侧输卵管开口遮蔽;宫颈管形态正常,未见新生物。术后病理检查 :(宫腔新生物、诊刮组织)高级别腺癌,结合镜下形态及免疫标记,符合子宫内膜样癌[国际妇产科联盟(International Federation ofGynecology and Obstetrics,FIGO)3级]伴局部鳞状分化。免疫组织化学示:配对盒基因-8(paired box gene-8,Pax-8)、波形蛋白(Vimentin)阳性,广谱细胞角蛋白(pan-cytokeratin,PanCK)、上皮膜抗原(epithelial membrane antigen,EMA)大部分阳性,CK7部分阳性,P53野生型,P16斑驳阳性,K903、钙结合蛋白(Calretinin)局灶阳性,P63少许阳性,雌激素
:(宫腔新生物、诊刮组织)高级别腺癌,结合镜下形态及免疫标记,符合子宫内膜样癌[国际妇产科联盟(International Federation ofGynecology and Obstetrics,FIGO)3级]伴局部鳞状分化。免疫组织化学示:配对盒基因-8(paired box gene-8,Pax-8)、波形蛋白(Vimentin)阳性,广谱细胞角蛋白(pan-cytokeratin,PanCK)、上皮膜抗原(epithelial membrane antigen,EMA)大部分阳性,CK7部分阳性,P53野生型,P16斑驳阳性,K903、钙结合蛋白(Calretinin)局灶阳性,P63少许阳性,雌激素 受体(estrogen receptor,ER)、孕激素
受体(estrogen receptor,ER)、孕激素 受体(progesterone receptor,PR)极少许阳性,CK20、天冬氨酸蛋白酶A(NapsinA)、肝细胞核因子-1β(hepatocyte nuclear factor-1β,HNF-1β)、白细胞分化抗原15(cluster of differentiation,CD15)、抑制素α(αinhibin)阴性,CD10间质阳性,β-连环蛋白(β-catenin)膜浆阳性,Ki-67标记指数(Ki-67 labeling index,Ki-67 LI)热点区约50%。
受体(progesterone receptor,PR)极少许阳性,CK20、天冬氨酸蛋白酶A(NapsinA)、肝细胞核因子-1β(hepatocyte nuclear factor-1β,HNF-1β)、白细胞分化抗原15(cluster of differentiation,CD15)、抑制素α(αinhibin)阴性,CD10间质阳性,β-连环蛋白(β-catenin)膜浆阳性,Ki-67标记指数(Ki-67 labeling index,Ki-67 LI)热点区约50%。
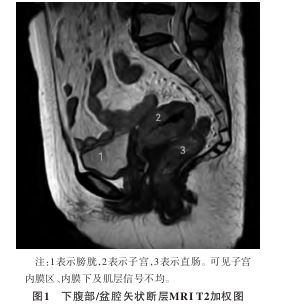
2022年11月23日继续完善相关检查:下腹部/盆腔磁共振成像 (magnetic resonance imaging,MRI)平扫+增强示:子宫体占位病变,累及宫颈间质,考虑子宫内膜癌Ⅱb期(见图1)。全腹部多排CT平扫
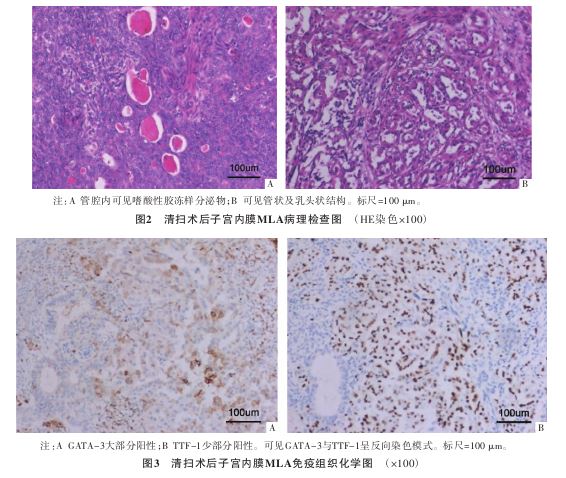
(magnetic resonance imaging,MRI)平扫+增强示:子宫体占位病变,累及宫颈间质,考虑子宫内膜癌Ⅱb期(见图1)。全腹部多排CT平扫 +三维重建示:轻度脂肪肝;左肾盂低密度灶,需鉴别肾盂旁囊肿与肾积水及肾肿瘤;子宫体积饱满,宫腔密度不均。经阴道子宫附件彩色超声示:子宫增大(相对性);子宫底和子宫体后壁子宫内膜局限性不规则明显增厚,质地不均,血流较丰富,考虑为子宫内膜癌,侵犯局部肌层>1/2,宫颈多发囊肿,右侧卵巢萎缩,未见异常显示,盆腔未见明显积液。告知患者及家属目前检查提示子宫内膜恶性肿瘤,建议限期手术,患者及家属要求手术治疗。完善相关检查,无明显手术禁忌证,于2022年12月1日行经腹筋膜外全子宫切除术+双侧卵巢动静脉高位结扎术+双侧输卵管卵巢切除术+腹主动脉旁淋巴结切除术+盆腔淋巴结清扫术,留腹腔冲洗液送病理检查。术后标本:子宫增大似孕1个月大小,肌层稍厚,质地僵硬,切开可见宫腔少许血块,内膜广泛异常,呈颗粒样改变,病灶至宫腔下段,未达宫颈内口,以后壁及左侧宫角部尤为显著,左侧宫角部肉眼见似侵犯子宫肌层1/2;双侧输卵管卵巢外观未见明显异常;双侧各组盆腔淋巴结组织及腹主动脉旁淋巴结组织未见明显异常。术后病理检查:①(腹腔冲洗液)镜下呈血细胞背景,可见淋巴细胞、中性粒细胞,未见肿瘤细胞。②子宫内膜高级别腺癌,结合镜下形态及免疫标记,符合MLA,侵犯深肌层(>1/2肌层),并向下侵犯宫颈管间质,可见脉管内癌栓,未见明确神经侵犯(见图2);免疫组织化学示(见图3):Pax-8、Vimentin阳性,GATA结合蛋白-3(GATA binding protein-3,GATA-3)大部分阳性,甲状腺转录因子-1(thyroid transcription factor-1,TTF-1)、CD10少部分阳性,ER、CK7、Calretinin、K903局灶阳性,P16斑驳阳性,错配修复蛋白MLH1、MSH2、MSH6、PMS2阳性,PR、WT1基因(Wilms tumor gene 1,WT1)、HNF-1β、NapsinA阴性,P53野生型,Ki-67 LI热点区约40%。特殊染色:PAS阳性。③慢性子宫颈炎
+三维重建示:轻度脂肪肝;左肾盂低密度灶,需鉴别肾盂旁囊肿与肾积水及肾肿瘤;子宫体积饱满,宫腔密度不均。经阴道子宫附件彩色超声示:子宫增大(相对性);子宫底和子宫体后壁子宫内膜局限性不规则明显增厚,质地不均,血流较丰富,考虑为子宫内膜癌,侵犯局部肌层>1/2,宫颈多发囊肿,右侧卵巢萎缩,未见异常显示,盆腔未见明显积液。告知患者及家属目前检查提示子宫内膜恶性肿瘤,建议限期手术,患者及家属要求手术治疗。完善相关检查,无明显手术禁忌证,于2022年12月1日行经腹筋膜外全子宫切除术+双侧卵巢动静脉高位结扎术+双侧输卵管卵巢切除术+腹主动脉旁淋巴结切除术+盆腔淋巴结清扫术,留腹腔冲洗液送病理检查。术后标本:子宫增大似孕1个月大小,肌层稍厚,质地僵硬,切开可见宫腔少许血块,内膜广泛异常,呈颗粒样改变,病灶至宫腔下段,未达宫颈内口,以后壁及左侧宫角部尤为显著,左侧宫角部肉眼见似侵犯子宫肌层1/2;双侧输卵管卵巢外观未见明显异常;双侧各组盆腔淋巴结组织及腹主动脉旁淋巴结组织未见明显异常。术后病理检查:①(腹腔冲洗液)镜下呈血细胞背景,可见淋巴细胞、中性粒细胞,未见肿瘤细胞。②子宫内膜高级别腺癌,结合镜下形态及免疫标记,符合MLA,侵犯深肌层(>1/2肌层),并向下侵犯宫颈管间质,可见脉管内癌栓,未见明确神经侵犯(见图2);免疫组织化学示(见图3):Pax-8、Vimentin阳性,GATA结合蛋白-3(GATA binding protein-3,GATA-3)大部分阳性,甲状腺转录因子-1(thyroid transcription factor-1,TTF-1)、CD10少部分阳性,ER、CK7、Calretinin、K903局灶阳性,P16斑驳阳性,错配修复蛋白MLH1、MSH2、MSH6、PMS2阳性,PR、WT1基因(Wilms tumor gene 1,WT1)、HNF-1β、NapsinA阴性,P53野生型,Ki-67 LI热点区约40%。特殊染色:PAS阳性。③慢性子宫颈炎 伴鳞状上皮化生及潴留囊肿形成。④双侧输卵管、卵巢未见癌累及。⑤双侧韧带切缘未见癌累及。⑥淋巴结(腹主动脉旁)10枚、(左侧盆腔)10枚、(右侧盆腔)9枚均未见癌转移。诊断:子宫内膜MLAⅡ期。术后行5个周期紫杉醇
伴鳞状上皮化生及潴留囊肿形成。④双侧输卵管、卵巢未见癌累及。⑤双侧韧带切缘未见癌累及。⑥淋巴结(腹主动脉旁)10枚、(左侧盆腔)10枚、(右侧盆腔)9枚均未见癌转移。诊断:子宫内膜MLAⅡ期。术后行5个周期紫杉醇 +卡铂
+卡铂 化疗,定位并勾画靶区行1个疗程盆腔放疗(45 Gy/1.8 Gy/25F)和1次阴道残端后装近距离放疗(12 Gy/6 Gy/2 F)。治疗结束后自2023年6月10日随访至2024年4月10日,未见疾病复发转移。
化疗,定位并勾画靶区行1个疗程盆腔放疗(45 Gy/1.8 Gy/25F)和1次阴道残端后装近距离放疗(12 Gy/6 Gy/2 F)。治疗结束后自2023年6月10日随访至2024年4月10日,未见疾病复发转移。
2讨论
MLA较为罕见,临床表现及影像学检查无特殊性,且病理结构模式与其他肿瘤有重叠,因此诊断较为困难,容易漏诊。通过活检、刮宫术或宫腔镜取少许内膜组织进行病理检查时,可因取材不足或取材部位选取不当等问题产生诊断误差,仅少数病例被正确诊断[5-6] 。因此为确保诊断的准确性,需手术医生及病理医生互相配合,提高警惕。
2.1诊断子宫内膜MLA好发于绝经后女性,发病年龄28~91岁,平均诊断年龄为60岁[7] 。常以绝经后阴道出血为首发症状,伴有阴道异常排液、腹部疼痛等不适,CA125、CA19-9和人附睾蛋白4等血清肿瘤标志物可升高,经彩色超声、盆腔CT和MRI等检查发现子宫占位性病变,直径1.0~14.0 cm不等,并伴有不同程度的子宫肌层受累[8] 。该病侵袭性较强,容易复发和转移,最常见的远处转移部位为肺部,少数病例可见肝转移[9] 。由于其临床表现及检查结果无特异性,术前诊断较为困难。常规组织病理学检查为诊断的金标准。子宫内膜MLA大部分起自子宫内膜,并向深肌层浸润。镜下可见多种组织形态,如腺管状、小管状、乳头状、网状和实性等,以小管状及腺管状最常见,特征性病理改变为管腔内嗜酸性胶冻样物质[10] 。免疫组织化学常表现为GATA-3、TTF-1及CD10阳性,P53野生型,ER、PR大部分呈阴性表达,少部分病例ER呈阳性[11-12] 。其中GATA-3、TTF-1的敏感度和特异度较高,达90%以上[13] ,常呈不均一表达,并存在反向表达模式[11] ,故联合使用GATA-3、TTF-1可减少误诊和漏诊的可能。绝经后女性为子宫内膜癌的高发人群,妇科医生对该类患者进行诊治时应提高警惕。本例患者因绝经后阴道出血、流液就诊,初次手术行宫腔镜检查,术后病理检查提示子宫内膜样癌。二次手术行根治性手术,组织病理学检查镜下见管状、乳头状结构及管腔内嗜酸性胶冻样分泌物,免疫组织化学表现为GATA-3和TTF-1呈反向染色模式,为子宫内膜MLA的特征性病理改变。两次病理检查结果产生的差异考虑取材部位不当、取材不足或因该病较罕见缺乏相关经验而造成的诊断误差,提示医生在手术操作中以及病理诊断时需提高警惕。
2.2鉴别诊断因其与MA具有相似性,故需与MA相鉴别。MA原发于宫颈及阴道壁,病变周围存在中肾残件或增生,缺乏米勒管源性肿瘤相关分子改变[14] 。
MLA起源与米勒管密切相关,可与米勒管源性病变合并存在,因此还需与米勒管源性恶性肿瘤如低级别子宫内膜样癌、浆液性癌、透明细胞癌及癌肉瘤等相鉴别[12] 。通过疾病的原发部位、组织学形态以及免疫表型等可进行区分。转移性癌如结直肠癌 、肺腺癌、甲状腺癌
、肺腺癌、甲状腺癌 、神经内分泌癌及乳腺癌
、神经内分泌癌及乳腺癌 等结合影像学检查,确定肿瘤原发部位,了解既往病史,通过免疫学和分子检测方法诊断。
等结合影像学检查,确定肿瘤原发部位,了解既往病史,通过免疫学和分子检测方法诊断。
2.3治疗子宫内膜MLA大部分发现时已处于疾病晚期,疗效尚不确切,目前尚无特异性的治疗方案。综合既往病例,该病以手术治疗为主,行全子宫+双侧附件±腹主动脉旁及盆腔淋巴结清扫±种植或转移灶切除,部分患者术后辅以放化疗或激素治疗等[9] 。目前研究表明,几乎所有患者诊断后均行手术治疗,化疗常选择紫杉醇联合卡铂,且反应较好[15] 。
对于Ⅰ~Ⅱ期高风险特殊病理组织类型的子宫内膜癌,考虑行盆腔外照射放疗;对伴有阴道切缘阳性或癌灶边缘距切缘较近或宫颈间质受累者,加用阴道后装近距离放疗[16] 。但由于该病较为罕见,目前报道的病例较少且随访时间较短,辅助放化疗的最佳方案和疗效仍未知。但有文献报道1例早期子宫内膜MLA患者手术治疗后未行放化疗,3年后发现盆腹腔转移灶[17] 。而3例早期患者术后行辅助放化疗后长期存活,随访期间未发现转移[18] 。由此可见,对于早期MLA患者,术后也需积极进行辅助治疗。
本例患者共行两次手术,初次手术行宫腔镜检查,术中怀疑恶变可能,选取部分典型组织送病理检查提示子宫内膜样癌。遂二次手术行经腹筋膜外全子宫切除术+双侧卵巢动静脉高位结扎术+双侧输卵管卵巢切除术+腹主动脉旁淋巴结切除术+盆腔淋巴结清扫术。术后病理检查提示子宫内膜MLA累及宫颈管间质,根据2023年FIGO子宫内膜癌分期标准[19] ,本例符合子宫内膜MLAⅡ期。作为子宫内膜癌的一种特殊病理组织类型,因其侵袭性较强,易复发转移,需积极进行辅助放化疗,疾病早期即进行辅助治疗可延长患者的生存时间。综合评估患者病情后,术后1个月开始进行辅助治疗,行5个周期紫杉醇联合卡铂化疗、1个疗程盆腔外照射放疗和1次阴道残端后装近距离放疗,截至末次随访时间2024年4月10日,未见疾病复发及转移。但考虑到随访时间较短,辅助放化疗的疗效暂未知,后期需继续对患者进行随访,以做到早发现、早诊断及早治疗,延长患者的生存时间。
综上所述,子宫内膜MLA是一种罕见的妇科恶性肿瘤。临床表现及影像学检查与子宫内膜其他类型癌症相似,极易混淆,常于病理检查时发现,需特别留意,以防漏诊。其典型病理改变为管腔内嗜酸性胶冻样物质,免疫组织化学显示GATA-3和TTF-1呈反向染色模式。虽然目前暂无最佳治疗方案,但由于该病较易复发转移,一经确诊需尽早手术治疗,并积极行辅助治疗,且需密切随访,以便早期发现疾病复发及转移情况,尽早处理,以延长患者的生存时间。
参考文献略。
来源:饶慧,卢娇兰,周欢,等.子宫内膜中肾样腺癌累及宫颈管间质一例[J].国际生殖健康/计划生育杂志,2024,43(05):410-414.
