
B型胰岛素抵抗综合征一例报道
作者:俞亭嫣,郭凯,张雪莲,张晓燕等,同济大学附属杨浦医院内分泌科
B型胰岛素抵抗综合征(TBIR)是一种罕见的自身免疫性疾病,是人体存在针对Ins受体的自身抗体,导致严重难治性高血糖或顽固性低血糖。本文报道1例TBIR患者病情特点及诊治经过。
患者,女,54岁,因“体重下降1年,头晕乏力加重1 周”于2023 年4 月入院。否认既往DM、高血压等慢性疾病史,否认遗传性疾病家族史。1年前行胆囊切除术。近 1 年面容变化大,体重降低约15 kg,反复晨起时头晕,自测FBG 2~3 mmol/L,调整饮食,于睡前加餐后晨起低血糖缓解,患者近1周头晕、乏力明显加重,伴口干、纳差,于我院门诊检查 FPG 4. 24 mmol/L,FIns 147. 32 μU/ml,FC‐P 0. 366 nmol/L,1 hPG 17. 62 mmol/L,1 hIns>967. 95 μU/ml,1 hC ‐ P 6. 34 nmol/L,2 hPG22. 95 mmol/L,2 hIns>967. 95 μU/ml,2 hC ‐ P 6. 55 nmol/L。查体:神清,身高159 cm,体重48 kg,BMI 19 kg/m2,BP 112/78 mmHg,口周、唇及眼周区域皮肤颜色加深,腋下、颈后及腹股沟明显黑棘皮症,心肺腹部(-),双下肢轻度水肿,病理征(-)。患者入院后完善检查:糖化白蛋白 29. 06%,HbA1c 8. 3%。肝肾功能、电解质、血脂、心肌酶谱及甲功均正常,IAA、GADAb 阴性,尿糖(++)。血 常 规 :白 细 胞 计 数 3. 1×109/L,红 细 胞 计 数2. 83×1012/L,血 红 蛋 白 85 g/L,血 小 板 总 数109×109/L,红细胞压积26. 3%,中性粒细胞计数1. 77×109/L,淋巴细胞计数1. 06×109/L,红细胞分布宽度15. 9%,血小板平均体积13. 6 fL,红细胞沉降率 85 mm/h,血清铁 5. 7 μmol/L,总铁结合力27 μmol/L。免疫 指 标 :抗 核 抗 体 阳 性(颗 粒型),抗 SmD1 抗 体(++),抗 SSA/Ro52kd 抗体(+++),抗 U1‐snRNP 抗体(++),κ 轻链8. 25 g/L,λ轻链5. 96 g/L,电泳γ球蛋白46. 75%。性腺:睾酮97. 43 ng/dl,余正常。凝血功能:D‐二聚体0. 85,余正常。胰腺增强核磁未见异常。胸部 CT 示肺小结节,两侧腋窝多发肿大淋巴结。胃肠镜示活动性胃炎,结肠多发息肉。肝胆胰脾肾超声示肝内血管瘤,胆囊术后改变,右肾肾盂分离。彩超甲状腺及四肢血管、心电图、24 h动态血压、动态心电图未见异常。DM相关致病基因检测结果为阴性。
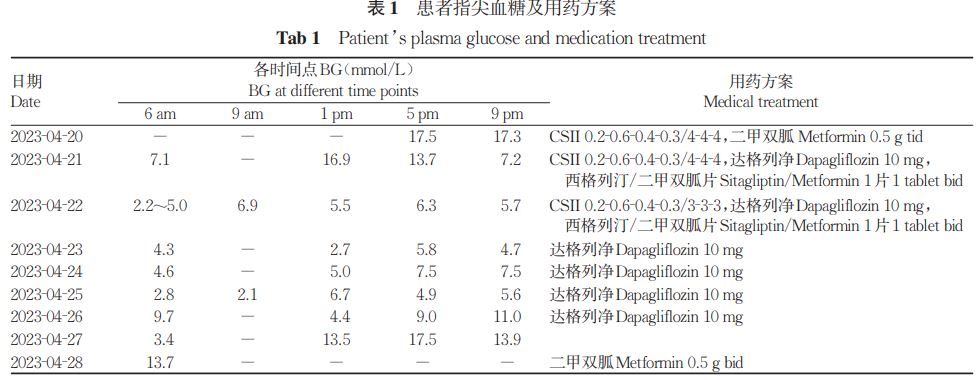
入院诊疗经过:患者入院后予胰岛素泵(CSII)联合口服降糖药物(二甲双胍、达格列净、西格列汀)控制血糖,补铁等对症治疗。CSII 治疗2 d 后出现反复空腹低血糖,逐渐减量至停用所有降糖药物并调整为多次进餐后血糖尚平稳,但数日后再次出现餐后高血糖,口服二甲双胍0. 5 g,2次/d。患者指尖血糖及用药方案见表1。
讨 论
本例患者临床特征为餐后高血糖与空腹顽固性低血糖,合并极高胰岛素血症、睾酮升高、血沉加快、抗核抗体等阳性,表现为严重IR、黑棘皮症及高雄激素血症等特征性表型,考虑严重胰岛素抵抗综合征(SSIR)。在排除胰源性、药物性、胰岛素自身免疫综合征、遗传性基因相关糖尿病及其他病因的SSIR后,明确诊断为TBIR[1]。
SSIR 临床特点是明显高胰岛素血症,伴黑棘皮症、卵巢性高雄激素血症,因遗传性或获得性胰岛素受体病引起,也可由Ins信号转导系统的基因或蛋白质降解酶基因突变所致,还见于遗传性或获得性脂肪营养不良患者。Ins受体病分为遗传性Ins 受体基因突变病和获得性 Ins 受体自身免疫病[2]。TBIR自1975年首次报道至今尚不足百例,80%为女性,多为成年人甚至老年人,尤其是非洲裔成年女性[3‐5]。日本一项研究[6]显示,男性与女性TBIR患病人数为19∶11,好发于60岁。TBIR 由循环中针对Ins 受体的多克隆IgG 抗体引起,与 Ins 受体 α 亚单位 C 端氨基酸残基540‐601免疫原结构域结合,除阻断生物学效应外,可促进复合体内化,受体降解致细胞表面Ins受体减少而发生IR。部分自身抗体与受体结合可激活受体酪氨酸磷酸化,引起低血糖症[4]。
本例患者血脂正常,可排除全身性脂肪营养不良症,根据发病年龄及无发育异常,初步考虑 Ins 受体病中的TBIR。考虑Ins 受体病时,应进行Ins 受体抗体及系统性自身免疫病实验室检查,并检测基因突变以明确诊断。本例患者基因突变检查排除A型胰岛素抵抗病及相关DM。TBIR在高胰岛素血症基础上还具有黑棘皮症、高雄激素症及自身免疫异常指标,对明确诊断有参考价值[4,7‐8]。TBIR 诊断标准为(1)极高胰岛素血症伴顽固性低血糖高血糖交替;(2)黑棘皮症伴卵巢源性高雄激素;(3)合并自身免疫病。黑棘皮症及卵巢源性高雄激素血症是由胰岛素作用缺陷导致代偿性Ins 水平升高并选择性作用于皮肤和卵巢所致,常提示严重IR,即Ins>1. 5~2. 0 U/kg。循环血液中检测出TBIR受体抗体是“金标准”,目前临床无标准化检测试剂盒,需根据患者症状及检查加以鉴别。
TBIR经1年或数年自发缓解或在应用免疫抑制剂后缓解。Ins 及其增敏剂疗效优于SGLT2 抑制剂和α糖苷酶抑制剂[4,6,9],后者作用机制不通过胰岛素受体路径,可能对基因缺陷导致的IR效果更明显。使用Ins及降糖药物时应避免低血糖,主要因Ins 受体自身抗体表现为Ins 样作用,引起空腹或自发低血糖,低血糖是导致TBIR患者死亡的主要原因[10]。糖皮质激素、免疫抑制剂治疗TBIR合并自身免疫性疾病效果明显,可缓解甚至治愈[11‐15]。IGF‐1及传统中医药对难以控制的高血糖有效,但疗程及临床缓解时间因人而异[16‐17]。本例患者红细胞沉降率及免疫指标异常,并无免疫风
湿系统疾病的临床表现及症状,暂未考虑予糖皮质激素及免疫抑制剂治疗。患者入院后发现营养不佳,消瘦、中度缺铁性贫血、低蛋白血症伴轻度水肿,考虑使用增敏剂类药物可能加重水肿、贫血[18]。
TBIR容易漏诊,通过总结诊治过程可提高临床特殊类型DM鉴别诊断。综上所述,临床治疗自身免疫性疾病无特效药,长期使用糖皮质激素及免疫抑制剂可引起严重不良反应。
参考文献略。
来源:俞亭嫣,郭凯,张雪莲,等.B型胰岛素抵抗综合征一例报道[J].中国糖尿病杂志,2024,32(09):703-705.
