
前列腺癌脑膜转移2例
作者:贾文学,王吉,朱岳峰,刘彦廷,田春雷,宜昌市中心人民医院神经外科;艾文兵,宜昌市夷陵医院神经外科
前列腺癌 是全球第二常见的男性恶性肿瘤,2020年新增病例接近140万例,其中约37.5万人死亡。近年来,随着我国人口老龄化的加剧,我国前列腺癌的发病率越来越高。前列腺癌较易发生远处转移,其中骨转移最为常见,脑转移十分罕见。然而,前列腺癌脑转移一旦发生,则病情进入难治阶段。本文报道2例前列腺癌单发脑转移。
是全球第二常见的男性恶性肿瘤,2020年新增病例接近140万例,其中约37.5万人死亡。近年来,随着我国人口老龄化的加剧,我国前列腺癌的发病率越来越高。前列腺癌较易发生远处转移,其中骨转移最为常见,脑转移十分罕见。然而,前列腺癌脑转移一旦发生,则病情进入难治阶段。本文报道2例前列腺癌单发脑转移。
1. 病例资料
病例1:男,64岁,因头痛 头晕入院。入院后颅脑MRI检查
头晕入院。入院后颅脑MRI检查 示左侧额颞顶部硬膜下不规则分叶状异常信号,呈匍匐生长,范围较广,大小约6.8 cm×4.5 cm,增强后强化明显(图1)。病人无泌尿生殖系症状。肺部CT检查示多发胸椎及胸骨骨质破坏。完善术前准备后,行脑膜病损切除术,术中见肿瘤色灰白,质韧,血供一般,不规则分叶状,少量圆形独立病灶(直径5 mm),边界清楚,与正常脑组织轻度黏连,镜下全切除肿瘤,大小约7 cm×5 cm×3 cm。
示左侧额颞顶部硬膜下不规则分叶状异常信号,呈匍匐生长,范围较广,大小约6.8 cm×4.5 cm,增强后强化明显(图1)。病人无泌尿生殖系症状。肺部CT检查示多发胸椎及胸骨骨质破坏。完善术前准备后,行脑膜病损切除术,术中见肿瘤色灰白,质韧,血供一般,不规则分叶状,少量圆形独立病灶(直径5 mm),边界清楚,与正常脑组织轻度黏连,镜下全切除肿瘤,大小约7 cm×5 cm×3 cm。
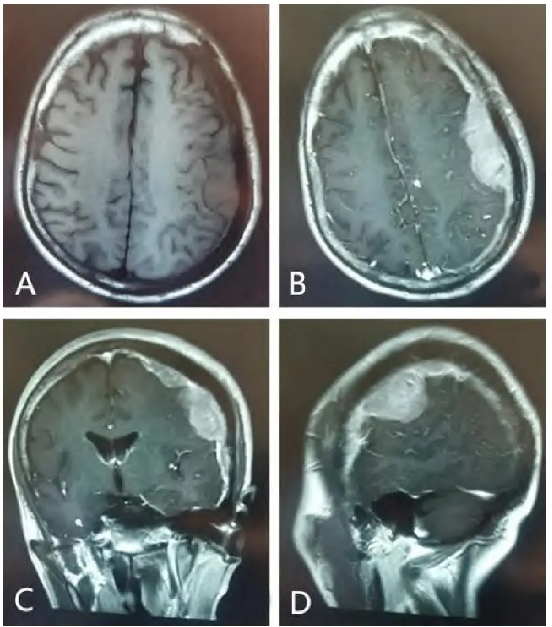
图1 左侧额颞顶部硬膜前列腺来源的转移性病变术前MRI表现。A.颅脑MRI平扫轴位显示左侧额颞顶部近脑膜下不规则分叶状异常信号,呈匍匐生长,范围较广,大小约6.8 cm×4.5 cm,伴邻近脑组织水肿 ;B~D.颅脑增强MRI轴位、冠状位、矢状位,显示左侧额颞顶部病灶不均匀强化,考虑脑膜转移瘤
;B~D.颅脑增强MRI轴位、冠状位、矢状位,显示左侧额颞顶部病灶不均匀强化,考虑脑膜转移瘤
术后病理诊断为(脑肿瘤)转移性中至低分化腺癌,结合免疫组化结果,考虑前列腺来源。免疫组化结果:CK7(-),CK20(-),Napsin A(-),TTF-1(-),Ki-67(LI约40%),CDX-2(部分+),SATB-2(-),NKX3.1(+),P504s(+),PSA(+),Villin(-)。术后追查:血清前列腺特异性抗原 (prostate-specific antigen,PSA)>100 ng/ml;前列腺超声示前列腺增大,内部回声不均匀,未见明显占位。术后1个月在肿瘤科行前列腺癌骨转移适形放疗(PTV/30GY/10F)、内分泌治疗(比卡鲁胺
(prostate-specific antigen,PSA)>100 ng/ml;前列腺超声示前列腺增大,内部回声不均匀,未见明显占位。术后1个月在肿瘤科行前列腺癌骨转移适形放疗(PTV/30GY/10F)、内分泌治疗(比卡鲁胺 及亮丙瑞林
及亮丙瑞林 ),病情好转出院。术后5个月随访,病人一般情况可,头痛头晕等改善,无明显功能障碍,可完成一般体力活动;未行影像学复查。
),病情好转出院。术后5个月随访,病人一般情况可,头痛头晕等改善,无明显功能障碍,可完成一般体力活动;未行影像学复查。
病例2:男,70岁,因头痛头晕入院。既往9年前行前列腺穿刺活检病理诊断为前列腺癌,后行前列腺局部放疗(DT54Gy/27F),后一直行内分泌治疗(戈舍瑞林 及比卡鲁胺)。2020年6月24日行骨肿瘤
及比卡鲁胺)。2020年6月24日行骨肿瘤 全身显像
全身显像 ECT检查
ECT检查 示额骨及左侧髋臼后缘骨代谢活跃。入院后颅脑MRI检查示双侧额部近颅骨内板下占位,分叶状,不均匀强化,邻近脑组织水肿(图2)。
示额骨及左侧髋臼后缘骨代谢活跃。入院后颅脑MRI检查示双侧额部近颅骨内板下占位,分叶状,不均匀强化,邻近脑组织水肿(图2)。
血清PSA>100 ng/ml。盆腔增强CT检查示前列腺癌治疗后改变,左侧坐骨、髂骨、股骨颈转移。入院后,行脑膜病损切除术,术中可见瘤色灰白,质韧,血供一般,分叶状,边界清楚,肿瘤侵犯上矢状窦,镜下全切肿瘤连同受累窦壁,大小约6 cm×4 cm×3 cm。术后病理诊断为转移性前列腺腺泡细胞。免疫组化结果:GFAP(-),Oligo-2(-),P504s(+),PSA(局灶+),Ki-67(热点区域约15%),PCK(+),AR(+),NKX3.1(+)。术后6个月随访,病人一般情况可,头痛头晕等改善,无明显功能障碍,生活能自理;未行影像学复查。

图2 双侧额部硬膜前列腺来源的转移性病变术前MRI表现。A.颅脑MRI平扫轴位显示左侧额部近颅骨内板下占位伴邻近脑组织水肿;B~D.颅脑增强MRI轴位、冠状位、矢状位,显示双侧额部近颅骨内板下病灶不均匀强化,考虑额部脑膜及邻近颅板转移瘤
2. 讨论
前列腺癌脑转移多发生在疾病晚期,恶性程度高,预后极差。前列腺癌中枢神经系统的扩散包括脑实质、硬脑膜和软脑膜转移。本文2例均为前列腺癌脑膜转移。前列腺癌脑转移的临床表现因疾病进展和个体差异等因素而异,但60%~75%的病人可出现神经症状,其中10%~20%的病人可出现癫痫 ,其他症状包括神经功能障碍、精神状态改变、头痛、共济失调
,其他症状包括神经功能障碍、精神状态改变、头痛、共济失调 、言语和视力
、言语和视力 改变等。
改变等。
本文2例主要临床表现为头痛、头晕。目前,前列腺癌脑转移的诊断主要依靠MRI、CT和PET/CT。本文病例1术前MRI检查示左侧额颞顶部脑膜转移瘤,术后病理检查 明确为前列腺来源的恶性肿瘤;病例2有前列腺癌病史9年,MRI检查示双侧额部脑膜及邻近颅板占位,术后病理证实为前列腺来源的恶性肿瘤。
明确为前列腺来源的恶性肿瘤;病例2有前列腺癌病史9年,MRI检查示双侧额部脑膜及邻近颅板占位,术后病理证实为前列腺来源的恶性肿瘤。
前列腺癌硬脑膜转移与脑膜瘤 在影像表现上类似,难以鉴别。本文两例病人MRI表现为T1加权像呈低信号,增强后肿瘤呈现边缘较清晰的不均匀强化。脑膜瘤T1加权像多为低信号或等信号,增强后多呈边缘较清晰的均匀强化,并可见脑膜尾征。然而,恶性脑膜瘤MRI T1加权像以等、低混杂信号多见;可见囊变及出血信号;增强扫描后肿瘤强化不均匀;边缘不规则或呈锯齿状,硬膜尾征呈粗短不规则形;肿瘤侵犯半球呈磨伞征;部分病例向颅内外浸润。本文两例前列腺来源的恶性肿瘤均位于硬脑膜,不易与脑膜瘤相鉴别,特别是恶性脑膜瘤。目前,68Ga标记的前列腺特异性膜抗原(68Ga-PSMA)PET/CT是监测前列腺癌转移最广泛的手段,具有较高的精确性、特异性和扩大观察视野的优势。
在影像表现上类似,难以鉴别。本文两例病人MRI表现为T1加权像呈低信号,增强后肿瘤呈现边缘较清晰的不均匀强化。脑膜瘤T1加权像多为低信号或等信号,增强后多呈边缘较清晰的均匀强化,并可见脑膜尾征。然而,恶性脑膜瘤MRI T1加权像以等、低混杂信号多见;可见囊变及出血信号;增强扫描后肿瘤强化不均匀;边缘不规则或呈锯齿状,硬膜尾征呈粗短不规则形;肿瘤侵犯半球呈磨伞征;部分病例向颅内外浸润。本文两例前列腺来源的恶性肿瘤均位于硬脑膜,不易与脑膜瘤相鉴别,特别是恶性脑膜瘤。目前,68Ga标记的前列腺特异性膜抗原(68Ga-PSMA)PET/CT是监测前列腺癌转移最广泛的手段,具有较高的精确性、特异性和扩大观察视野的优势。
前列腺癌脑转移的治疗包括手术、分次局部和全脑放射(WBRT)治疗、放射外科、药物系统治疗、姑息治疗或其组合。目前,对于肿瘤体积较大(>2 cm)和有症状的单发脑转移瘤 ,手术切除为首选方法。本文两病例均采用手术治疗。对于全身状况良好、颅外疾病控制较好的单发脑转移瘤,手术切除联合WBRT为一线治疗方案,可延长病人的中位生存期。然而,WBRT具有神经毒性,临床上越来越多地应用高剂量辐射立体定向放射外科治疗。
,手术切除为首选方法。本文两病例均采用手术治疗。对于全身状况良好、颅外疾病控制较好的单发脑转移瘤,手术切除联合WBRT为一线治疗方案,可延长病人的中位生存期。然而,WBRT具有神经毒性,临床上越来越多地应用高剂量辐射立体定向放射外科治疗。
由于药物的中枢神经系统渗透率低及其副作用,全身系统疗法目前在前列腺癌脑转移的治疗中无明确作用。尽管前列腺癌脑转移可通过手术和放射治疗 实现更长期的局部疾病控制,但病人的中位生存期仍然较低,尤其在前列腺癌单发脑转移病人。
实现更长期的局部疾病控制,但病人的中位生存期仍然较低,尤其在前列腺癌单发脑转移病人。
总之,在临床工作中,老年男性脑膜病变鉴别诊断时,应考虑到前列腺来源的可能。对于前列腺癌脑膜转移,如果病人全身状况良好、颅外疾病控制较好,可采用手术切除肿瘤联合术后放化疗,有助于延长病人的生存期。但是,到目前为止,还没有关于特征预测前列腺癌脑转移风险的前瞻性证据的报道。前列腺癌脑转移的病理机制、前列腺癌新治疗方法对脑转移发病率的影响,以及适合于前列腺癌脑转移的系统治疗方案,也是我们今后需要探索的新领域。
来源:贾文学,王吉,朱岳峰,等.前列腺癌脑膜转移2例[J].中国临床神经外科杂志,2024,29(04):248-250.
