
透明带自发溶解胚胎复苏移植活产1例报道及文献复习
作者:杨金姬,付浩,胡春秀等,武警特色医学中心军人生殖医学科
一、病例资料
患者,女,30岁,主诉再婚后男方性功能障碍,未避孕未孕2年。月经规律,12岁月经初潮,5~6/30d,经量少,痛经(-);G1P0,2017年孕早期人工流产1次(与前夫);2022年6月10日在外院行宫腔镜 检查发现宫腔轻度粘连,行粘连分解术;子宫内膜病理提示慢性子宫内膜炎,给予多西环素
检查发现宫腔轻度粘连,行粘连分解术;子宫内膜病理提示慢性子宫内膜炎,给予多西环素 0.1g,2次/d×14d治疗。2022年6月就诊于我科,B超检查提示双侧基础窦卵泡计数(AFC)14个,抗苗勒管激素(AMH)水平4.28ng/ml。男方精液常规检查:精子浓度94.05×106/ml,总活动率51.75%,前向运动精子18.86%,正常形态精子比例为4%。夫妻双方染色体
0.1g,2次/d×14d治疗。2022年6月就诊于我科,B超检查提示双侧基础窦卵泡计数(AFC)14个,抗苗勒管激素(AMH)水平4.28ng/ml。男方精液常规检查:精子浓度94.05×106/ml,总活动率51.75%,前向运动精子18.86%,正常形态精子比例为4%。夫妻双方染色体 报告未见异常。诊断:继发性不孕症;宫腔粘连分解术后;慢性子宫内膜炎治疗后;男方中度弱精子症;男方性功能障碍。
报告未见异常。诊断:继发性不孕症;宫腔粘连分解术后;慢性子宫内膜炎治疗后;男方中度弱精子症;男方性功能障碍。
综合考虑患者情况,在与患者及家属充分沟通并知情同意后采用拮抗剂方案促排卵,给予重组人促卵泡激素(果纳芬 ,默克雪兰诺,瑞士)150U启动,Gn使用时间为12d。HCG注射日E2水平为10 980pmol/L,LH水平为0.66U/L,孕酮
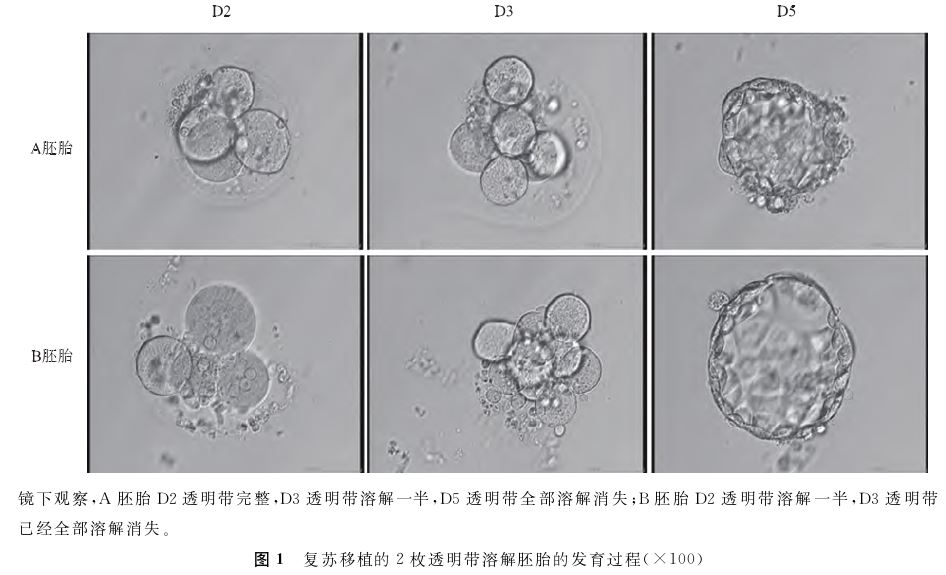
,默克雪兰诺,瑞士)150U启动,Gn使用时间为12d。HCG注射日E2水平为10 980pmol/L,LH水平为0.66U/L,孕酮 (P)水平为2.47nmol/L。2022年9月7日取卵,共获卵15枚。卵冠丘复合物用卵母细胞及胚胎处理液G-MOPST M PLUS(Vitrolife,瑞典)收集,清洗后转入受精培养液G-IVFTMPLUS(Vitrolife,瑞典)中,置于37℃、6%CO2培养箱中培养。HCG注射后39h进行常规受精,加精密度约为2×105/ml。加精后第1天(D1)早上剥除颗粒细胞后,将受精卵转入卵裂培养液G-1TMPLUS(Vitrolife,瑞典)中。每个培养滴(约30μl)放置1枚受精卵。倒置显微镜下观察原核形成情况,其中2PN卵7枚,1PN卵3枚,3PN卵2枚,0PN 2PB卵2枚,MⅠ卵1枚。所有受精卵透明带完整无缺,部分受精卵的卵周间隙大,卵周间隙里有颗粒物质。D2观察共有13枚受精卵卵裂,发现其中1枚卵裂胚的透明带溶解了一半。D3观察发现又有4枚卵裂胚透明带发生溶解,其余8枚胚胎透明带正常(胚胎级别尚未达到移植标准)。考虑到对无透明带卵裂胚进行移植或冷冻操作极易发生解体,经患者充分知情同意后,将所有胚胎进行囊胚培养。为了维持胚胎卵裂球的完整性,采用原位换液法进行囊胚液的更换。用拉细的巴氏吸管将原滴90%的G-1TMPLUS液吸走,再换上预平衡的囊胚培养液G-2TM PLUS(Vitrolife,瑞典),换液操作十分轻柔避免触碰和吹起卵裂球。D5共形成6枚可利用囊胚,其中3枚透明带完整的囊胚,在体外培养过程中透明带均表现为正常;另3枚无透明带囊胚,来自于透明带溶解的胚胎。挑选两枚透明带正常的4BC囊胚进行新鲜移植,其余囊胚行玻璃化冷冻保存。新鲜囊胚移植后未孕。冻融胚胎移植:2022年11月行促排周期准备子宫内膜,移植日内膜厚度为9.7mm,C型内膜。因另1枚冻存的透明带完整囊胚评分较低,故未优先选择移植。复苏移植2枚无透明带的4BC囊胚(图1),获得临床妊娠,为双胎宫内妊娠。患者于2023年7月4日孕36+4周剖宫产分娩双胎女婴,体重分别为2 500g、2 650g,外观无畸形。产后8个月随访婴儿发育情况未见明显异常。
(P)水平为2.47nmol/L。2022年9月7日取卵,共获卵15枚。卵冠丘复合物用卵母细胞及胚胎处理液G-MOPST M PLUS(Vitrolife,瑞典)收集,清洗后转入受精培养液G-IVFTMPLUS(Vitrolife,瑞典)中,置于37℃、6%CO2培养箱中培养。HCG注射后39h进行常规受精,加精密度约为2×105/ml。加精后第1天(D1)早上剥除颗粒细胞后,将受精卵转入卵裂培养液G-1TMPLUS(Vitrolife,瑞典)中。每个培养滴(约30μl)放置1枚受精卵。倒置显微镜下观察原核形成情况,其中2PN卵7枚,1PN卵3枚,3PN卵2枚,0PN 2PB卵2枚,MⅠ卵1枚。所有受精卵透明带完整无缺,部分受精卵的卵周间隙大,卵周间隙里有颗粒物质。D2观察共有13枚受精卵卵裂,发现其中1枚卵裂胚的透明带溶解了一半。D3观察发现又有4枚卵裂胚透明带发生溶解,其余8枚胚胎透明带正常(胚胎级别尚未达到移植标准)。考虑到对无透明带卵裂胚进行移植或冷冻操作极易发生解体,经患者充分知情同意后,将所有胚胎进行囊胚培养。为了维持胚胎卵裂球的完整性,采用原位换液法进行囊胚液的更换。用拉细的巴氏吸管将原滴90%的G-1TMPLUS液吸走,再换上预平衡的囊胚培养液G-2TM PLUS(Vitrolife,瑞典),换液操作十分轻柔避免触碰和吹起卵裂球。D5共形成6枚可利用囊胚,其中3枚透明带完整的囊胚,在体外培养过程中透明带均表现为正常;另3枚无透明带囊胚,来自于透明带溶解的胚胎。挑选两枚透明带正常的4BC囊胚进行新鲜移植,其余囊胚行玻璃化冷冻保存。新鲜囊胚移植后未孕。冻融胚胎移植:2022年11月行促排周期准备子宫内膜,移植日内膜厚度为9.7mm,C型内膜。因另1枚冻存的透明带完整囊胚评分较低,故未优先选择移植。复苏移植2枚无透明带的4BC囊胚(图1),获得临床妊娠,为双胎宫内妊娠。患者于2023年7月4日孕36+4周剖宫产分娩双胎女婴,体重分别为2 500g、2 650g,外观无畸形。产后8个月随访婴儿发育情况未见明显异常。
二、讨论
卵母细胞透明带是在卵泡发育过程中合成,包裹在哺乳动物卵母细胞和植入前胚胎外的多层糖蛋白结构,厚度大约为15~20μm[1]。透明带的功能与卵母细胞形成、受精和早期胚胎发育过程中发生的重要事件息息相关。在卵泡发育过程中透明带可以为卵母细胞提供结构支持,促进卵母细胞和卵泡生长发育。受精过程中透明带可以诱导顶体反应和防止多精受精[2-3]。在卵裂期胚胎发育过程中,透明带的包裹可增强卵裂球之间的接触,促进胚胎致密化过程。在输卵管运输过程中,透明带可以保护胚胎免受机械应力,防止过早着床,并可能影响胚胎卵裂的轴线。因此,结构完整和功能正常的透明带在女性生殖过程中发挥着十分重要的作用,当卵母细胞或胚胎的透明带缺失时可影响女性正常受孕。2020年Li[4]首次报道了将透明带自发性溶解胚胎
培养至囊胚期,移植并获得成功妊娠。刘霜等[5]在2022年报道了移植1枚受精后第2日透明带部分消失的胚胎后活产的病例。经检索国内外文献,本研究为目前第3例相关病例报道,且患者成功获得活产,本报道为透明带自发性溶解胚胎的处理提供了更多的参考。本例患者为继发性不孕,取卵日所获卵冠丘复合物形态正常,精子质量良好,行常规过夜受精。受精后D1剥除颗粒细胞进行原核检查时,观察到所有受精卵的透明带均清晰完整、无明显异常,提示经过取卵、授精、去除颗粒等操作后,本例患者卵母细胞的透明带依然结构完整,并可以发挥其正常的功能。本例患者透明带溶解的异常现象是在受精后卵裂胚培养过程中开始发生的,并且随着培养时间的延长,部分胚胎透明带甚至全部消失不见。胚胎培养过程除将培养皿从培养箱取出在镜下进行观察外,并无多余的人为操作,由此可以排除操作因素所致卵裂期胚胎透明带缺失。此外,取卵当日共有3名患者,其用于胚胎培养的试剂耗材批号以及培养箱均相同,其中两名患者的胚胎发育从始至终均正常,只有本例患者卵裂胚发生透明带溶解的现象。延长培养至D6所有培养滴均未见污染迹象。提示这种异常现象与体外培养条件无关。卵裂胚透明带的溶解很可能是胚胎自发的一种异常行为,但该异常现象发生的确切原因尚不明确。
在生理条件下,透明带会包裹在胚胎之外至囊胚阶段。只有在囊腔压力、胚胎自身或宫腔内各种溶解酶 以及宫腔pH值的共同作用下,透明带才会扩张、变薄,最后破裂,胚胎从透明带中孵出。参与囊胚透明带溶解的蛋白酶很多,其中丝氨酸
以及宫腔pH值的共同作用下,透明带才会扩张、变薄,最后破裂,胚胎从透明带中孵出。参与囊胚透明带溶解的蛋白酶很多,其中丝氨酸 蛋白酶和半胱氨酸蛋白酶是发挥主要作用的两种酶。小鼠模型研究发现丝氨酸蛋白酶具有类似胰蛋白酶的活性,定位在囊胚孵出的位置,是参与小鼠透明带溶解和囊胚孵化的关键酶。金黄地鼠的囊胚能表达半胱氨酸酶,如组织蛋白酶L和组织蛋白酶P,二者出现在滋养外胚层突起上,可先使透明带局部溶解,最后会引起整个透明带的溶解消失[6]。
蛋白酶和半胱氨酸蛋白酶是发挥主要作用的两种酶。小鼠模型研究发现丝氨酸蛋白酶具有类似胰蛋白酶的活性,定位在囊胚孵出的位置,是参与小鼠透明带溶解和囊胚孵化的关键酶。金黄地鼠的囊胚能表达半胱氨酸酶,如组织蛋白酶L和组织蛋白酶P,二者出现在滋养外胚层突起上,可先使透明带局部溶解,最后会引起整个透明带的溶解消失[6]。
如果参与透明带溶解的蛋白酶分泌异常,可能会导致在卵裂胚阶段透明带提前溶解。基因突变同样可以导致透明带异常。透明带基因是卵母细胞特异性表达的基因,不同的透明带基因编码不同类型的透明带糖蛋白。人卵母细胞透明带由4种糖蛋白构成,分别命名为ZP1、ZP2、ZP3及ZP4。有研究证实ZP1、ZP2或ZP3的点突变、错义突变或移码突变导致的基因序列变异,可造成人类卵母细胞或透明带的异常或缺失[7-8],在临床上通常表现为原发性不孕,即使改变促排方案仍会出现。考虑到本例患者为继发不孕,部分胚胎透明带正常,故未对本例患者及胚胎进行遗传学分析及相关蛋白酶检测,因此无法确认这种推测。
通过仔细观察本病例胚胎发育过程,发现透明带自发溶解的卵裂胚具有一个共同特征,即卵周间隙大且间隙内有颗粒。这种特征与Li[4]报道的病例一致,Li通过延时成像系统观察胚胎透明带的形态学变化,推断卵周间隙颗粒可能与透明带的溶解有关。Ferri等[9]也发现卵周间隙大且有颗粒的卵母细胞,在受精12h后透明带由于颗粒的扩张而发生破裂。卵周间隙内的颗粒可能源于卵胞质、放射冠细胞或卵丘细胞的突出[10]。卵周间隙异常与颗粒的存在对胚胎发育及临床结局的影响目前仍存在争议[11-12]。卵裂期胚胎透明带自发溶解是否与其有关,尚无法确定。
在早期胚胎发育过程中,透明带的重要功能之一是维持卵裂球之间的结构,增强卵裂球之间的接触[13]。失去透明带的包裹,卵裂球之间的接触会变微弱,对无透明带的卵裂期胚胎进行操作极易造成卵裂球解体,因此建议先行囊胚培养,再进行囊胚移植或玻璃化冷冻等操作[14]。无透明带胚胎卵裂球在平底培养皿易呈分散排布,不利于胚胎的致密化过程。相对于传统的平底培养皿,WOW培养皿与一步式培养液应用于无透明带胚胎培养可获得较好效果[15]。该皿除了能有效防止无透明带胚胎的聚集和卵裂球的解体外,极少量的溶液将胚胎紧密地包围在一起,从而建立了一个合适的、相对稳定的微环境[16]。目前WOW培养皿已经广泛应用于时差培养系统。
由于本实验室没有WOW培养皿以及时差培养系统,且本病例胚胎是在培养过程中发生的透明带溶解,考虑到若采取常规更换培养皿的方法来更换囊胚培养液,可能会造成无透明带胚胎卵裂球的解离,因此本中心选择了原位换液法,即用拉细的巴氏吸管轻轻去除原滴约90%的卵裂培养液,然后再缓慢加入预平衡的囊胚培养液,整个操作过程十分轻柔,防止触碰或吹起卵裂球。结果证实通过对换液方法的优化,可以有效减少对胚胎的干扰,最终本例患者有多枚无透明带胚胎成功形成囊胚,并经解冻移植后成功分娩。
综上所述,目前关于体外培养卵裂期胚胎透明带自发溶解的确切原因尚不明确,必要时可通过遗传分析查找原因。临床实践中建议对缺乏透明带的胚胎进行单独培养,通过原位换液法更换囊胚液,可以有效减少对胚胎的干扰,促进无透明带胚胎的致密化及囊胚形成。本病例的诊疗经过表明在无其它优质胚胎选择的情况下,无透明带的囊胚移植也可获得满意的临床结局。
参考文献略。
来源:生殖医学杂志2024年11月第33卷第11期
