
阿尔茨海默病并发急性缺血性肠病1例
作者:李小庆,孙文静,肖娟等,重庆市第十三人民医院消化内分泌科
缺血性肠病是由于肠道缺血缺氧,导致肠黏膜炎症、坏死、梗阻、穿孔等,从而引起腹痛、腹泻 、便血等一系列临床表现的一组异质性疾病[1] 。据报道,我国90%以上的缺血性肠病患者发病年龄大于60岁[2] 。阿尔茨海默病
、便血等一系列临床表现的一组异质性疾病[1] 。据报道,我国90%以上的缺血性肠病患者发病年龄大于60岁[2] 。阿尔茨海默病 (AD)是一种进行性神经系统疾病,其是由于大脑神经元退化和凋亡引起的认知和记忆功能的丧失。在老年人群中,AD发病率及死亡率逐年上升[3] 。AD会导致认知功能障碍,往往会提高其它器质性疾病的诊疗难度。目前,缺血性肠病与AD相关性的研究报道较少见,但二者从“脑-肠轴”、肠道菌群、疾病发生的危险因素等方面均有一定关联。本文回顾了1例老年AD并发急性缺血性肠病的诊治过程,并从中总结了临床诊治经验。
(AD)是一种进行性神经系统疾病,其是由于大脑神经元退化和凋亡引起的认知和记忆功能的丧失。在老年人群中,AD发病率及死亡率逐年上升[3] 。AD会导致认知功能障碍,往往会提高其它器质性疾病的诊疗难度。目前,缺血性肠病与AD相关性的研究报道较少见,但二者从“脑-肠轴”、肠道菌群、疾病发生的危险因素等方面均有一定关联。本文回顾了1例老年AD并发急性缺血性肠病的诊治过程,并从中总结了临床诊治经验。
1临床资料
患者,男,92岁,因“大便习惯改变3 d,便血1 d”于2023年10月6日经本院急诊收入消化内分泌科。现病史:入院3 d前,患者受凉后出现大便习惯改变,为不成形稀便,约每天2次,色正常,气味不详,量少,伴恶心、纳差、咳嗽 、咳痰、喘累气促,未引起重视及进一步检查。自服“三九感冒灵颗粒
、咳痰、喘累气促,未引起重视及进一步检查。自服“三九感冒灵颗粒 、藿香正气液”等药物后无明显好转。入院1 d前,患者发现肛周有鲜红色血液3次,伴腹痛。为求进一步诊疗由急诊120送入本院。既往史:AD史数年,长期卧床,生活不能自理。既往有高血压病史,否认糖尿病病史。入院查体:体温36.6 ℃,脉搏
、藿香正气液”等药物后无明显好转。入院1 d前,患者发现肛周有鲜红色血液3次,伴腹痛。为求进一步诊疗由急诊120送入本院。既往史:AD史数年,长期卧床,生活不能自理。既往有高血压病史,否认糖尿病病史。入院查体:体温36.6 ℃,脉搏 92次/分,呼吸20次/分,血压179/80 mm Hg,口唇稍发绀
92次/分,呼吸20次/分,血压179/80 mm Hg,口唇稍发绀 ,听双肺呼吸音粗,双下肺闻及少许湿啰音,心率92次/分,心律齐,心音正常,无病理性杂音及心包摩擦音,腹部膨隆,肠鸣音
,听双肺呼吸音粗,双下肺闻及少许湿啰音,心率92次/分,心律齐,心音正常,无病理性杂音及心包摩擦音,腹部膨隆,肠鸣音 4次/分,全腹无明显压痛、反跳痛及肌紧张。神经系统检查
4次/分,全腹无明显压痛、反跳痛及肌紧张。神经系统检查 :痴呆状,问答不合理,查体不合作,双侧瞳孔等大等圆,对光反射存在,四肢肌力检查不合作,肌张力可,病理反射未引出。常规:白细胞计数9.17×109/L,中性粒细胞百分比91.10%。D-二聚体
:痴呆状,问答不合理,查体不合作,双侧瞳孔等大等圆,对光反射存在,四肢肌力检查不合作,肌张力可,病理反射未引出。常规:白细胞计数9.17×109/L,中性粒细胞百分比91.10%。D-二聚体 测定:2.08 mg/L。电解质:钾3.11 mmol/L。降钙素
测定:2.08 mg/L。电解质:钾3.11 mmol/L。降钙素 6.09 ng/mL,C-反应蛋白
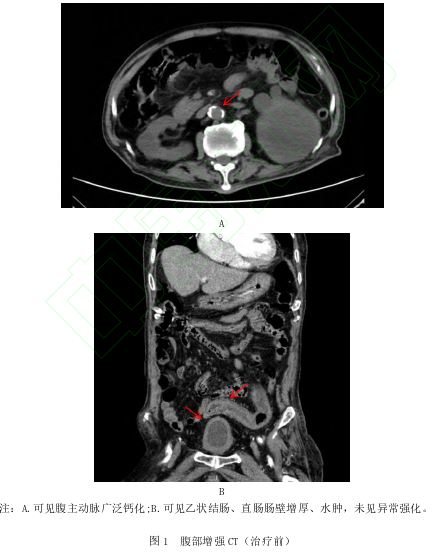
6.09 ng/mL,C-反应蛋白 136.1 mg/L,N末端-前脑钠4 737.16 pg/mL。便隐血试验:阳性。心脏超声:左房增大;主动脉瓣钙化伴中度反流;三尖瓣重度反流,肺动脉压增高;二尖瓣中度反流;肺动脉瓣轻度反流;左心室舒张功能减退。颈部血管超声:双侧颈总动脉内-中膜毛糙增厚伴粥样斑块形成。下肢动静脉超声:双下肢动脉粥样硬化性改变伴粥样硬化斑块形成。腹部增强CT(图1):主动脉及左、右冠状动脉管壁钙化;腹主动脉广泛钙化;乙状结肠、直肠大范围水肿
136.1 mg/L,N末端-前脑钠4 737.16 pg/mL。便隐血试验:阳性。心脏超声:左房增大;主动脉瓣钙化伴中度反流;三尖瓣重度反流,肺动脉压增高;二尖瓣中度反流;肺动脉瓣轻度反流;左心室舒张功能减退。颈部血管超声:双侧颈总动脉内-中膜毛糙增厚伴粥样斑块形成。下肢动静脉超声:双下肢动脉粥样硬化性改变伴粥样硬化斑块形成。腹部增强CT(图1):主动脉及左、右冠状动脉管壁钙化;腹主动脉广泛钙化;乙状结肠、直肠大范围水肿 ,考虑炎症。肠镜
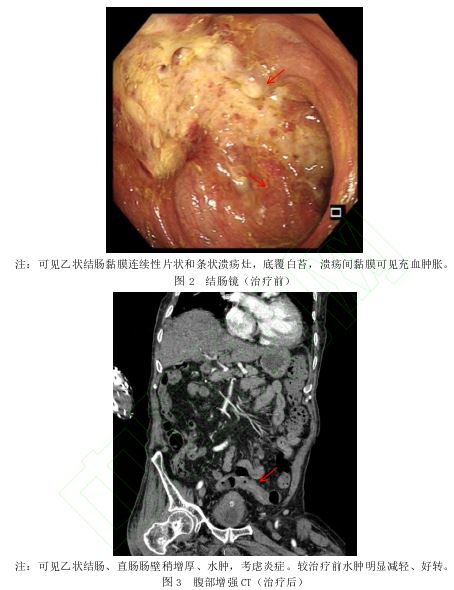
,考虑炎症。肠镜 (图2):距肛门10~25 cm处可见连续性片状和条状溃疡灶,底覆白苔,溃疡间黏膜可见充血肿胀。考虑缺血性肠病?自身抗体谱检测:阴性。大便培养:未见微生物生长。大便轮状病毒
(图2):距肛门10~25 cm处可见连续性片状和条状溃疡灶,底覆白苔,溃疡间黏膜可见充血肿胀。考虑缺血性肠病?自身抗体谱检测:阴性。大便培养:未见微生物生长。大便轮状病毒 及腺病毒检测:阴性。巨细胞病毒IgM抗体:阴性。临床诊断:缺血性结直肠炎(局灶节段性缺血)。入院后予禁食、补液、控制血压(硝苯地平控释片
及腺病毒检测:阴性。巨细胞病毒IgM抗体:阴性。临床诊断:缺血性结直肠炎(局灶节段性缺血)。入院后予禁食、补液、控制血压(硝苯地平控释片 30 mg,每天1次,目标控制血压为140/80 mm Hg)、抗凝(依诺肝素钠
30 mg,每天1次,目标控制血压为140/80 mm Hg)、抗凝(依诺肝素钠 3 000 AXalU,皮下注射每天1次)、缓解肠道炎症(美沙拉秦缓释颗粒
3 000 AXalU,皮下注射每天1次)、缓解肠道炎症(美沙拉秦缓释颗粒 1 g,口服,每天4次),稳定斑块(阿托伐他汀
1 g,口服,每天4次),稳定斑块(阿托伐他汀 钙20 mg,每天1次,睡前口服),并予以抑酸、调节肠道菌群、抗感染、止咳祛痰、营养支持及维持水电解质平衡等对症支持治疗。患者存在明显的精神症状,予以奥氮平
钙20 mg,每天1次,睡前口服),并予以抑酸、调节肠道菌群、抗感染、止咳祛痰、营养支持及维持水电解质平衡等对症支持治疗。患者存在明显的精神症状,予以奥氮平 (口服2.5~5 mg,每晚1次)改善激惹吵闹等症状。治疗后腹部增强CT见图3。
(口服2.5~5 mg,每晚1次)改善激惹吵闹等症状。治疗后腹部增强CT见图3。
2讨论
缺血性肠病主要包括急性肠系膜缺血、慢性肠系膜缺血及缺血性结肠炎[4] 。
缺血性肠病的病理生理过程十分复杂,包括全身循环状态、肠道血管结构和功能受损程度、受损血管数量、血管床对血流灌注减少的反应、侧支循环代偿能力、缺血损伤持续时间及受累肠段的代谢需要等[5] 。缺血性肠病的常见危险因素为老年人群肠系膜血管粥样硬化[1] ,其他常见危险因素包括糖尿病、高血压病、冠状动脉疾病、心房颤动 、休克等。药物因素、免疫因素、生理因素等也可导致缺血性肠病的发生[6-7] 。
、休克等。药物因素、免疫因素、生理因素等也可导致缺血性肠病的发生[6-7] 。
急性肠系膜缺血是缺血性肠病分型中严重程度最高的类型,其是由于流向肠道的血流量突然减少。缺血性损伤的主要机制是缺氧和细胞酸中毒。如果缺血损伤后再灌注不及时,细胞受损将不可逆,且肠壁炎症和出血释放自由基、白细胞介素等会引起进一步的组织损伤,即再灌注损伤[8] 。缺血性结肠炎是缺血性肠病中最常见的类型。大部分缺血性结肠炎因黏膜下或壁内出血引起可逆性缺血性结肠炎,只有少数存在肠壁和功能的不可逆性损伤[9] 。缺血性结肠炎的病变多表现为节段性受累,部位以左半结肠多见。慢性肠系膜缺血的发病率较低,多为单支血管病变,其是由供应肠道的血流量逐渐减少所致。广泛的侧枝循环代偿可使患者多年无明显临床症状。腹痛、腹泻、便血是缺血性肠病的临床三联征,其中不同亚型的临床表现存在差异。急性肠系膜缺血常表现为突发剧烈腹痛,多伴有恶心呕吐和腹泻,腹痛与体征不呈正比。慢性肠系膜缺血常表现为餐后剧烈腹痛、畏食和慢性体重下降,腹痛定位不明确。缺血性结肠炎一般表现为左下腹或下腹部轻中度痉挛痛,24 h内常出现腹泻并伴有便血[10] ,这一特点与结肠的分水岭区域侧支即左腹部血流有限有关,故左半结肠更容易发生缺血风险。在体格检查中,缺血性结肠炎早期多表现为腹部轻中度压痛,病情加重时可有腹部重度压痛、反跳痛、腹肌紧张,肠鸣音逐渐减弱甚至消失等腹膜炎的体征。
对于临床高度怀疑的病例应立即安排适当的检查,CT增强扫描和CT血管成像 可观察肠系膜动脉主干及其二级分支的解剖情况。肠镜检查是缺血性结肠炎主要诊断方法;选择性血管造影
可观察肠系膜动脉主干及其二级分支的解剖情况。肠镜检查是缺血性结肠炎主要诊断方法;选择性血管造影 是急性肠系膜缺血诊断的“金标准”,可在诊断的同时直接进行血管内药物灌注治疗和介入治疗[11] 。有研究报道,血清学标志物(如D-二聚体、乳酸脱氢酶、脂肪酸结合蛋白、二胺氧化酶、瓜氨酸、血管黏附蛋白-1等)有一定的协助诊断价值,但特异性常不高[12-13] 。未来有待更多的前瞻性临床研究证实血清学标志物在缺血性肠病中的诊断价值。缺血性肠病的治疗原则主要是维持血流动力学稳定,尽早恢复组织灌注。缺血性肠病的治疗方法包括内科保守治疗(抗凝、溶栓、扩血管等)、经皮血管内介入治疗(经皮抽吸取栓、动脉内药物溶栓、经皮腔内血管成形术、支架植入术等)、手术治疗(血管重建术、血栓切除术和肠道切除术等)[14-15] 。临床应针对患者的适应证及禁忌证,选择合理的治疗方法。多学科团队的参与对治疗缺血性肠病也至关重要。在预后方面,急性肠系膜缺血的预后最差。ADABA等[16] 研究发现,急性肠系膜缺血患者住院死亡率约为63%。如果可以在肠系膜发生梗死之前进行诊断和治疗,则可以大大降低死亡率。缺血性结肠炎预后相对较好,大多数患者在1~2周内症状逐渐好转,总死亡率接近10%[17] 。慢性肠系膜缺血有发生急性肠系膜动脉栓塞的风险,其可导致发病率和死亡率的增加。
是急性肠系膜缺血诊断的“金标准”,可在诊断的同时直接进行血管内药物灌注治疗和介入治疗[11] 。有研究报道,血清学标志物(如D-二聚体、乳酸脱氢酶、脂肪酸结合蛋白、二胺氧化酶、瓜氨酸、血管黏附蛋白-1等)有一定的协助诊断价值,但特异性常不高[12-13] 。未来有待更多的前瞻性临床研究证实血清学标志物在缺血性肠病中的诊断价值。缺血性肠病的治疗原则主要是维持血流动力学稳定,尽早恢复组织灌注。缺血性肠病的治疗方法包括内科保守治疗(抗凝、溶栓、扩血管等)、经皮血管内介入治疗(经皮抽吸取栓、动脉内药物溶栓、经皮腔内血管成形术、支架植入术等)、手术治疗(血管重建术、血栓切除术和肠道切除术等)[14-15] 。临床应针对患者的适应证及禁忌证,选择合理的治疗方法。多学科团队的参与对治疗缺血性肠病也至关重要。在预后方面,急性肠系膜缺血的预后最差。ADABA等[16] 研究发现,急性肠系膜缺血患者住院死亡率约为63%。如果可以在肠系膜发生梗死之前进行诊断和治疗,则可以大大降低死亡率。缺血性结肠炎预后相对较好,大多数患者在1~2周内症状逐渐好转,总死亡率接近10%[17] 。慢性肠系膜缺血有发生急性肠系膜动脉栓塞的风险,其可导致发病率和死亡率的增加。
本案例患者高龄,有高血压病、动脉钙化的基础疾病,是缺血性肠病的高危人群。而且,患者有腹泻、便血、腹痛症状。因此,对于无法用常规疾病进行解释的腹痛、大便习惯改变,且有缺血性肠病高危因素的患者需警惕该疾病。结合患者影像学资料(因患者有认知功能障碍,间断躁动,无法配合血管介入手术,故未能获得血管介入影像资料),可见乙状结肠、直肠壁增厚、水肿。肠镜下表现为节段性肠道黏膜糜烂和条状溃疡灶,支持缺血性肠病的诊断。该患者合并AD,存在认知功能障碍,对自身症状、病情变化描述能力差,治疗配合度不良,并且合并多器官功能不全,外科手术及介入治疗风险高,本科室选择内科保守治疗后,取得了较好疗效。治疗12 d后,患者未再便血,腹痛、腹泻缓解。复查腹部增强CT(图3):乙状结肠、直肠壁水肿较治疗前明显减好转。患者于10月26日病情好转出院,住院时间为20 d。出院后3个月内电话随访,无复发。
关于AD与缺血性肠病发生的相关性,目前尚无确切的临床数据予以证实。但是,从“脑-肠轴”、肠道菌群、疾病发生的危险因素等方面分析,二者可能存在关联性。从“脑-肠轴”方面看,大脑可通过自主神经系统调节肠道功能,还可通过直接调节微粒体的激素分泌,进而影响肠道微生物的基因表达及肠道微生物群的结构和功能。肠道的缺血性损伤可加重肠道菌群紊乱,并引起肠源性内毒素血症,进而影响大脑认知功能,加速AD的病程进展[18-20] 。从疾病发生机制上看,目前已证实载脂蛋白E4是AD的主要易感基因,胆固醇水平升高、脂质代谢障碍等参与大脑中β-淀粉样蛋白的合成,导致大脑退化和认知功能障碍[21] 。
而高胆固醇血症也是导致腹主动脉粥样硬化、缺血性肠病的重要因素[22-23] 。此外,从发病的高危因素看,年龄、高血压病、糖尿病等均为AD及缺血性肠病的危险因素[3,17] ,二者有较多的相同风险因素。因此,对于缺血性肠病的老年患者,如出现认知障碍,需警惕AD的可能;而对于AD患者,在出现腹痛、腹泻、便血等症状时,也需警惕缺血性肠病的风险,以免延误诊治。
综上所述,对于老年缺血性肠病的治疗,需要全面评估患者病情,建议依据患者情况选择个体化的综合治疗方案。AD与缺血性肠病可能在“脑-肠轴”、肠道菌群、疾病发生的危险因素等方面存在一定的相关性,但需更多的临床研究证实,以便加强临床医生对缺血性肠病及AD的预防及治疗,这对于改善疾病预后至关重要。
参考文献略。
来源:李小庆,孙文静,肖娟.阿尔茨海默病并发急性缺血性肠病1例[J/OL].现代医药卫生.

