
成人弥漫性内生型脑桥胶质瘤伴椎管内播散一例并文献复习
作者:王丹阳,白玉萍,甘铁军,江林臻,张静,兰州大学第二医院;蒋盈盈,甘肃中医药大学
本研究遵守《赫尔辛基宣言》,经兰州大学第二医院伦理委员会审核批准,免除受试者知情同意,批准文号:2023A-782。
患者男,25岁,因“持续性头晕3个月”于2020年8月24日收入兰州大学第二医院神经内科,患者自述3个月前无明显诱因出现持续性头部昏沉感,自觉头重脚轻,走路脚踩棉花感,站立步态不稳,间歇性视物水平重影,每次持续数秒,上述症状于3个月内逐渐加重。专科检查:双眼水平眼震,右视时为著,双侧咽反射消失,左下肢运动觉 减退,双下肢腱反射减退,双侧病理征阳性。
减退,双下肢腱反射减退,双侧病理征阳性。
实验室检查:FOLATE 2.13 ng/m L,Vit B-12 212.00 pg/m L,TORCH抗体均阴性;脑脊液常规及生化:白细胞数 目6.00×10-9/L,脑脊液蛋白0.48 g/L,葡萄糖
目6.00×10-9/L,脑脊液蛋白0.48 g/L,葡萄糖 2.0 mmo1/L,氯117.2 mmol/L;于2020年8月26日入院时行头颅CT轴位平扫示:双侧小脑半球多发钙化灶(图1A);头颅MRI轴位平扫+增强扫描示:脑干及双侧小脑半球异常信号影,T1WI呈等信号(图1B),T2-液体衰减反转恢复(fluid attenuated inversion recovery,FLAIR)序列呈高信号(图1C),弥散加权成像(diffusion weighted imaging,DWI)(b=1000 s/mm2)呈等信号(图1D),增强扫描无明显强化(图1E),病灶边界不清,内部信号均匀,未见出血、坏死,影像学诊断考虑颅内感染。
2.0 mmo1/L,氯117.2 mmol/L;于2020年8月26日入院时行头颅CT轴位平扫示:双侧小脑半球多发钙化灶(图1A);头颅MRI轴位平扫+增强扫描示:脑干及双侧小脑半球异常信号影,T1WI呈等信号(图1B),T2-液体衰减反转恢复(fluid attenuated inversion recovery,FLAIR)序列呈高信号(图1C),弥散加权成像(diffusion weighted imaging,DWI)(b=1000 s/mm2)呈等信号(图1D),增强扫描无明显强化(图1E),病灶边界不清,内部信号均匀,未见出血、坏死,影像学诊断考虑颅内感染。
临床以抗感染、营养神经等治疗一月,症状无改善,于2020年9月26日进一步行全脊椎矢状位MRI平扫+增强扫描示:颈5椎体以下颈胸段椎管内见多发大小不一结节影(图1F),T1WI呈等信号(图1G),T2WI呈稍高信号(图1J),增强扫描呈中度强化(图1K),影像学诊断考虑脑干高级别胶质瘤 伴椎管内脑脊液播散。
伴椎管内脑脊液播散。
患者随后转入神经外科,于2020年9月29日行颈椎椎管内病损切除术,术中见瘤髓边界不清,鱼肉样,质软,血供较丰富,切除部分肿瘤送病理科活检。术后病理结果:肿瘤细胞密度高,核浆比增大,核有异型性,部分区域血管增生明显(图1H、1I);免疫组化染色结果:瘤细胞示H3K27M(-),Olig-2(+),GFAP(-),Vimentin(弱+),S-100(-),NSE(-),CKP(-),CD99(弱+),Ki-67(5%~20%);基因检测结果:IDH1基因和IDH2基因均为野生型,1p/19q基因未缺失,MGMT甲基化检测呈阴性,TERT基因为突变型(C250T)。诊断为胶质母细胞瘤 ,IDH野生型,CNS WHOⅣ级。
,IDH野生型,CNS WHOⅣ级。
一年后,患者因症状加重复查,于2021年7月13日行头颅轴位CT平扫 示双侧侧脑室壁、双侧额叶近中线区可见结节状、片状高密度影(图1L、1M),对比一年前首诊CT平扫(图1N、1O、1P)为新发病灶,影像学诊断考虑颅内多发转移;双侧小脑半球钙化灶较前没有明显改变(1Q)。
示双侧侧脑室壁、双侧额叶近中线区可见结节状、片状高密度影(图1L、1M),对比一年前首诊CT平扫(图1N、1O、1P)为新发病灶,影像学诊断考虑颅内多发转移;双侧小脑半球钙化灶较前没有明显改变(1Q)。
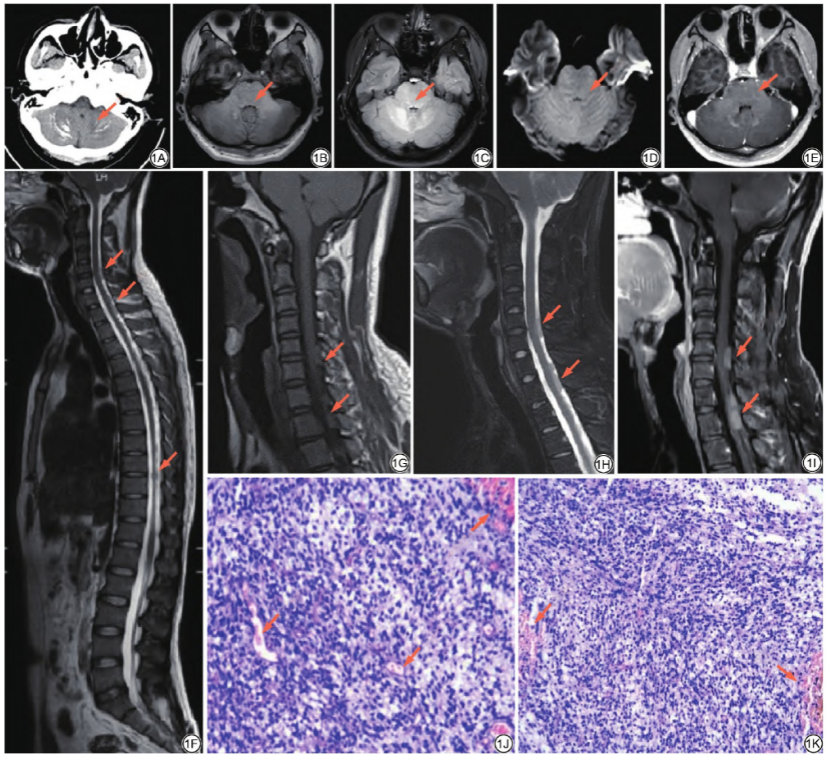
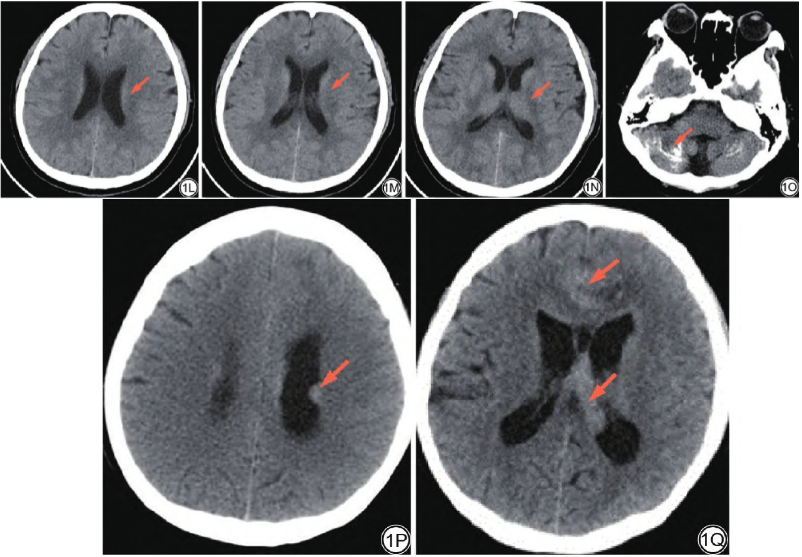
图1 男,25岁,弥漫性内生型脑桥胶质瘤。头颅CT轴位平扫示:双侧小脑半球多发钙化灶(箭)(1A);头颅MRI轴位平扫+增强扫描示:脑干及双侧小脑半球异常信号影(箭),T1WI呈等信号(1B),T2-液体衰减反转恢复(FLAIR)序列呈高信号(箭)(1C),弥散加权成像(DWI)(b=1000 s/mm2)呈等信号(箭)(1D),增强扫描无明显强化(箭)(1E),病灶边界不清,内部信号均匀,未见出血、坏死;全脊椎矢状位MRI平扫+增强扫描示:颈5椎体以下颈胸段椎管内见多发大小不一结节影(箭)(1F),T1WI呈等信号(箭)(1G),T2WI呈稍高信号(箭)(1H),增强扫描呈中度强化(箭)(1I);术后病理(HE×10)示:肿瘤细胞密度高,核浆比增大,核有异型性,部分区域血管增生明显(箭)(1J~1 K);复查头颅CT轴位平扫示:双侧侧脑室壁、双侧额叶近中线区可见结节状、片状高密度影(箭)(1L~1M),对比一年前首诊CT平扫病灶(箭)(1N~1P)为新发病灶;双侧小脑半球钙化灶较前没有明显改变(箭)(1Q)。
讨论
弥漫性内生型脑桥胶质瘤(diffuse intrinsic pontine glioma,DIPG)是一种高度恶性的脑干肿瘤,影像学上脑桥弥漫性病变为其特征,预后极差,成人脑干肿瘤极为罕见,在脑干肿瘤中约80%为DIPG。脑干胶质瘤根据发生部位分为中脑胶质瘤、脑桥胶质瘤、延髓胶质瘤;根据影像学表现分为外生型或内生型胶质瘤、弥漫性或局限性胶质瘤,发生部位及影像学表现与预后相关。
DIPG好发于儿童,约占儿童中枢神经系统肿瘤的20%,而在成人中罕见,仅占成人胶质瘤的不到2%,DIPG的好发年龄具有双峰性,儿童DIPG中位发病年龄为6~7岁,成人DIPG中位发病年龄为30岁左右。DIPG的诊断通常基于临床表现和影像学表现,一般不需要活检。
本例由于H3B K27M(-),在诊断上应与2016版和2021版WHO中枢神经系统肿瘤分类中的弥漫性中线胶质瘤(diffuse midline glioma,DMG)进行鉴别。根据2021年WHO中枢神经系统肿瘤分类,结合该患者的组织病理、免疫组化及基因检测结果,可归类于成人型弥漫性胶质瘤类别中胶质母细胞瘤,IDH野生型,CNS WHOⅣ级,由于其发生于脑桥部位,又可归为成人型DIPG。
DIPG的典型临床表现为颅神经功能障碍、共济失调 和长束征,常可出现复视、感觉减退、肌力减退,当中脑导水管梗阻时,还会出现头痛
和长束征,常可出现复视、感觉减退、肌力减退,当中脑导水管梗阻时,还会出现头痛 、呕吐
、呕吐 等颅高压表现。症状表现可反映脑干病变的程度,患者出现多种神经系统症状,提示脑干病变广泛。成人DIPG患者可在出现神经系统症状(平均约4.5个月)后才得到确诊,由于成人DIPG罕见,临床症状表现与其他神经系统疾病有相似性,容易漏诊。
等颅高压表现。症状表现可反映脑干病变的程度,患者出现多种神经系统症状,提示脑干病变广泛。成人DIPG患者可在出现神经系统症状(平均约4.5个月)后才得到确诊,由于成人DIPG罕见,临床症状表现与其他神经系统疾病有相似性,容易漏诊。
结合MRI特点和临床表现对脑干肿瘤可进行初步的诊断和分类,有学者认为MRI可取代活检对脑干弥漫性胶质瘤进行诊断,研究也报道MRI诊断DIPG的准确度可高达95%~97%。多模态MRI组学预测DIPG的基因突变类型和疾病的进展及生存期具有一定价值。
DIPG的MRI表现具有一定的特征性,形态上表现为以脑桥为中心边界不清的病变,常累及中脑、延髓,伴有脑干明显肿胀,有时可累及小脑或包绕基底动脉,易发生柔脑膜和椎管的播散转移,MRI信号提示病变的侵袭性及进展程度,早期或侵袭性较低的病变主要为血管源性水肿 ,表现为T2WI均匀的高信号,表观弥散系数(apparent diffusion coefficient,ADC)值无降低;进展期肿瘤组织血供不足易出现坏死,表现为T2WI不均匀的高信号,肿瘤实性成分内细胞密度增加,ADC值降低,DWI出现高信号,由于血脑屏障的破坏及新生血管增加,增强扫描病灶出现强化,CBV明显增加。多数DIPG的MRI信号特点为T1WI等信号或稍低信号,T2WI及T2-FLAIR高信号,DWI多表现为等信号,坏死少见,少数病灶可出现强化。
,表现为T2WI均匀的高信号,表观弥散系数(apparent diffusion coefficient,ADC)值无降低;进展期肿瘤组织血供不足易出现坏死,表现为T2WI不均匀的高信号,肿瘤实性成分内细胞密度增加,ADC值降低,DWI出现高信号,由于血脑屏障的破坏及新生血管增加,增强扫描病灶出现强化,CBV明显增加。多数DIPG的MRI信号特点为T1WI等信号或稍低信号,T2WI及T2-FLAIR高信号,DWI多表现为等信号,坏死少见,少数病灶可出现强化。
磁共振波谱(magnetic resonance spectroscopy,MRS)可辅助鉴别DIPG与感染性疾病,胆碱(choline,Cho)的含量与肿瘤的恶性程度相关。通过MRI展示的肿瘤生长于脑桥部位或浸润程度广泛(侵及小脑或三叉神经)提示预后不良,T2WI均匀高信号、无坏死、较高的ADC值、无强化,低CBV提示较好的预后,反之则提示预后不良。
本例患者颅内病灶的部分MRI表现较为典型,T1WI等信号、T2-FLAIR均匀高信号、ADC未减低以及脑内病灶未强化,但出现的小脑钙化很不典型,由于首次检查未进行脊椎的影像学检查,且脑脊液检查炎性指标偏高,因而初次诊断为颅内感染,这是一个深刻的教训。
本例最不典型的表现为小脑钙化灶以及椎管播散病灶,钙化不是DIPG的典型表现,在以往文献中仅有一例儿童DIPG病例报告了经放射治疗 后脑桥病灶内出现钙化灶,由于该患者Vit B-12和叶酸
后脑桥病灶内出现钙化灶,由于该患者Vit B-12和叶酸 较低,考虑可能与小脑多发钙化有关;患者脑脊液检查炎性指标偏高,可能为肿瘤的继发改变;本例增强扫描颅内原发灶未强化而椎管内播散灶中度强化,还未有文献报道过类似现象,且文献对于椎管内播散灶强化特点的描述较少,这是否由于肿瘤在播散时级别发生改变尚需探讨;患者在一年后复查时出现脑内及脑室下多发播散结节,其脑内的转移晚于椎管内播散,这种转移的特点文献也未有过报道,此现象在脑干肿瘤中是否普遍存在还没有明确的研究。
较低,考虑可能与小脑多发钙化有关;患者脑脊液检查炎性指标偏高,可能为肿瘤的继发改变;本例增强扫描颅内原发灶未强化而椎管内播散灶中度强化,还未有文献报道过类似现象,且文献对于椎管内播散灶强化特点的描述较少,这是否由于肿瘤在播散时级别发生改变尚需探讨;患者在一年后复查时出现脑内及脑室下多发播散结节,其脑内的转移晚于椎管内播散,这种转移的特点文献也未有过报道,此现象在脑干肿瘤中是否普遍存在还没有明确的研究。
从组织细胞学特点来说,细胞密度,细胞的异型性、核分裂象的多少、血管的增生程度等都是判断胶质瘤分级的重要指标,DIPG的病理学分级主要为高级别胶质瘤,本例根据组织学特点及基因检测归为WHOⅣ级。DIPG中约80%伴有H3B K27M突变,可能能够作为肿瘤潜在的治疗靶点。目前对于DIPG常采用标准放疗,但只能起到短暂的作用。
MRI可清楚显示DIPG的生长部位及范围,可根据MRI表现评估是否适合手术治疗,当病灶范围小且界限较清楚时,切除可获得较好的收益;若病灶范围大,浸润周围组织广泛时,不建议手术,应采用其他治疗方案。MRI指导的立体定向活检使DIPG活检的安全性及精准性明显提高。MRI指导手术操作也具有极大优势,近年来的新技术“术中MRI实时成像”有助于实现肿瘤的最大范围安全切除。化学治疗受血脑屏障的限制,疗效不明显。
同时,影像学表现对预后预测也具有很高价值。预后也与发病年龄相关,儿童DIPG的中位生存期约11个月,成人型DIPG的中位生存期约为20~30个月,成人患者的预后情况稍好于儿童。在过去的几十年里,新的治疗方式不断产生,但疗效均不显著。目前的研究主要致力于肿瘤细胞的基因组及分子特征的分析,探索一些靶向治疗的方式,但这些基本还处于实验阶段,疗效还未可知。
先前多项研究发现DIPG容易发生柔脑膜和椎管内播散也印证了这一点,该病例给我们带来了启示,具有神经系统症状和脑干弥漫性影像学病变时,可考虑全脊椎MRI检查。所以,综合影像特征及临床表现可实现早期明确诊断及治疗,改善预后。
来源:王丹阳,蒋盈盈,白玉萍,等.成人弥漫性内生型脑桥胶质瘤伴椎管内播散一例并文献复习[J].磁共振成像 ,2024,15(06):129-132.
,2024,15(06):129-132.
