
医挑百例|王丽教授、张世玉医生:一例HER2阳性晚期乳腺癌病例,从早期走向晚期的5年历程,看抗HER2治疗理念的变革与更新
如今,HER2阳性晚期乳腺癌 的治疗,已从单一化疗迈入精准靶向时代。曲妥珠单抗联合帕妥珠单抗
的治疗,已从单一化疗迈入精准靶向时代。曲妥珠单抗联合帕妥珠单抗 的双靶向治疗联合化疗仍是一线标准方案,显著延长中位总生存(OS)至57个月。针对耐药患者,抗体偶联药物(ADC)如恩美曲妥珠单抗
的双靶向治疗联合化疗仍是一线标准方案,显著延长中位总生存(OS)至57个月。针对耐药患者,抗体偶联药物(ADC)如恩美曲妥珠单抗 (T-DM1)、德曲妥珠单抗
(T-DM1)、德曲妥珠单抗 (T-DXd)成为二线优选,T-DXd凭借50%的客观缓解率(ORR)及对脑转移的突破性疗效获美国食品药品监督管理局(FDA)优先审批。小分子酪氨酸激酶抑制剂(TKI)药物(吡咯替尼
(T-DXd)成为二线优选,T-DXd凭借50%的客观缓解率(ORR)及对脑转移的突破性疗效获美国食品药品监督管理局(FDA)优先审批。小分子酪氨酸激酶抑制剂(TKI)药物(吡咯替尼 、Tucatinib)通过阻断HER2信号通路,为多线治疗失败患者提供了新的选择。然而当下临床工作仍面临诸多挑战,如耐药机制复杂(如HER2异质性、下游信号代偿激活)及药物毒性管理。当前研究聚焦于ADC药物序贯优化、靶向联合免疫治疗及基于液体活检的个体化策略,旨在突破生存瓶颈。医脉通特邀邢台市人民医院王丽教授点评、张世玉医生分享一例HER2阳性晚期乳腺癌病例,作为临床实践参考,并结合目前我国乳腺癌诊疗现状及相关研究进展,深入剖析病例。
、Tucatinib)通过阻断HER2信号通路,为多线治疗失败患者提供了新的选择。然而当下临床工作仍面临诸多挑战,如耐药机制复杂(如HER2异质性、下游信号代偿激活)及药物毒性管理。当前研究聚焦于ADC药物序贯优化、靶向联合免疫治疗及基于液体活检的个体化策略,旨在突破生存瓶颈。医脉通特邀邢台市人民医院王丽教授点评、张世玉医生分享一例HER2阳性晚期乳腺癌病例,作为临床实践参考,并结合目前我国乳腺癌诊疗现状及相关研究进展,深入剖析病例。
患者基本信息
患者,女,发病年龄59岁
主诉:发现左乳肿块4月余于2019年7月入院
既往史、家族史:无特殊、无恶性肿瘤家族史
体格检查
双乳对称,左乳外上象限可触及一枚大小约3.5×2.0cm肿物,质硬,表面欠光滑,边界不清,活动度可,左腋窝触及一枚大小约2.0×1.0cm肿大淋巴结,质硬,边界清,活动可,右乳、右腋窝、双锁骨上未触及明显肿大淋巴结。
辅助检查
双乳X线示:左乳癌 BI-RADS 5类,左侧腋窝可见异常肿大淋巴结。右侧乳腺增生症。
双乳超声示:左乳腺体层低回声 BI-RADS 4c类,左侧腋窝可见多发异常肿大淋巴结,较大者约2.0×1.0cm,右乳符合乳腺增生症。右侧腋下及双侧锁骨上未见明显异常肿大淋巴结。
左乳肿物+左腋窝淋巴结穿刺:(左乳肿物)乳腺浸润性癌;(左腋下淋巴结)淋巴结中见转移性癌;
免疫组化:(左乳肿物):ER(2%弱+)PR(-)HER2(3+)Ki-67(50%+);(左腋下淋巴结):ER(10%弱+)PR(-)HER2(3+)Ki-67(30%+) GATA-3(+)
初始治疗
诊断:左乳癌 cT2N1M0 IIB期 HR(+)HER-2(+)型
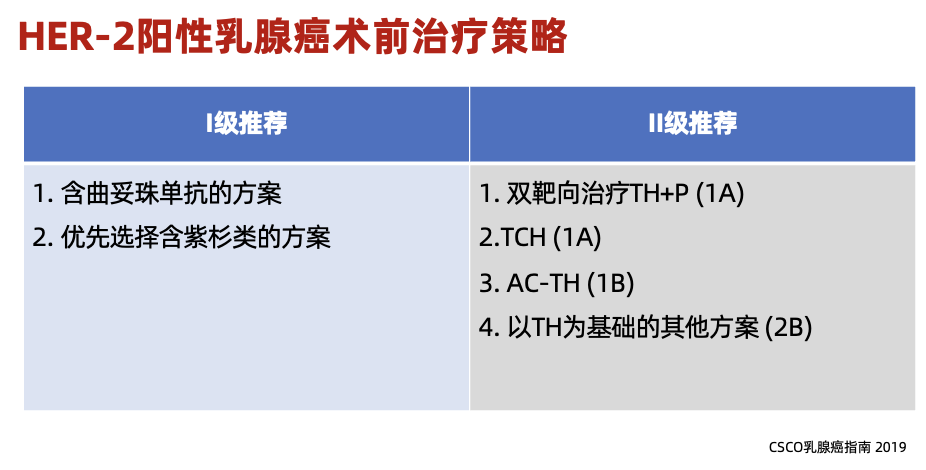
新辅助化疗(依据2019版CSCO BC指南):
· 患者身高:155cm
· 体重:56kg,体表面积1.57㎡
· 方案:THP×4(多西他赛 75mg/㎡+曲妥珠单抗 首次8mg/kg 维持6mg/kg+帕妥珠单抗 首次840mg 维持420mg)1/21d
75mg/㎡+曲妥珠单抗 首次8mg/kg 维持6mg/kg+帕妥珠单抗 首次840mg 维持420mg)1/21d
临床疗效评估:完全缓解(CR)
手术治疗:2019年10月31日行左乳癌改良根治术;
· 术后病理:左乳腺瘤床未见明显浸润性癌残留,点灶性见高核级导管内癌,可见散在脉管内癌栓,未见神经累及,间质组织纤维增生伴少量淋巴细胞、组织细胞浸润,符合新辅助化疗后改变,MP分级5级;乳头、基底、皮肤均未见癌;腋窝淋巴结见转移性癌(1/21)。
· 免疫组化:ER(-)PR(-)HER2(3+)Ki-67(20%+)
诊断:左乳癌ypT0N1M0 IIA期(HER2阳性型)
术后治疗:
· FEC×3周期辅助化疗后,序贯HP(曲妥珠单抗 维持6mg/kg+帕妥珠单抗 维持420mg 1/21d)治疗满1年。
· 末次治疗时间2020年11月
· 内分泌治疗:阿那曲唑 1mg 口服 qd
1mg 口服 qd
解救治疗
01、一线治疗
患者于2021年7月常规门诊复查。
双锁骨上淋巴结超声:双侧锁骨上低回声结节,考虑异常肿大淋巴结。
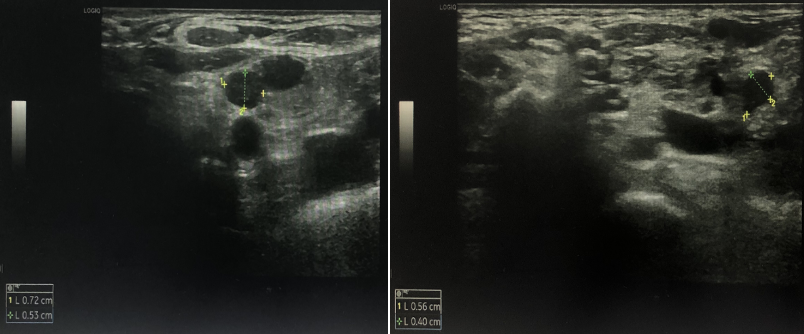
胸部CT:纵隔及右肺门多发淋巴结,部分肿大,较前新增,双侧胸腔积液 伴双肺局部膨胀不全,较前进展。
伴双肺局部膨胀不全,较前进展。
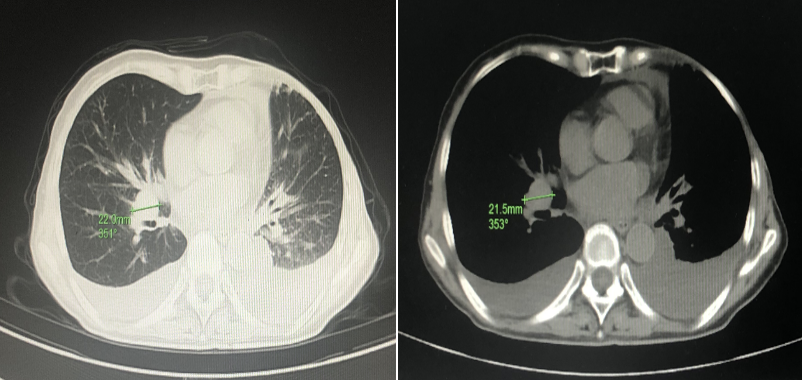
左锁骨上淋巴结穿刺:纤维脂肪组织中间癌浸润,病史及免疫组化符合乳腺癌转移;免疫组化:ER(-)PR(-)HER2(3+)Ki-67(热点区40%+)GATA-3(+)。
无病生存期(DFS):近12月。
晚期一线方案:T-DM1(体重:37kg,130mg,3.6mg/㎡,1/21d)(依据CSCO BC指南 EMILIA研究结果)。
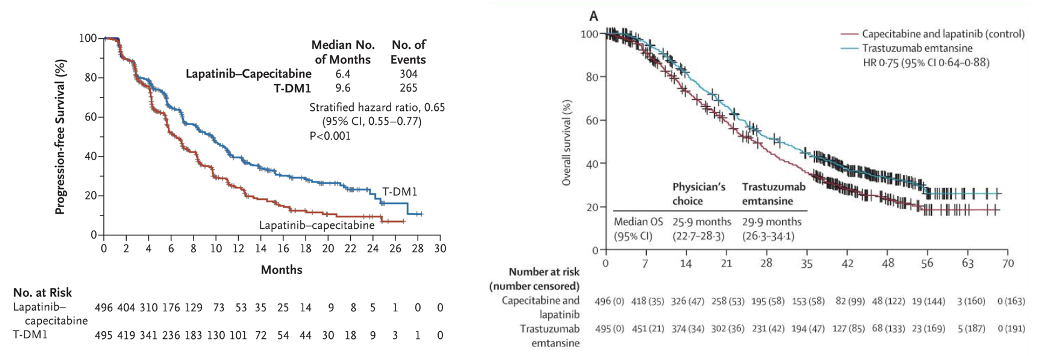
EMILIA研究总体人群PFS和OS曲线
EMILIA研究:对于曲妥珠单抗和紫杉类药物治疗失败的HER2阳性晚期乳腺癌患者,T-DM1较拉帕替尼 +卡培他滨
+卡培他滨 可改善中位无进展生存期(PFS)并显著延长中位OS。
可改善中位无进展生存期(PFS)并显著延长中位OS。
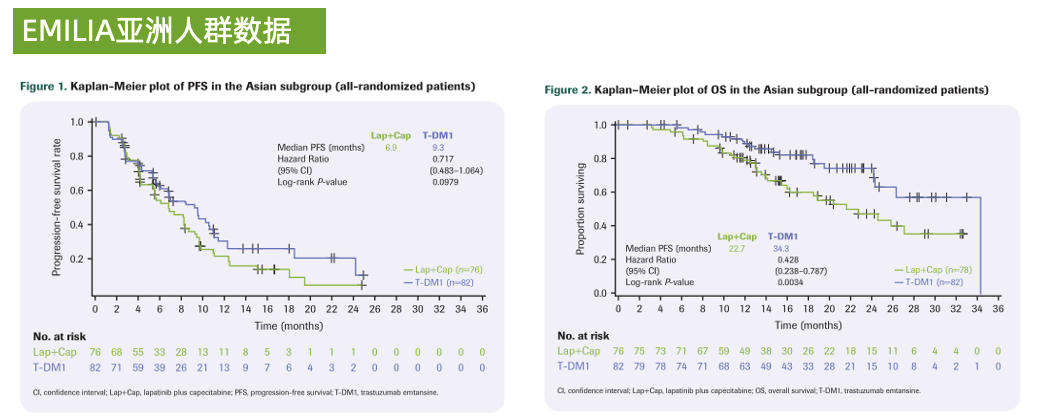
EMILIA研究亚洲人群PFS和OS曲线
疗效评估:部分缓解(PR)
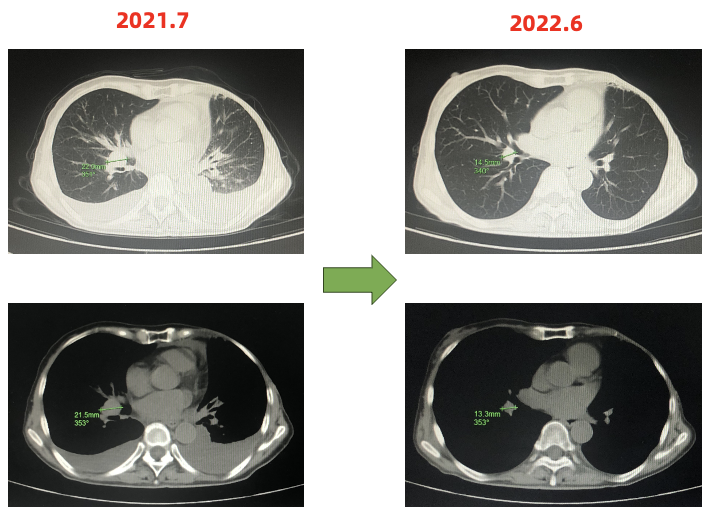
一线PFS:15月
02、二线治疗
2022年10月头颅MR:脑内多发异常强化灶,结合病史考虑转移。(新发脑转移)
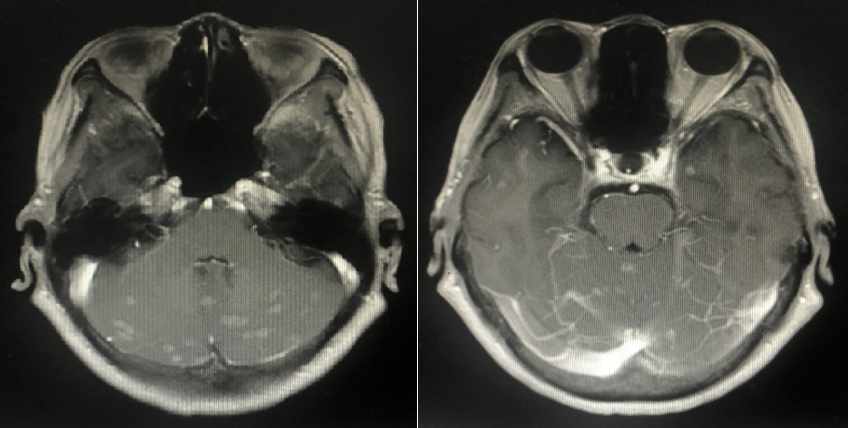
二线治疗方案:吡咯替尼 400mg/d + 卡培他滨 1.0g 2次/d 1/21d(依据PHENIX研究)
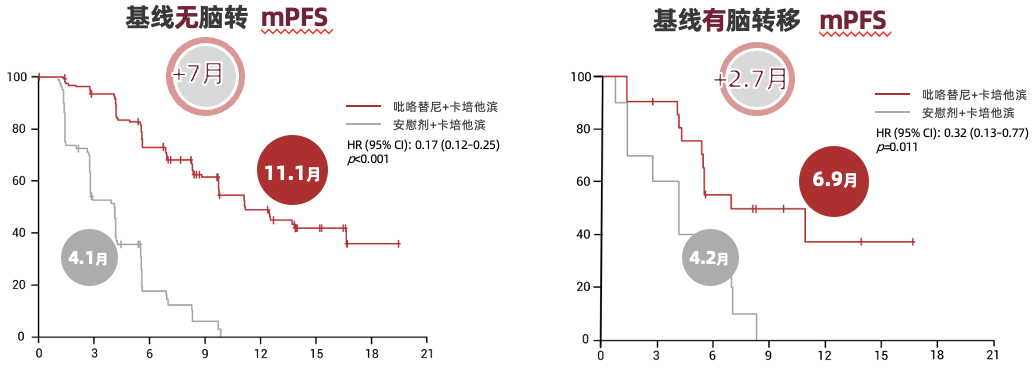
PHENIX研究:基线有脑转移患者,吡咯替尼方案可延长中位PFS近3月,有效抑制脑转移进展。
疗效评估:PR
2023年9月头颅增强MR:脑内多发异常强化灶,部分较前缩小。
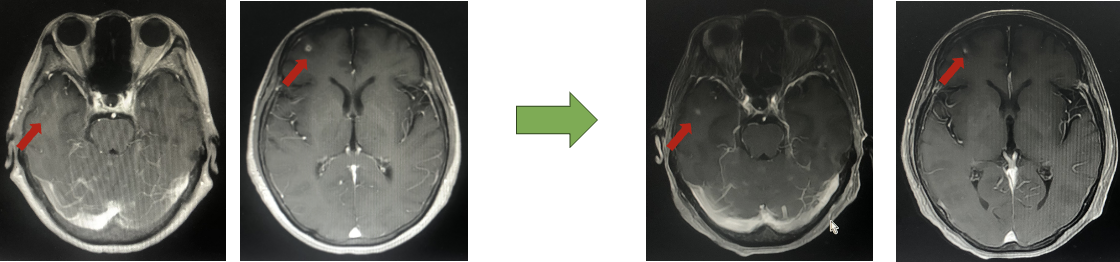
二线PFS:19月
03、三线治疗
2024年5月头颅增强MR:脑内多发异常强化灶,较前增多增大。
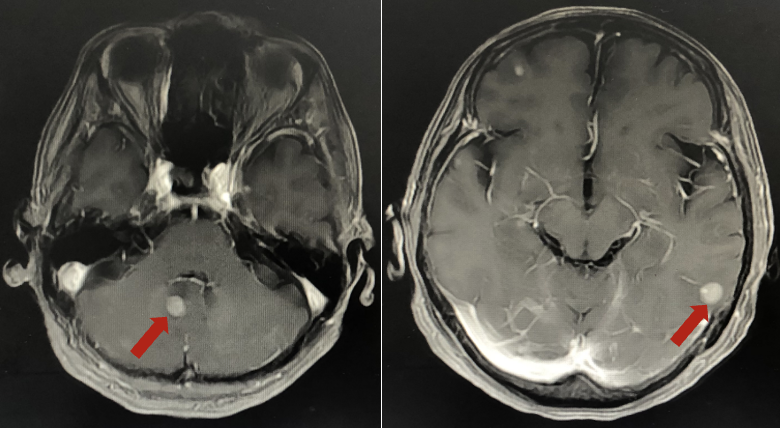
三线治疗方案:T-DXd (200mg 体重37kg 5.4mg/kg)(依据DESTINY-Breast系列研究)。
不良事件:患者用药过程中,恶心、呕吐及疲乏症状较重。
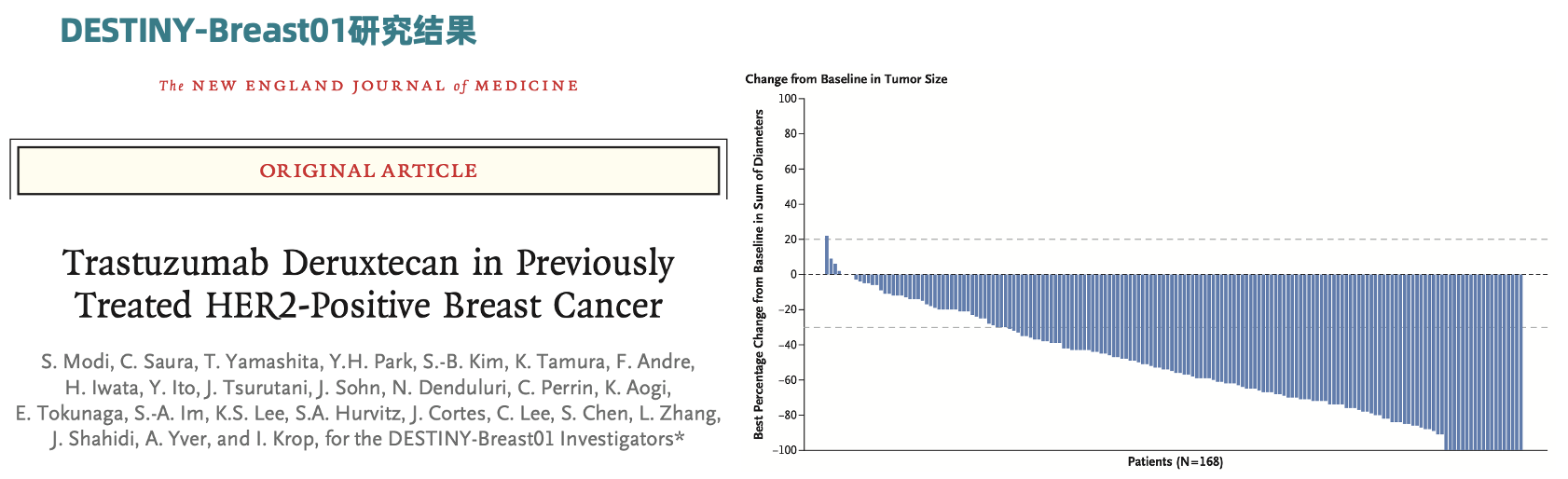
DESTINY-Breast01研究
DESTINY-Breast01研究:在184例接受T-DXd推荐剂量为5.4mg/kg治疗的患者中,独立中心审查确认的ORR达到60.9%,有6.0%的患者达到肿瘤CR,疾病控制率达到97.3%。
2019年12月,FDA加速批准了T-DXd用于转移阶段既往已接受过≥2线抗HER2治疗的HER2阳性晚期乳腺癌患者。
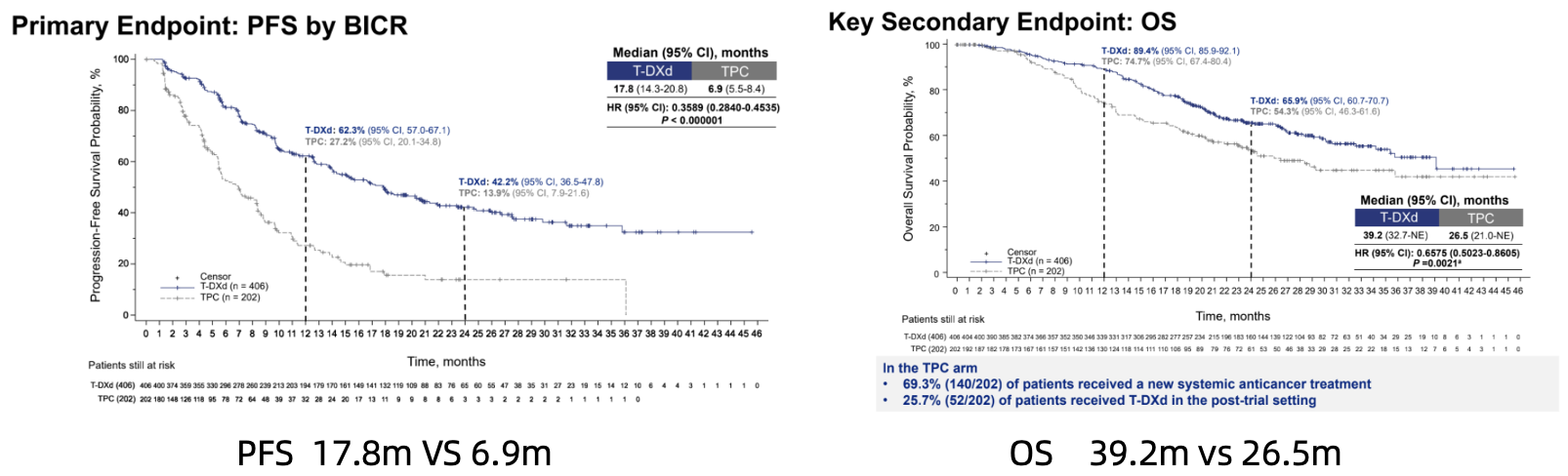
DESTINY-Breast02研究:对于T-DM1经治的HER2阳性不可切除和(或)转移性乳腺癌患者,探索了T-DXd(5.4mg/kg,q3w)较研究者选择方案的疗效差异。主要研究终点为PFS,次要研究终点为OS。
疗效评估:疾病进展(PD)
2024年8月头颅增强MR:脑内多发异常强化灶,较前增多增大,进展。
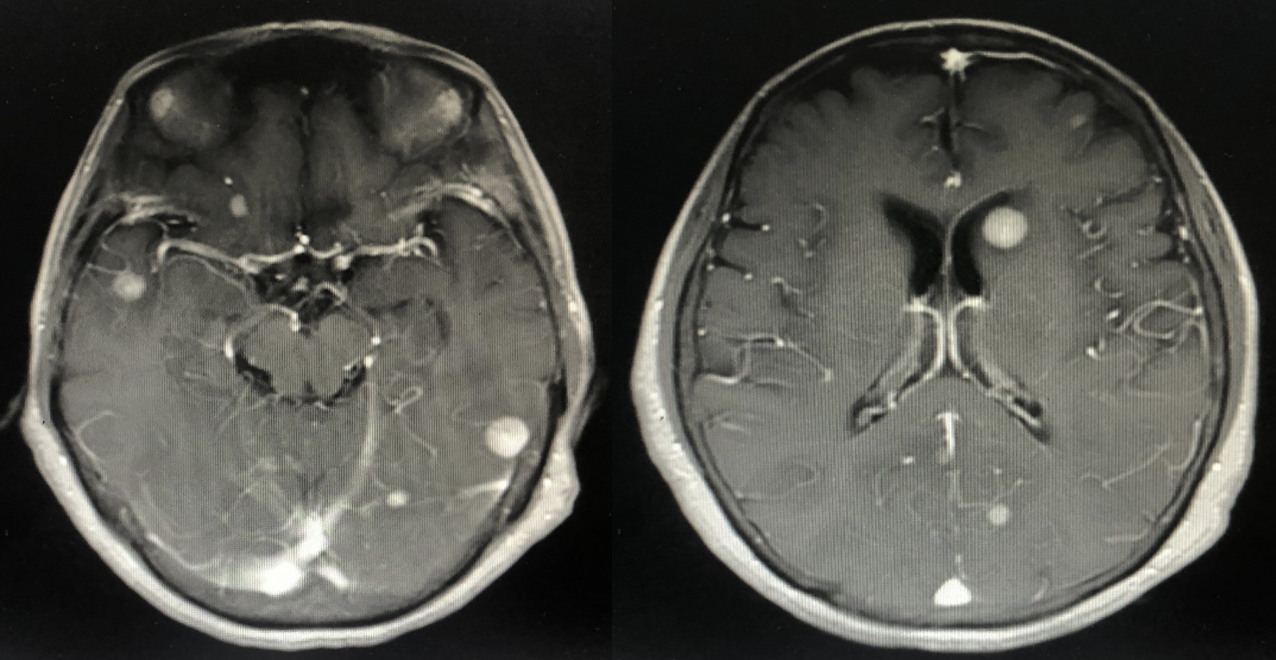
三线PFS:3个月
04、四线治疗
患者于放疗科放疗,至今失访
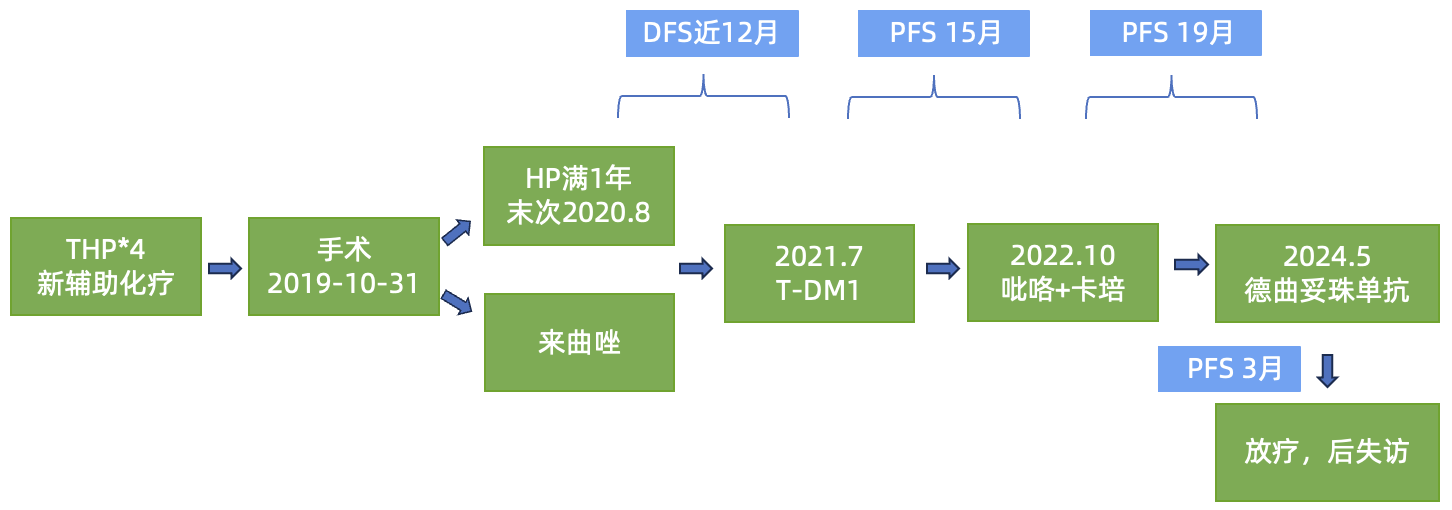
诊疗经过回顾
专家点评
这是一例HR低表达,HER2阳性乳腺癌患者从早期走向晚期的5年历程,也印证了HER2阳性乳腺癌治疗理念的变革与更新。患者初次就诊时系合并腋窝淋巴结转移的HER2阳性乳腺癌,基于当时的指南推荐,新辅助治疗采用THP方案(多西他赛+曲妥珠单抗+帕妥珠单抗)4周期,术后病理提示MP分级5级,腋窝淋巴结1/21转移,表明新辅助治疗有效,但未达到病理学完全缓解,如果按照当下证据应行T-DM1进行辅助强化治疗。该患者术后辅助治疗采用FEC×3周期后HP双靶向治疗满1年,完全遵循了NeoSphere方案的设计。但内分泌治疗(阿那曲唑)的指征值得商榷。因患者原发灶ER仅2%弱阳性,术后大病理ER阴性,根据ASCO指南,ER低表达(1-10%)患者内分泌治疗获益有限。若术后ER确为阴性,可能无需继续内分泌治疗,需重新评估ER检测的准确性(如原发灶与转移灶异质性)。
一线解救治疗(T-DM1):患者系曲妥珠单抗原发耐药人群,基于EMILIA研究,T-DM1作为曲妥珠单抗和紫杉类治疗失败后的国际一线标准治疗方案,符合指南推荐,考虑到本例患者体重较小,需特别关注药物的血液学毒性,合理调整药物剂量。
二线解救治疗(吡咯替尼联合卡培他滨):脑转移后采用吡咯替尼联合卡培他滨(PHENIX研究支持)符合《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南》推荐。同时河南省肿瘤医院闫敏教授团队发起的一项吡咯替尼联合卡培他滨治疗HER2阳性脑转移的多中心、前瞻、单臂、开放的Ⅱ期PERMEATE研究,同样支持二线尽早选择吡咯替尼的联合治疗,无论患者是否曾接受过局部放疗,吡咯替尼联合卡培他滨的治疗方案均能为HER2阳性乳腺癌伴脑转移的患者带来显著的长期生存期获益,尤其在未接受放疗的患者中尤为显著。这同时也提示,乳腺癌新发脑转移不必急于局部治疗,某些具有中枢活性的抗肿瘤药物,或可作为优先考虑的治疗选择。
三线进展时基于DESTINY-Breast系列研究,换用T-DXd(德曲妥珠单抗)是非常合理的选择,但患者耐受性差,需优化支持治疗或调整剂量。
后续治疗方面,目前患者已接受多线治疗(T-DM1、吡咯替尼、T-DXd),后续选择有限。首先鼓励患者参加合适的临床试验,探索新型ADC药物(如Trop2-ADC)、HER2/CD3双抗或联合免疫治疗。其次患者目前已经进行了脑部放疗,需向患者家属充分告知放疗可能带来的认知障碍等问题。另外可考虑二代测序(NGS)检测耐药机制(如HER2突变、PI3K通路异常),寻找潜在靶点(如mTOR抑制剂)。内分泌治疗方面,因患者原发灶ER低表达且术后阴性,内分泌治疗可能无效,除非转移灶活检证实ER阳性。与此同时支持治疗方面不容忽视,需加强营养支持及恶病质管理。
在《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南2024版》中,对于HER2阳性转移性乳腺癌患者,ADC治疗失败后,靶向药物如何选择是临床热点问题,T-DM1治疗失败后,首选T-DXd,但T-DXd治疗失败后如何选择,目前仍缺乏高质量的临床研究,我们也期待未来有更多更好的药物出现,可以更好地服务我们的患者。

参考文献:
1. 中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)乳腺癌诊疗指南2019. 人民卫生出版
2. 中国抗癌协会乳腺癌专业委员会.中国抗癌协会乳腺癌诊治指南与规范(2019年版)[J].中国癌症杂志,2019,31(10):954-1040.DOI:10.19401/j.cnki.1007-3639.2021.10.013.
3. 国家肿瘤质控中心乳腺癌专家委员会,中国抗癌协会乳腺癌专业委员会,中国抗癌协会肿瘤药物临床研究专业委员会. 中国晚期乳腺癌规范诊疗指南(2024版). 中华肿瘤杂志,2024,44(12):1262-1287.
4. ESMO Metastatic Breast Cancer Living Guidelines,v1.1 May 2023.
5. Patient-reported outcomes from EMILIA, a randomized phase 3 study of trastuzumab emtansine (T-DM1) versus capecitabine and lapatinib in human epidermal growth factor receptor 2-positive locally advanced or metastatic breast cancer.Cancer. 2014;120:642–51. doi: 10.1002/cncr.28465
6. Turner N C, Oliveira M, Howell S J, et al. Capivasertib in Hormone Receptor–Positive Advanced Breast Cancer[J]. New England Journal of Medicine, 2023, 388(22): 2058-2070.
7. Event-free survival in patients with early HER2-positive breast cancer with a pathological complete response after HER2-targeted therapy: a pooled analysis.Cancers 14, 5051 (2022).

