
腹膜弥漫性平滑肌瘤病并子宫外腺肌瘤1例
作者:宋春红,朱勇杰,吴亮,王芸等,阿克苏地区第一人民医院,温州医科大学附属第一医院
子宫肌瘤 是一种主要发生于育龄期女性的良性肿瘤,该病早期症状不明显,随着肌瘤的逐渐长大将给患者的生活和健康带来影响。现临床上的主要治疗方式为手术,因腹腔镜
是一种主要发生于育龄期女性的良性肿瘤,该病早期症状不明显,随着肌瘤的逐渐长大将给患者的生活和健康带来影响。现临床上的主要治疗方式为手术,因腹腔镜 手术具有损伤小、出血少等优点,故腹腔镜下肌瘤剥除术更受欢迎。但采用腹腔镜手术剥离肌瘤也会出现并发症,影响患者的预后。有研究[1-4]表明,腹腔镜下子宫肌瘤剥除术分碎肌瘤时,可能会有较小组织遗留在患者盆腹腔内,导致肌瘤组织在盆腹腔内种植和播散。
手术具有损伤小、出血少等优点,故腹腔镜下肌瘤剥除术更受欢迎。但采用腹腔镜手术剥离肌瘤也会出现并发症,影响患者的预后。有研究[1-4]表明,腹腔镜下子宫肌瘤剥除术分碎肌瘤时,可能会有较小组织遗留在患者盆腹腔内,导致肌瘤组织在盆腹腔内种植和播散。
通过检索国内外数据库并复习LPD及子宫外腺肌瘤相关病例,总结并分析LPD及子宫外腺肌瘤的诊断、鉴别诊断、发病机制、治疗以及预防措施,旨在进一步强化临床医师以及病理医师对LPD以及子宫外腺肌瘤的认识,以提高诊治水平减少疾病复发。
1 病例资料
患者,女,37岁,下腹痛4 d,有痛经史1年余。于2024年1月4日无明显诱因出现阵发性下腹痛,疼痛为坠痛,持续数分钟自行缓解,于2024年1月9日就诊于当地县医院行B超检查,提示盆腔多发实性占位,建议手术。患者为求进一步诊治于2024年1月11日就诊于阿克苏地区第一人民医院,门诊以“盆腔肿物”收住院。患者于2016年曾在当地县医院检查发现子宫肌瘤并行腹腔镜下子宫肌瘤剥除术+右侧输卵管囊肿剥除术,术后病理结果为: (子宫肌瘤)平滑肌瘤。术前B超及影像学仅提示子宫肌瘤,未提示其他部位占位。本次住院专科检查提示:右侧附件区触及8 cm大小边界清晰的包块,有压痛,左侧附件区未触及明显异常。2024年1月12日B超提示:盆腔偏右侧见大小84 mm×70 mm的低回声,边界清,形态欠规则,内见丰富血流信号,收缩期峰值血流速度(peak systolic blood flow velocity, PSV):54 cm/s,血流阻力指数(resistance index, RI):0.73,其旁另见大小72 mm×37 mm×45 mm的混合性回声,边界清,实性部分见血流信号,子宫后方见大小51 mm×43 mm×58 mm的低回声,边界清,形态欠规则,内见丰富血流信号,PSV:25 cm/s,RI:0.5。盆腔多发低回声病变,紧贴肾中部低回声病变,考虑腹膜后来源病变。2024年1月13日CT提示:①子宫后壁肌层内、宫底向上突起等密度占位,考虑子宫肌瘤可能。②右侧髂窝区、盆腔内多发实性占位性病变,考虑平滑肌瘤病。③右侧附件区混杂密度占位,考虑囊性病变可能。临床初步诊断: ①子宫多发性平滑肌瘤;②盆腔肿物。
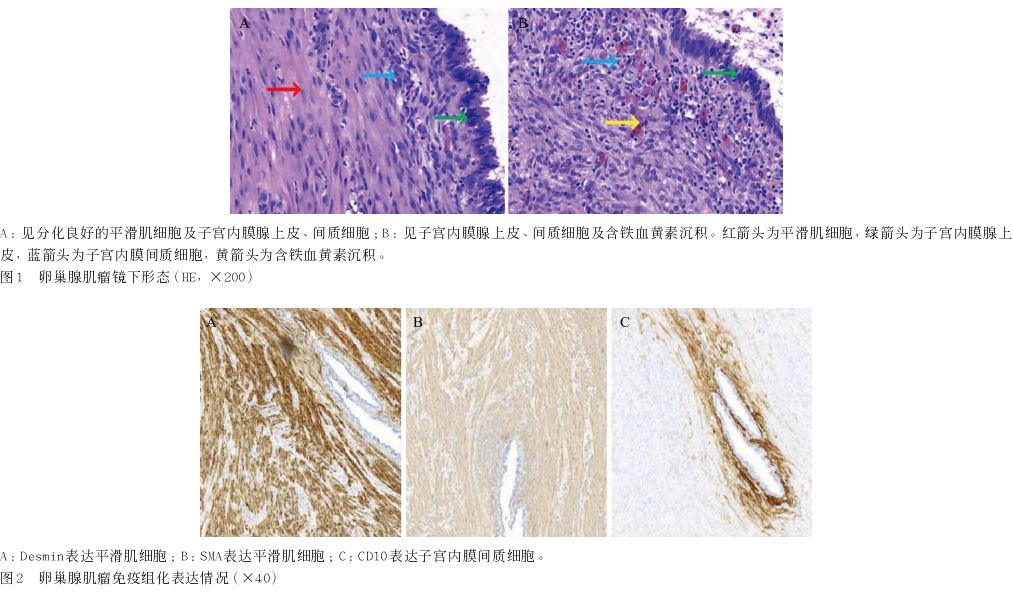
完善术前检查后,于2024年1月18日在全身麻醉下行腹式子宫肌瘤切除术+卵巢病损切除术+ 盆腔病损切除术+阑尾切除术。术中所见:宫底见 3 cm×2 cm大小肿物,空肠肠系膜见一肿物约8 cm× 6 cm,阑尾系膜见一肿物约2 cm×2 cm,子宫后方结肠系膜见一肿物约6 cm×5 cm,右侧卵巢增大约5 cm×4 cm,切开右侧卵巢表面,完整剥离卵巢肿瘤,切取全部肿瘤并送病理。送检病理标本包括右侧卵巢肿物、肠系膜肿物、子宫肿物、阑尾肿物及腹壁肿物。病理大体检查:子宫肿物、阑尾肿物、腹壁及肠系膜肿物均为灰白色实性肿物,切面编织状,质硬,质地均匀;右侧卵巢肿物呈灰白色,切面为囊实性,囊性区见咖啡色粘稠液体流出,实性区质硬,质地均匀。病理形态学上肠系膜肿物、子宫肿物、阑尾肿物及腹壁肿物镜下均见交叉束状排列的分化良好的梭形肿瘤细胞,胞浆嗜酸、核呈雪茄形、核仁小、未见明确核分裂;右侧卵巢肿物镜下见梭形肿瘤细胞,胞浆嗜酸、核呈雪茄形、核仁小、核分裂罕见,呈交叉束状排列,在梭形肿瘤细胞间见子宫内膜腺体、子宫内膜间质细胞及含铁血黄素沉积,并形成囊腔(图1)。免疫组化结果:肠系膜肿物、子宫肿物、阑尾肿物及腹壁肿物,肿瘤细胞均表达平滑肌标记:CD117(-)、DOG-1(-)、CD34(血管+)、S-100(-)、SMA(+)、Desmin(+)、Ki67(3%+)、Caldesmon(+)。右侧卵巢梭形肿瘤细胞表达平滑肌标记:Desmin(+)、SMA(+)、Caldesmon(+);腺体周围的间质细胞表达子宫内膜间质细胞标记:CD10(+)(图2)。本例免疫组化采用链霉菌抗生物素蛋白-过氧化物酶连结法(streptavidin-perosidase, SP)法,DAB显色,所有一抗均购自北京中杉金桥生物技术有限公司。最终结合形态学及免疫组化结果,病理诊断结果提示为(子宫肿物)平滑肌瘤; (肠系膜肿物、阑尾肿物、腹壁肿物)平滑肌瘤,符合LPD; (右侧卵巢肿物)腺肌瘤。患者术后第7天出院,恢复良好。
2 讨论
LPD是一种发生于腹膜表面由多灶性平滑肌或平滑肌样结节组成的病变[5],绝大多数病例发生于女性,临床上多无明显症状,少数可因病变累及范围大而出现疼痛或压迫感等症状[6]。腺肌瘤是由子宫内膜样腺体和间质以及形态良好的平滑肌细胞组成的良性肿瘤,常起源于子宫[7]。子宫外腺肌瘤十分罕见,子宫外腺肌瘤常见发病部位包括卵巢、直肠旁间隙和阔韧带等,其常出现腹痛症状,部分患者也可出现异常阴道流血和不孕,也可因压迫周围组织和器官引起相应症状[3]。LPD在术前影像学上能做出多发性平滑肌瘤诊断,但子宫外腺肌瘤术前影像学诊断较困难,在以往报道病例中,影像学检查主要以超声为主[8]。检索文献发现超声图像多见低回声,边界清,形态规则,内见血流或形成一个类似“子宫”的超声图像[8]。若超声医师对本病的诊断经验不足,易将本病诊断为浆膜下子宫肌瘤、卵巢良性实性肿瘤或恶性肿瘤等[8]。诊断子宫外腺肌瘤单纯依靠影像学是非常困难的,在检索到的病例报道中,均未能在术前做出明确诊断[7-11],所有病例的确诊均依靠术后病理。本例患者术前超声提示“盆腔多发低回声病变”,CT检查 报告提示子宫平滑肌瘤病,但右附件区仅提示囊性病变可能,未能明确诊断,直至术后病理结果才得以明确诊断为右侧卵巢腺肌瘤。
报告提示子宫平滑肌瘤病,但右附件区仅提示囊性病变可能,未能明确诊断,直至术后病理结果才得以明确诊断为右侧卵巢腺肌瘤。
LPD大体为多个灰白色实性肿物,切面编织状,质硬,质地均匀,镜下由交叉束状排列的分化良好的梭形平滑肌肿瘤细胞组成。子宫外腺肌瘤大体见灰白色肿物切面呈囊实性,囊性区见咖啡色粘稠液体流出,实性区质硬,质地均匀,镜下由梭形平滑肌肿瘤细胞、子宫内膜腺体以及子宫内膜间质细胞组成。发生于盆腹腔呈梭形细胞形态的肿瘤较多,在组织学形态上与LPD和子宫外腺肌瘤较难鉴别,特别是在穿刺标本数量有限的情况下,更易造成漏诊或误诊。鉴别诊断有胃肠道间质瘤、胃肠道神经鞘瘤、炎性纤维性息肉、孤立性纤维性肿瘤、肠系膜纤维瘤病、内膜异位囊肿、卵巢纤维瘤、卵巢囊腺纤维瘤等,仔细观察组织形态学特征,查看临床病史、影像学检查结果并结合免疫组化结果可对本病做出明确诊断。
LPD和子宫外腺肌瘤均是罕见病变,发病机制均尚未明确,检索文献发现LPD发病机制可能与性激素依赖性学说、腹膜化生假说、医源性因素等有关[6,9];而子宫外腺肌瘤发病机制包括亚腔间充质转化、苗勒管融合缺陷、苗勒管疾病、子宫内膜异位症 以及分碎子宫切除术或子宫肌瘤切除术期间细胞的扩散等[7,9-11]。检索文献发现患者多有腹腔镜下子宫肌瘤剥除病史,腹腔镜下肌瘤剥除时需借助电动肌瘤分碎器旋切标本后方可将肌瘤从腹腔内取出,在旋切肌瘤过程中不可避免地会产生细小的组织碎片,这些组织碎片有可能脱落于盆腹腔中导致LPD和子宫外腺肌瘤的发生[1-4]。本例患者即在行腹腔镜下子宫肌瘤切除术后7年发生LPD和卵巢腺肌瘤,其发病机制考虑系因前次子宫肌瘤切除时细小肌瘤碎片落入盆腹腔导致医源性着床。进行腹腔镜肌瘤剥除术分碎肌瘤时,制备肌瘤密闭旋切袋,在密闭旋切袋内进行肌瘤分碎,能有效减少医源性着床的发生,可降低肌瘤组织播散率及种植率[2-3]。 LPD和子宫外腺肌瘤在临床表现和影像学上均无明显特异,术前不易诊断,明确诊断主要依靠术后病理,手术是其主要治疗方式,对于无法手术的LPD及术后宫外腺肌瘤患者使用亮丙瑞林
以及分碎子宫切除术或子宫肌瘤切除术期间细胞的扩散等[7,9-11]。检索文献发现患者多有腹腔镜下子宫肌瘤剥除病史,腹腔镜下肌瘤剥除时需借助电动肌瘤分碎器旋切标本后方可将肌瘤从腹腔内取出,在旋切肌瘤过程中不可避免地会产生细小的组织碎片,这些组织碎片有可能脱落于盆腹腔中导致LPD和子宫外腺肌瘤的发生[1-4]。本例患者即在行腹腔镜下子宫肌瘤切除术后7年发生LPD和卵巢腺肌瘤,其发病机制考虑系因前次子宫肌瘤切除时细小肌瘤碎片落入盆腹腔导致医源性着床。进行腹腔镜肌瘤剥除术分碎肌瘤时,制备肌瘤密闭旋切袋,在密闭旋切袋内进行肌瘤分碎,能有效减少医源性着床的发生,可降低肌瘤组织播散率及种植率[2-3]。 LPD和子宫外腺肌瘤在临床表现和影像学上均无明显特异,术前不易诊断,明确诊断主要依靠术后病理,手术是其主要治疗方式,对于无法手术的LPD及术后宫外腺肌瘤患者使用亮丙瑞林 和芳香酶抑制剂等药物可改善预后[12]。LPD在组织学上是良性的,少数可能会转变为恶性肿瘤[13],卵巢的腺肌瘤大多数也是良性肿瘤,但也有极少数合并恶性的报道[8],故临床医师需意识到LPD和子宫外腺肌瘤潜在的恶性并及时给予治疗。
和芳香酶抑制剂等药物可改善预后[12]。LPD在组织学上是良性的,少数可能会转变为恶性肿瘤[13],卵巢的腺肌瘤大多数也是良性肿瘤,但也有极少数合并恶性的报道[8],故临床医师需意识到LPD和子宫外腺肌瘤潜在的恶性并及时给予治疗。
参考文献略。
来源: 宋春红, 朱勇杰, 吴亮, 等. 腹膜弥漫性平滑肌瘤病并子宫外腺肌瘤1例[J]. 温州医科大学学报, 2025, 55(2): 150-152.
