
一例EGFR-ALK双靶点突变肺癌患者病例
作者:余慧青 重庆大学附属肿瘤医院 老年肿瘤科
本文为作者授权医脉通发布,未经授权请勿转载
患者为68岁老年女性,汉族,因“诊断‘肺腺癌’3年余,综合治疗中”于2024-12-02入院。
病史特点:
老年女性,起病隐匿,病程长。
现病史:
3年余前患者体检检查发现“肺占位性病变”,胸部增强CT:1.右肺下叶后基底段肿块(直径约5.4cm),考虑周围型肺癌可能,伴右肺下叶、后基底段支气管受侵,右颈根部及肺门淋巴结转移。于2021-09-28(肺组织)病理检查报告:(肺)穿刺物见非小细胞癌,结合免疫组化符合腺癌。遂就诊于我院行疑难病理会诊:肺穿刺活检:腺癌。基因检测:EGFR19号外显子上突变,于2021-10-23开始予奥希替尼靶向治疗。2022-04-24复查PET/CT与我院2021.10 PET-CT片比较:右肺下叶斑片状影,考虑治疗后改变;右下肺后基底段软组织结节(2.2cm×2.8cm)伴代谢增高,较前新增,考虑复发可能。与患方沟通后,于2022-05-16开始行右下肺肿瘤放疗(6X-FFF SBRT(VMAT)-SIB,剂量:PTV 50Gy/10F/2W,iGTV 70Gy/10F/2W)。于2023-04-10返院复查PET/CT提示新增右肺下叶肿块伴代谢增高,考虑恶性病变可能,排除绝对手术禁忌症,于2023-04-19在全麻下行姑息性胸腔镜下右肺下叶切除术+胸腔镜下胸膜粘连松解术,手术顺利。术后肺癌驱动基因结果回示基因EML4的2号外显子和基因ALK的20号外显子发生融合,结合患者治疗意愿,2023-05-17口服“洛拉替尼 100mg qd”靶向治疗,病情稳定。2023-10-25返院复查提示病情进展,予洛拉替尼靶向治疗联合长春瑞滨胶囊化疗,并予地舒单抗抗骨转移治疗,2023-12-18予以骨减症放疗累计完成骶椎30Gy/10F,胸椎27Gy/9F。2024-3月,患者病情进展(骨、脑、肺),予以PP方案化疗1周期,耐受性差,遂予伏美替尼靶向治疗,2024-04-28予以89锶-骨转移瘤治疗。今为求进一步治疗,以“肺恶性肿瘤”收住入院。
与本病相关病史:
既往有高血压病史10余年,最高血压180/?mmHg,目前口服“苯磺酸左氨氯地平片 2.5mg qd ”降压治疗;既往有糖尿病病史,未规律监测血糖,目前口服“阿卡波糖 50mg tid”控糖治疗。
专科检查:
ECOG 1分,NRS 1-3分,皮肤黏膜未见皮疹、瘀斑、瘀点。右侧胸壁可见手术疤痕,愈合可,无渗血渗液。双肺呼吸音低,未闻及干湿性啰音。心律齐,心音正常,各瓣膜听诊区未闻及病理性杂音。腹软,无压痛,反跳痛及肌紧张。双下肢无水肿。
辅助检查:
胸腹部CT:对比前片(2024-08-02):1. 右肺下叶部分缺如,术区条片影,残余右肺及左肺少许渗出性改变,较前相仿。2. 双肺多发结节,较前相仿,考虑转移可能,建议随诊。3. 右侧少量胸腔积液,较前相仿。心包少量积液,较前减少。4. 右锁骨上、右肺门及纵隔内多发淋巴结,较前相仿。主动脉弓及左冠脉壁钙化,同前。5. T8、T10椎体病理性压缩性骨折;T8椎体高密度影,术后?同前,请结合临床。6. 所示颈胸腰椎椎体及附件、双侧部分肋骨、左侧肩胛骨异常密度,考虑转移,较前大致相仿,伴部分肋骨病理性骨折可能,同前;请结合临床。7. 肝内多发转移,较前缩小。胆囊结石,同前;胆囊底壁增厚伴强化,腺肌症?较前相仿。8. 双侧肾上腺增粗,右侧新发结节,考虑转移;左肾结石;右肾囊肿;均同前。
头颅MRI:比前片(2024-08-01):1. 双侧额叶、桥脑右侧、小脑蚓部、左侧小脑转移可能,左侧小脑半球结节较前稍缩小、强化减低,其余较前相仿。2. 双侧半卵圆中心及侧脑室旁异常信号影,较前大致相仿,可能为血管起源的白质高信号(Fazekas 3级)。3. 额骨、枕骨左侧异常信号,较前相仿。4. 双侧上颌窦、筛窦、蝶窦炎症,较前相仿。双侧晶状体变薄,同前。5. 上述多发骨质改变伴软组织肿块,考虑转移,T8、T10病理性压缩性骨折,T8椎体内低信号、治疗后改变?部分强化程度较前稍减低、软组织影较前减少。6. 颈胸腰椎退变,较前相仿。T12椎体下缘上述改变,许莫氏结节不除外,较前变化不大;随诊。7. C3/4椎间盘(中央型)突出,C5/6、L2-5椎间盘膨出,均较前变化不大。8. 腰背部皮下筋膜炎,较前相仿。9. 扫及肝内强化结节;左侧肾上腺增粗,右肾上腺结节;右肺条片、结节影,请结合相关检查。
诊断:
右肺下叶腺癌 T4N3M1 IV期;骨继发恶性肿瘤;脑继发恶性肿瘤;肝继发恶性肿瘤;肺继发恶性肿瘤;原发性高血压3级 很高危;癌性疼痛
病史总结:
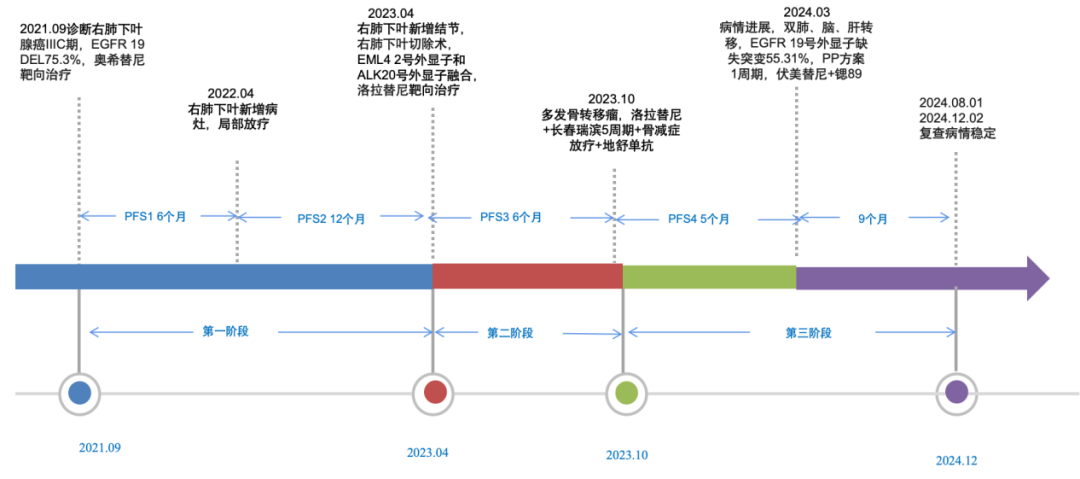
病例评析:
在亚裔肺腺癌患者中,EGFR 基因的发生概率高达50%,ALK 融合基因突变的概率为5%~8%,由于这 2 个基因突变在免疫治疗上效果欠佳,所以很多靶向药物围绕这2个基因突变进行研发。早期研究认为是EGFR、ALK是独立的分子事件,相互排斥,但近年来不断有 EGFR和ALK共存突变的病例或研究报道[1,2]。2008年,美国和韩国研究者首次报告了EGFR和ALK双突变患者,这名患者的EGFR突变类型是最常见的19号外显子缺失突变(Del19),而ALK突变则是EML4-ALK融合突变[3]。2010年,吴一龙教授团队报告了国内的首例双突变患者,EGFR和ALK两个基因的突变模式与第一例完全相同。这名女性患者的病情处于相对早期,因此并未接受靶向治疗,而是做了手术切除,术后的生存期达到38个月[4]。随着分子检测技术的发展,EGFR/ALK双突变病例报道陆续出现,现有的数据显示,大多数国内外的基因测序分析中,EGFR/ALK双突变的检出率都在 0.3%~1.3%之间,属于罕见的基因改变事件。根据全球关于EGFR-ALK共存突变的NSCLC相关统计数据显示,患者在无吸烟史(56.3%)、腺癌(80.6%)、临床分期较晚(61.2%)的亚洲人群(54.4%)中数量较多,二者突变亚型以常见类型为主[5-8]。Tiseo等报道1例双突变患者,ALK阳性和阴性细胞均能检测到EGFR突变,提示双突变可位于同一细胞或一个细胞可同时表达EGFR突变蛋白或ALK重排蛋白[9]。Cai等报道使用激光微切割捕获技术,在肿瘤不同区域,既可以发现双突变区域,又可以发现EGFR突变或ALK重排区域,说明双突变可以存在于同一癌细胞上。双突变肿瘤发生和进展依赖于两个或者其中一个驱动基因尚未可知[10]。多篇相关报道均显示双突变和单突变患者接受靶向单药治疗的效果类似,且使用靶向药的疗效显著好于化疗[11-12]。
本病例展现了EGFR-ALK双突变肺腺癌的复杂治疗过程。患者初诊时EGFR 19外显子突变阳性,接受奥希替尼治疗后短期内获益,但随后出现局部复发和远处转移,提示原发耐药或肿瘤异质性导致部分克隆逃逸。放疗及手术切除后检出EML4-ALK融合突变,提示两种驱动基因可能共存于不同肿瘤亚克隆或同一细胞中。然而,序贯使用ALK抑制剂洛拉替尼仍未能控制病情进展,可能与肿瘤微环境改变、旁路信号激活或药物渗透性不足相关。后续联合化疗及多线靶向治疗。现有研究表明,EGFR-ALK双突变患者对单药靶向治疗的缓解持续时间较短,序贯治疗的中位无进展生存期显著低于单突变患者,可能与两种驱动通路交替主导肿瘤进展有关。近年有学者尝试联合EGFR/ALK双靶点抑制剂,需警惕叠加毒性(如间质性肺炎、肝损伤)。多线治疗后肿瘤基因组动态演变可能导致新耐药突变(如ALK G1202R、EGFR C797S),需通过重复活检或液体活检明确耐药机制。本病例警示临床需加强治疗全程分子监测,结合多学科诊疗(MDT)动态调整方案,以实现精准管控。
专家简介

余慧青 教授
重庆大学附属肿瘤医院
主任医师,硕士研究生导师,肿瘤内科学教研室副主任
重庆英才计划.创新创业领军人才
老年肿瘤科主任
临床营养科主任
中国抗癌协会癌痛整合治疗专委会副主委
中国抗癌协会安宁疗护专委会副主委
中国抗癌协会癌症康复与姑息治疗专委会常委
中华医学会疼痛学分会癌痛学组副组长
中国抗癌协会肿瘤代谢调节治疗专家协作组副组长
中国抗癌协会老年肿瘤专委会常委
中国肺癌防治联盟重庆分会副主委
国家卫健委疼痛质控中心癌痛专家组委员
重庆市中西医结合学会老年肿瘤专委会主任委员
重庆市医药生物技术协会癌症康复与姑息治疗专委会主任委员
重庆市医学会肿瘤MDT、流行病学与循证医分会副主委
重庆抗癌协会化疗副主委
重庆市营养学会常务理事
参考文献:
1.Talukdar S, Emdad L, Das SK, Fisher PB. EGFR: An essential receptor tyrosine kinase-regulator of cancer stem cells. Adv Cancer Res. 2020;147:161-188. doi:10.1016/bs.acr.2020.04.003
2.Shen J, Meng Y, Wang K, et al. EML4-ALK G1202R mutation induces EMT and confers resistance to ceritinib in NSCLC cells via activation of STAT3/Slug signaling. Cell Signal. 2022;92:110264. doi:10.1016/j.cellsig.2022.110264
3.Koivunen JP, Mermel C, Zejnullahu K, Murphy C, Lifshits E, Holmes AJ, Choi HG, Kim J, Chiang D, Thomas R, Lee J, Richards WG, Sugarbaker DJ, Ducko C, Lindeman N, Marcoux JP, Engelman JA, Gray NS, Lee C, Meyerson M, Jänne PA. EML4-ALK fusion gene and efficacy of an ALK kinase inhibitor in lung cancer. Clin Cancer Res. 2008 Jul 1;14(13):4275-83.
4.Zhang X, Zhang S, Yang X, Yang J, Zhou Q, Yin L, An S, Lin J, Chen S, Xie Z, Zhu M, Zhang X, Wu YL. Fusion of EML4 and ALK is associated with development of lung adenocarcinomas lacking EGFR and KRAS mutations and is correlated with ALK expression. Mol Cancer. 2010 Jul 13;9:188.
5.Thomas D, Maloney ME, Raval G. Concomitant EGFR Mutations and ALK Rearrangements in Lung Adenocarcinoma Treated With Osimertinib. Cureus. 2023;15(11):e48122. Published 2023 Nov 1. doi:10.7759/cureus.481222.
6.Hu H, Tan S, Xie M, et al. Case report: Concomitant EGFR mutation and ALK rearrangement in non-small cell lung cancer. Front Pharmacol. 2023;14:1167959. Published 2023 Aug 29. doi:10.3389/fphar.2023.1167959
7.Zhao D, Fan J, Peng L, et al. Two different patterns of lung adenocarcinoma with concomitant EGFR mutation and ALK rearrangement. Tumori. 2022;108(1):12-18. doi:10.1177/03008916211005546
8.夏丹丹,王惠宇,刘超英,等. 4.EGFR突变和EML4-ALK重排双阳性非小细胞肺癌研究进展. 国际呼吸杂志 39(04):300-306. DOI:10.3760/cma.j.issn.1673-436X.2019.04.010
9.Tiseo M, Gelsomino F, Boggiani D, et al. EGFR and EML4-ALK gene mutations in NSCLC: a case report of erlotinib-resistant patient with both concomitant mutations[J]. Lung Cancer, 2011, 71(2): 241-243.
10.Cai W, Lin D, Wu C, et al. Intrat umora l heterogeneit y of ALKrearranged and ALK/EGFR coaltered lung adenocarcinoma[J]. J Clin Oncol, 2015, 33(32): 3701-3709.
11.Lou NN, Zhang XC, Chen HJ, Zhou Q, Yan LX, Xie Z, Su J, Chen ZH, Tu HY, Yan HH, Wang Z, Xu CR, Jiang BY, Wang BC, Bai XY, Zhong WZ, Wu YL, Yang JJ. Clinical outcomes of advanced non-small-cell lung cancer patients with EGFR mutation, ALK rearrangement and EGFR/ALK co-alterations. Oncotarget. 2016 Oct 4;7(40):65185-65195.
12.Zeng Y, Zeng Q, Yang B, Hu Y. Therapeutic strategies to overcome ALK-fusion and BRAF-mutation as acquired resistance mechanism in EGFR-mutated non-small cell lung cancer: two case reports. Front Oncol. 2024;14:1390523. Published 2024 Nov 1. doi:10.3389/fonc.2024.1390523

