
并发多重感染脓毒症的X-连锁慢性肉芽肿病1例诊治体会
作者:王亚莉,单立业,刘振伟,王利武等,长春市儿童医院
慢性肉芽肿病(chronicgranulomatousdisease,CGD),是一种原发性免疫缺陷病[1],病因主要是编码还原型烟酰胺 腺嘌呤
腺嘌呤 二核苷磷酸钠(nicotinamideadeninedinucleotidephosphate,NADPH)氧化酶的5个亚基中任一亚基缺陷[2]。NADPH的5个亚基包括:gp91phox、p22phox、IM7phox、p67phox及p40phox,他们编码的基因分别为CYBB、CYBA、NCFl、NCF2和NCF4[3];最近Maria Ciriacoh等又发现了一种由CYBC1/EROS基因突变引起的常染色体
二核苷磷酸钠(nicotinamideadeninedinucleotidephosphate,NADPH)氧化酶的5个亚基中任一亚基缺陷[2]。NADPH的5个亚基包括:gp91phox、p22phox、IM7phox、p67phox及p40phox,他们编码的基因分别为CYBB、CYBA、NCFl、NCF2和NCF4[3];最近Maria Ciriacoh等又发现了一种由CYBC1/EROS基因突变引起的常染色体 隐性遗传AR-CGD[4]。CGD的遗传方式有X-连锁隐性遗传(XRCGD)及常染色体隐性遗传(AR-CGD)等。CGD患者白细胞不能产生过氧化氢
隐性遗传AR-CGD[4]。CGD的遗传方式有X-连锁隐性遗传(XRCGD)及常染色体隐性遗传(AR-CGD)等。CGD患者白细胞不能产生过氧化氢 ,过氧化物和其他活性氧分子,导致吞噬细胞的杀菌功能障碍[5],细胞产生活性氧(ROS)的能力受损,从而阻止它们杀死细胞内细菌和真菌,出现肉芽肿性炎症[6]。临床导致吞噬细胞不能杀伤过氧化物酶阳性细菌与真菌,引起严重感染[7]。但CGD并发多重(细菌、真菌、病毒)感染脓毒症
,过氧化物和其他活性氧分子,导致吞噬细胞的杀菌功能障碍[5],细胞产生活性氧(ROS)的能力受损,从而阻止它们杀死细胞内细菌和真菌,出现肉芽肿性炎症[6]。临床导致吞噬细胞不能杀伤过氧化物酶阳性细菌与真菌,引起严重感染[7]。但CGD并发多重(细菌、真菌、病毒)感染脓毒症 病例目前尚未见报道。
病例目前尚未见报道。
笔者医院于2020年6月23日,收治1例临床表现为反复多重严重感染5.5月龄患儿,采用二代测序方法进行全外显子测序分析,发现该患者携带CYBB基因上一个剪切突变,对患者及家属进行Sanger测序验证,证实为母源,半合突变;进而检查患儿中性粒细胞氧化功能明显降低,结合临床表现,最终诊断:X-CGD,脓毒症[细菌(沙门氏菌属、溶血链球菌),病毒(汉坦病毒),真菌(白色念珠菌)多重感染],流行性出血热,感染性腹泻 ,贫血
,贫血 。现将患者的诊治过程进行报告,并结合文献进行分析。
。现将患者的诊治过程进行报告,并结合文献进行分析。
1 临床资料
患儿,男性,5.5月龄,居住地为内蒙古自治区,因持续发烧5天入院。入院前5天无明显诱因出现发热 ,热峰40℃,热型不规则,服退热药,热可退,间隔6h左右体温复升;伴轻咳。腹胀,排黄色稀便,无粘液及脓血,日4~5次。无呕吐,无皮疹
,热峰40℃,热型不规则,服退热药,热可退,间隔6h左右体温复升;伴轻咳。腹胀,排黄色稀便,无粘液及脓血,日4~5次。无呕吐,无皮疹 ,病初尿量
,病初尿量 正常,入院当日尿量减少。
正常,入院当日尿量减少。
既往病史:3.5月龄时,因发热在我院普外科住院。诊断为肝脓肿,腹壁脓肿。脓汁培养,金黄色葡萄球菌 阳性。给予腹壁脓肿局部引流,全身抗生素治疗32天后治愈出院。
阳性。给予腹壁脓肿局部引流,全身抗生素治疗32天后治愈出院。
体格检查:体温38.9℃,脉搏 172次/分,呼吸52次/分,体重7.1kg,血氧(鼻导管吸氧3升/分)98%,血压70/35mm Hg。神志模糊,表情淡漠,时有烦躁。面色略苍白,口唇无发绀
172次/分,呼吸52次/分,体重7.1kg,血氧(鼻导管吸氧3升/分)98%,血压70/35mm Hg。神志模糊,表情淡漠,时有烦躁。面色略苍白,口唇无发绀 。咽部充血。双肺呼吸音粗,未闻及罗音。心音有力,心率172次/分,律齐。腹部膨隆,无压痛,未触及包块,肠鸣音
。咽部充血。双肺呼吸音粗,未闻及罗音。心音有力,心率172次/分,律齐。腹部膨隆,无压痛,未触及包块,肠鸣音 6~8次/分。肝右肋下4cm,剑突下5.5cm,质韧,边锐。脾肋下2.5cm,质软。肢体活动无异常,四肢末梢凉。
6~8次/分。肝右肋下4cm,剑突下5.5cm,质韧,边锐。脾肋下2.5cm,质软。肢体活动无异常,四肢末梢凉。
四肢皮肤可见花纹,毛细血管充盈时间5s。
实验室检查:血液分析:白细胞总数7.73×109/L,中性粒细胞38.10%,淋巴细胞56.10%;红细胞3.85×109/L,血红蛋白 89g/L;血小板225×1012/L。C反应蛋白(CRP),86.91 mg/L。降钙素
89g/L;血小板225×1012/L。C反应蛋白(CRP),86.91 mg/L。降钙素 原(PCT),2.61ng/m L。血气分析:p H7.25,Pa O292mmHg,Pa CO238mm Hg,BE-12mmol/L, HCO-316mmol/L,乳酸:3.0mmol/L。尿常规
原(PCT),2.61ng/m L。血气分析:p H7.25,Pa O292mmHg,Pa CO238mm Hg,BE-12mmol/L, HCO-316mmol/L,乳酸:3.0mmol/L。尿常规 :白细胞6~8/HP,红细胞5~6/HP,潜血+,蛋白+。便常规
:白细胞6~8/HP,红细胞5~6/HP,潜血+,蛋白+。便常规 :白细胞1~3/HP,红细胞1~2/HP,脓细胞0/HP,潜血+。肝功:ALT131.3U/L,AST145.9U/L。肾功能、心肌酶均正常。Ig A0.73g/L,Ig G12.06g/L,Ig M 1.93g/L,C31.27g/L, C40.36g/L。淋巴细胞亚群计数大致正常。出血热抗体:Ig G阳性,Ig M阴性。G-脂多糖,1、3-β-D葡聚糖和血清抗核抗体均阴性。肺炎衣原体和肺炎支原体
:白细胞1~3/HP,红细胞1~2/HP,脓细胞0/HP,潜血+。肝功:ALT131.3U/L,AST145.9U/L。肾功能、心肌酶均正常。Ig A0.73g/L,Ig G12.06g/L,Ig M 1.93g/L,C31.27g/L, C40.36g/L。淋巴细胞亚群计数大致正常。出血热抗体:Ig G阳性,Ig M阴性。G-脂多糖,1、3-β-D葡聚糖和血清抗核抗体均阴性。肺炎衣原体和肺炎支原体 Ig M抗体,甲乙丙肝、梅毒
Ig M抗体,甲乙丙肝、梅毒 及艾滋病毒抗体阴性。布鲁菌病
及艾滋病毒抗体阴性。布鲁菌病 试管凝集试验
试管凝集试验 <1∶25;结核杆菌抗体、结核菌素斑点试验阴性;伤寒O、H抗体<1∶20;甲型、乙型、丙型副伤寒
<1∶25;结核杆菌抗体、结核菌素斑点试验阴性;伤寒O、H抗体<1∶20;甲型、乙型、丙型副伤寒 H抗体均<1∶20;咽拭子甲型流感、乙型流感、腺病毒、巨细胞病毒及呼吸道合胞病毒核酸均阴性;血、便、骨髓细菌培养
H抗体均<1∶20;咽拭子甲型流感、乙型流感、腺病毒、巨细胞病毒及呼吸道合胞病毒核酸均阴性;血、便、骨髓细菌培养 ,沙门氏菌属阳性。
,沙门氏菌属阳性。
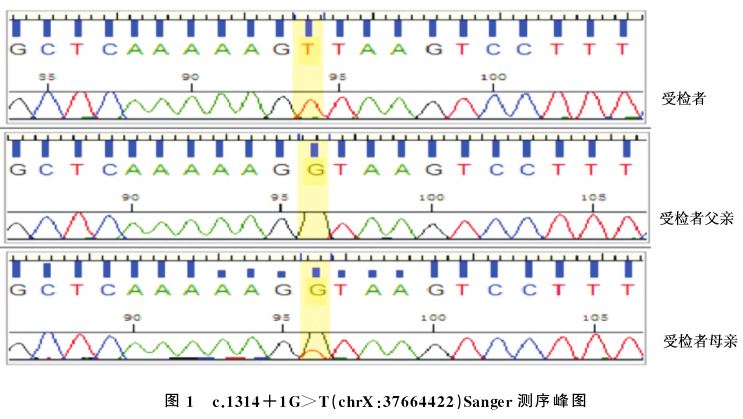
肝胆泌尿系彩超:肝右肋下40.9mm,剑突下44.3mm,右肝斜径86.5mm,肝被膜光滑,肝左内叶与左外叶见大小为14.7×6.4mm条状强回声。门静脉左支回声增强,壁增厚。脾厚23.7mm,肋弓下31.7mm。双肾未见异常。腹部MRI平扫+增强:肝脾增大,肝内未见确切异常信号。胸片:双肺纹理增强。基因检查:住院35天采集患儿及其父母外周血送第三方进行全外显子基因检测,结果:CYBB基因,chr X:37664422染色体位置,发现核苷酸改变,c.1314+1G>T。ACMG变异评级为致病基因,半合基因型。提示:X-连锁慢性肉芽肿病(X-CGD)。Sanger测序验证:母源,见图1。
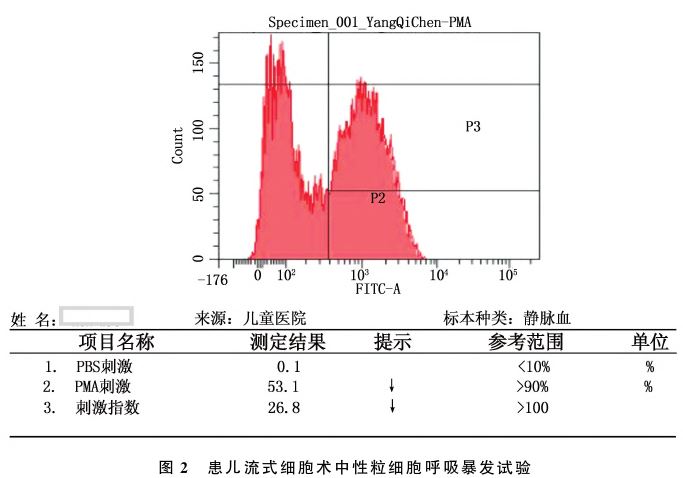
中性粒细胞呼吸爆发试验:取患儿及健康对照新鲜血送吉林大学第一医院进行中性粒细胞呼吸爆发试验。应用流式细胞仪,平行进行PBS和PMA刺激,PMA刺激仅为53.1%,刺激指数26.8;中性粒细胞峰图位移不明显,见图2;对照标本PMA刺激率为98.9%,刺激指数为7249,中性粒细胞峰图明显位移,见图3。入院诊断及诊断依据:(1)脓毒症(沙门菌属 感染),感染伴器官功能障碍(如肝脏肿大、皮肤发花等),依据新脓毒症定义为宿主对感染的反应失调,导致危及生命的器官功能损害[8]。(2)疑似流行性出血热,血清出血热病毒特异性抗体阳性。(3)感染性腹泻,患儿腹泻、便常规可见红、白细胞,培养沙门氏菌阳性。(4)贫血,血红蛋白89g/L。
感染),感染伴器官功能障碍(如肝脏肿大、皮肤发花等),依据新脓毒症定义为宿主对感染的反应失调,导致危及生命的器官功能损害[8]。(2)疑似流行性出血热,血清出血热病毒特异性抗体阳性。(3)感染性腹泻,患儿腹泻、便常规可见红、白细胞,培养沙门氏菌阳性。(4)贫血,血红蛋白89g/L。
治疗与转归,患儿入院立即给予抗休克治疗:①液体复苏:第一小时40ml/kg生理盐水静脉注射,后依据血压逐渐减量液体,维持在8~10 ml/kg/h。②肾上腺素 .1~0.2μg/kg/min静脉泵入。③抗菌治疗,给美罗培南
.1~0.2μg/kg/min静脉泵入。③抗菌治疗,给美罗培南 20 mg/kg,q8h静点。
20 mg/kg,q8h静点。
入院24小时后循环改善,血压稳定,尿量良好,乳酸降至1.0mmol/L。住院6天后体温逐渐降至正常,一般状态好转,少量哺乳,稍有腹胀,排黄色糊状便。查体肝脏较前缩小,变软;脾大 同前。补液100~120 ml/kg/d,肾上腺素减停。住院7~17天,尿量增多,尿比重低于1.01。肝脏右肋下3cm。泌尿系彩超:双肾增大。依据尿量增加补液。住院18~21天,尿量减少,再次发热,皮肤出现少许米粒大小红色充血性皮疹,间断腹胀、稀便。再次血培养
同前。补液100~120 ml/kg/d,肾上腺素减停。住院7~17天,尿量增多,尿比重低于1.01。肝脏右肋下3cm。泌尿系彩超:双肾增大。依据尿量增加补液。住院18~21天,尿量减少,再次发热,皮肤出现少许米粒大小红色充血性皮疹,间断腹胀、稀便。再次血培养 :溶血葡萄球菌阳性。抗生素加用替考拉宁
:溶血葡萄球菌阳性。抗生素加用替考拉宁 10 mg/kg,qd。住院22~25天体温趋于正常,精神不振,出现皮肤黄染,巩膜黄染,肝脏增大,肋下约5cm。血ALT75U/L,AST115 U/L,TBIL93μmol/L,IBIL50μmol/L,CRP及PCT升高。骨髓培养,白色念珠菌阳性。抗感染将替考拉宁改为利奈唑胺
10 mg/kg,qd。住院22~25天体温趋于正常,精神不振,出现皮肤黄染,巩膜黄染,肝脏增大,肋下约5cm。血ALT75U/L,AST115 U/L,TBIL93μmol/L,IBIL50μmol/L,CRP及PCT升高。骨髓培养,白色念珠菌阳性。抗感染将替考拉宁改为利奈唑胺 ,加用伏立康唑
,加用伏立康唑 抗真菌及保肝药物治疗。住院26~33天,黄疸
抗真菌及保肝药物治疗。住院26~33天,黄疸 减轻,间断发热,每日1~2次,热峰38.5℃,哺乳60~80 ml/次,排便略稀;肝大,肋下约4~5cm,泌尿系彩超:双肾正常。监测体温、尿量和液体入量见表1。
减轻,间断发热,每日1~2次,热峰38.5℃,哺乳60~80 ml/次,排便略稀;肝大,肋下约4~5cm,泌尿系彩超:双肾正常。监测体温、尿量和液体入量见表1。
出院诊断及依据,(1)X-连锁慢性肉芽肿病。依据:反复细菌真菌感染,中性粒细胞呼吸爆发试验阳性,高通量测序提示X-连锁慢性肉芽肿病(X-CGD)。(2)脓毒症(细菌:沙门氏菌属、溶血链球菌,病毒:汉坦病毒,真菌:白色念珠菌多重感染),多重感染和器官功能障碍。依据儿童脓毒性休克 (感染性休克)诊治专家共识(2015版)[9]。(3)流行性出血热。依据:病程中有血尿
(感染性休克)诊治专家共识(2015版)[9]。(3)流行性出血热。依据:病程中有血尿 ,少尿和多尿表现;出血热病毒特异性抗体阳性。(4)感染性腹泻。依据:入院时腹泻,便培养沙门氏菌阳性。(5)贫血。依据:血色素89g/L。
,少尿和多尿表现;出血热病毒特异性抗体阳性。(4)感染性腹泻。依据:入院时腹泻,便培养沙门氏菌阳性。(5)贫血。依据:血色素89g/L。
后续治疗及随访:继续美罗培南、伏立康唑抗感染及保肝药物治疗;营养及支持治疗;基因检测报告和呼吸爆发试验结果明确为X-CGD,告知家长需行造血干细胞移植。电话随访,目前患儿感染基本控制。已经准备造血干细胞移植。
2 讨论
20世纪50年代,美国明尼苏达州一名12个月大的儿童首次被诊为慢性肉芽肿(CGD)[10]。CGD发病率,美国大约为20万分之一[11],欧洲和亚洲估计为每10万活产1.5例[12],我国目前无相关数据。
X-连锁慢性肉芽肿病(X-linkedchronicgranulomatousdisease,X-CGD)是一种罕见的原发性免疫缺陷综合征,是由Xp21.1上编码NADPH氧化酶的gp91phox蛋白亚基的CYBB基因突变,导致还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH又称还原型辅酶Ⅱ)氧化酶缺陷,吞噬细胞在吞噬异物或受刺激活化时,短时间内不能产生超氧化物,即“呼吸暴发”抑制,严重损伤吞噬细胞杀伤微生物的能力,导致细菌和霉菌易感[13-14]。
X-CGD起病多在6个月以内,部分新生儿期发病,其临床特征为:①一般男孩发病;②反复发生严重感染(各部位脓肿,肺炎,肠炎等),肝脾肿大,贫血,腹泻;③感染病原:细菌(包括结核感染)、真菌;④细胞及体液免疫均正常;⑤CYBB基因突变;⑥中性粒细胞氧化功能明显降低。
国内李淑娟等报道的12例X-CGD患者,平均起病年龄4.08月,平均诊断年龄2岁[15];Winkelstein等报道的259例X-CGD患者,多数起病年龄在6个月内,平均诊断年龄3.01岁[16];本例患者3.5月发病,6.5月明确诊断,诊断年龄明显早于上述报道病例的平均年龄。确诊年龄早,得益于对特殊复杂病例进行全外显子基因测序分析。
该病发病率为1/250000~1/200000[17],按照我国每年人口出生数量进行推算,新发现病例应远超报道数量,说明多数该病患者未被及时诊断,而仅仅诊断为感染性疾病。分析其中原因:基层医院及一些三甲医院,中性粒细胞功能系列检测非检验科常规检测项目;而基因检测为医保自费项目,费用高昂,尚未在临床广泛开展。导致该病诊断年龄偏晚,诊断率低。建议临床对反复多重感染的患儿开展中性粒细胞功能检查。广东报道4例新生儿CGD。根据患儿临床表现,考虑可能存在免疫性疾病。立即完善呼吸暴发试验,发现中性粒细胞无明显活化表现,经基因检测明确诊断CGD[18]。
CYBB基因突变导致粒细胞呼吸暴发抑制是患者易感染细菌、真菌的主要原因。本例患者先后感染金黄色葡萄球菌、沙门氏菌属、溶血葡萄球菌、白色念珠菌,与朱莹莹报道[19]8例CGD患儿感染病原相似。患儿血清出血热病毒特异性抗体阳性,病初临床无颜面皮肤潮红、血小板减少、肉眼血尿等少尿期期出血热典型表现,入院诊断疑似流行性出血热,住院1周后患儿出现尿量增多,超过6 ml/kg/h,最多达25ml/kg/h,尿比重低,双肾增大,临床确诊流行性出血热。该病病原为汉坦病毒。啮齿类动物(鼠类等)为主要宿主动物和传染源,经呼吸道、消化道均可传播,人群普遍易感。儿童病例轻症较多,临床往往分期不清,可由发热期直接进入多尿期[21]。多尿期的治疗主要是补充液体和电解质,维持内环境平衡,防止因脱水和电解质紊乱而出现肾功能衰竭[20]。本例X-CGD患儿同时感染细菌、病毒和真菌,出现细菌、病毒和真菌多重感染脓毒症。目前未见X-CGD患儿伴发流行性出血热的报道。
目前,国际数据库已注册超过300个CYBB突变,CYBB基因是X-CGD最常见的变异基因,CYBB基因突变引起X-CGD占所有CGD患者的65%[21],依据报道核苷酸突变可为:IVS5+1G>A剪切位点突变,c.742-743Ains移码突变,c.801del T无义突变等;本患儿突变点为c.1314+1G>T,受检者母亲携带CYBB:c.1314+1G>T杂合突变;属于剪切位点突变;供体和受体剪接位点变异通常导致蛋白质功能丧失;该位点突变在正常人群数据库gnom AD、千人数据库和Ex AC数据库中均没有被收录,为罕见突变。截止目前,未有文献报道在患者中发现该突变;结合受检者临床表现,依据美国ACMG指南,判定该突变为致病突变[PVS1、PM2、PP4]。该患者的CYBB基因突变类型为剪接位点突变;剪接位点变异通常导致蛋白质功能丧失,影响中性粒细胞呼吸暴发功能。该病例的基因突变使已知的变异类型更加丰富。
参考文献略。
来源:王亚莉,单立业,刘振伟,等.并发多重感染脓毒症的X-连锁慢性肉芽肿病1例诊治体会[J].中国实验诊断学,2024,28(12):1432-1435.
