
APTT纠正试验温育后不延长的获得性血友病A1例
作者:邓爽,甘芳宴,方靖舒,宁乐平等,广西医学科学院,广西壮族自治区人民医院检验科
获得性血友病A(Acquired hemophilia A,AHA)是一种罕见的出血性疾病 ,其发病机制为机体存在针对凝血因子Ⅷ(FactorⅧ,FⅢ)的抑制性自身抗体,导致凝血功能障碍。据统计,AHA的发生率约为1.5/100万[1] 。由于该病罕见,临床对其认识不足,易延误诊断,甚至导致患者死亡。活化部分凝血活酶时间
,其发病机制为机体存在针对凝血因子Ⅷ(FactorⅧ,FⅢ)的抑制性自身抗体,导致凝血功能障碍。据统计,AHA的发生率约为1.5/100万[1] 。由于该病罕见,临床对其认识不足,易延误诊断,甚至导致患者死亡。活化部分凝血活酶时间 (activated partial thromboplastin time,APTT)纠正试验是筛查FⅢ抑制物的常用方法。FⅢ抑制物具有时间和温度依赖性,温育后延长的APTT纠正试验提示FⅢ抑制物的存在。目前,国内外报道的AHA病例大多为APTT纠正试验温育后延长的典型表现。然而,本院收治了一例APTT纠正试验温育后不延长的AHA患者,现报道如下。
(activated partial thromboplastin time,APTT)纠正试验是筛查FⅢ抑制物的常用方法。FⅢ抑制物具有时间和温度依赖性,温育后延长的APTT纠正试验提示FⅢ抑制物的存在。目前,国内外报道的AHA病例大多为APTT纠正试验温育后延长的典型表现。然而,本院收治了一例APTT纠正试验温育后不延长的AHA患者,现报道如下。
1病历资料
患者女,27岁,因“反复皮肤瘀斑6月余”至我院血液内科就诊。患者自述6个月来反复出现皮肤瘀斑,可自行消退,无牙龈及鼻出血,无月经量增多。既往有类风湿性关节炎 (rheumatoid arthritis,RA)病史,未使用抗凝药物。体格检查发现上肢有陈旧性瘀斑。
(rheumatoid arthritis,RA)病史,未使用抗凝药物。体格检查发现上肢有陈旧性瘀斑。
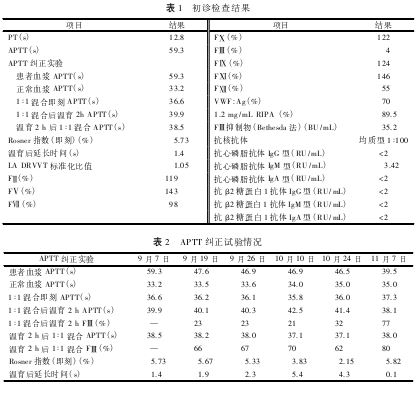
血液学检查显示APTT单独延长,APTT纠正试验即刻可纠正且温育后无明显延长。为明确病因,进一步完善凝血因子、因子抑制物、狼疮抗凝物(Lupus anticoagulant,LA)及抗磷脂抗体 等检测。LA和抗磷脂抗体检测结果阴性(表1)。凝血因子检测中仅FⅢ明显降低(表1),提示FⅢ缺乏可能。
等检测。LA和抗磷脂抗体检测结果阴性(表1)。凝血因子检测中仅FⅢ明显降低(表1),提示FⅢ缺乏可能。
鉴于患者为女性且出血为近期新发,先天性血友病A(hemophilia A,HA)可能性不大。血管性血友病 因子(von Willebrand factor,vWF)和瑞斯托霉素诱导血小板聚集(Ristocetin-induced platelet agglutination,RIPA)检测结果正常(表1),不支持血管性血友病(von Willebrand disease,vWD)和获得性vWD综合征(acquired vWD syndrome,AVWS)的诊断。FⅢ抑制物检测为35.2 BU/m L(表1),提示AHA的可能性。然而,患者APTT纠正试验温育后不延长(表1),与AHA纠正试验温育后延长的典型特点不相符。在第2次就诊时复查APTT纠正试验及FⅢ抑制物(表2),结果与初诊时一致。
因子(von Willebrand factor,vWF)和瑞斯托霉素诱导血小板聚集(Ristocetin-induced platelet agglutination,RIPA)检测结果正常(表1),不支持血管性血友病(von Willebrand disease,vWD)和获得性vWD综合征(acquired vWD syndrome,AVWS)的诊断。FⅢ抑制物检测为35.2 BU/m L(表1),提示AHA的可能性。然而,患者APTT纠正试验温育后不延长(表1),与AHA纠正试验温育后延长的典型特点不相符。在第2次就诊时复查APTT纠正试验及FⅢ抑制物(表2),结果与初诊时一致。
综合分析,患者既往无出血史及家族出血史,近期突发自发性皮下出血,合并不明原因的APTT单独延长,FⅢ活性明显降低,且连续2次FⅢ抑制物检测均为阳性,最终诊断为AHA。经醋酸泼尼松 和环磷酰胺
和环磷酰胺 治疗9周后,患者病情好转,皮下出血消失,APTT恢复正常,FⅢ活性升至41%,FⅢ抑制物降至<0.6 BU/m L。
治疗9周后,患者病情好转,皮下出血消失,APTT恢复正常,FⅢ活性升至41%,FⅢ抑制物降至<0.6 BU/m L。
2实验室检查与结果
2.1外院检查结果抗CCP抗体阳性,类风湿因子 (RF)30 IU/m L。
(RF)30 IU/m L。
2.2初诊时检查结果见表1。
2.3 APTT纠正试验情况如表2所示,9月7日、9月19日和9月26日,APTT纠正试验温育后延长均不超过3 s,与FⅢ抑制物纠正试验的典型特点不相符。分别对温育后混合的血浆及混合后温育的血浆进行FⅢ活性检测,FⅢ活性降低程度均超过60%,符合FⅢ抑制物具有时间和温度依赖性抑制作用的特点。10月10日起,APTT纠正试验温育后延长超过3 s,表现为常见的FⅢ抑制物纠正试验特点。
2.4 APTT、FⅢ活性及抑制物水平的变化情况如表3所示,FⅢ抑制物水平与FⅢ活性无明显相关性。在FⅢ抑制物检测中,当剩余因子活性接近50%时,其不随抑制物的稀释倍数增大而升高。

3讨论
本例患者为育龄期女性,以新发的自发性皮下出血为首发症状,考虑其AHA可能与RA相关。针对FⅢ的自身抗体多见于全身性自身免疫病,其中与RA相关的FⅢ抑制物通常为高滴度[1] 。
Oleshko等[2] 的研究发现,64%的AHA患者可检测到抗核抗体,78%的患者至少有一个额外的自身免疫标志物阳性。本例患者FⅢ抑制物滴度高,抗核抗体和抗CCP抗体阳性,与既往报道[2] 一致。
AHA的诊断基于临床表现和实验室检查。超过95%的患者在诊断时有出血症状,少数患者仅表现为APTT单独延长而无出血表现[3-4] 。APTT单独延长并非AHA的特异性表现,还需考虑存在内源性凝血因子、激肽释放酶原(PK)/高分子量激肽原(HWMK)、vWF缺乏,或存在抑制物(如因子抗体、LA或抗凝药物)等情况。鉴于大多数AHA患者发病年龄较大,可能正在接受抗凝治疗,因此排除抗凝药物的影响至关重要。对于APTT单独延长的疑似AHA患者,首先应进行APTT纠正试验筛查FⅢ抑制物,随后检测凝血因子、vWF、LA和FⅢ抑制物来明确诊断[5-7] 。典型的AHA实验室检查结果表现为:APTT单独延长,APTT纠正试验温育2 h后延长(>3 s),FⅢ活性降低(50%的病例FⅢ活性<1%,75%的病例<5%,所有病例均<40%),并可检测到FⅢ抑制物[8-9] 。抑制物滴度中位数约为8~20 BU/m L,少数病例抑制物滴度极低或极高[10-11 ] 。Tiede等[8] 报道AHA患者诊断时APTT为41.9~123.5 s,抑制物滴度为0.7~972 BU/m L。
本例患者就诊初期APTT纠正试验温育后未见延长,不提示存在FⅢ抑制物。但温育后FⅢ活性降低程度超过60%,提示存在针对FⅢ的时间和温度依赖性抑制物。随着治疗的进展,温育后APTT逐渐延长,最终超过3 s。这提示在疾病的初始治疗阶段,可能存在其他影响APTT检测结果的因素,导致FⅢ活性的降低在APTT变化上没有得到准确的反映。因此,APTT纠正试验只能作为初步的筛查试验,温育后APTT不延长并不能完全排除FⅢ抑制物的可能性,必要时仍需进行FⅢ抑制物的检测。APTT纠正试验不能100%区分凝血因子缺乏和抑制物,明确诊断还需结合相应的确认试验进行综合分析[12] 。APTT纠正试验不能单独用来确定或排除AHA的诊断,还需同时检测FⅢ、FⅢ抑制物和LA[7] 。
凝血因子检测中单独FⅢ降低除提示AHA外,还需与先天性血友病A(HA)、vWD和AVWS相鉴别[13] 。vWD和AVWS也可表现为出血和FⅢ降低,但其vWF相关检测异常,且APTT纠正试验和Bethesda法FⅢ抑制物检测均阴性[7-8] 。此外,还应注意与LA相鉴别。LA可不同程度延长APTT,导致基于APTT的FⅢ活性检测假性降低,也可致基于Bethesda法的FⅢ抑制物检测假阳性。采用ELISA法检测FⅢ及FⅢ抑制物可避免LA的干扰[8] 。临床表现及APTT纠正试验的结果有助于与LA相鉴别。本例患者为女性,vWF相关指标及血小板黏附功能正常,LA阴性,APTT纠正试验可立即纠正,可排除先天性HA、VWD、AVWS及LA。
本例患者FⅢ抑制物表现为2型非线性动力学特点,即存在快速失活阶段和随后较慢的平衡阶段,抑制物滴度与FⅢ活性无线性关系。在平衡阶段,抑制物不能完全抑制FⅢ,即使存在高滴度抑制物,仍可检测到残留的FⅢ活性。
既往报道约70%的AHA患者经皮质类固醇治疗后可在5~11周内获得完全缓解,低滴度抑制物患者偶有自发缓解的报道[13] 。本例患者经治疗后APTT恢复正常,FⅢ活性升高,FⅢ抑制物转阴,提示免疫抑制治疗有效,抑制物清除时间为9周。
综上所述,APTT纠正试验作为FⅢ抑制物的筛查试验操作简便,对设备要求低,可指导后续凝血因子和抑制物检测的选择。但APTT可受多种因素影响,APTT纠正试验只能作为初步筛查,不能单独用于排除AHA。对于高度怀疑AHA的病例,即使APTT纠正试验不提示存在FⅢ抑制物,仍应进行FⅢ抑制物等相关检测以明确诊断。
参考文献略。
来源:临床检验杂志2025年2月第43卷第2期
