
疑似子宫腺肌症实为肺癌子宫转移1例并文献复习
作者:任远,邓姗等,中国医学科学院北京协和医学院北京协和医院妇产科学系,妇科内分泌与生殖中心,国家妇产疾病临床医学研究中心
病例资料
患者朱某,女性,42岁,G2P1,因“发现肺癌4年,月经紊乱3年,不规则阴道出血5月”。于2024年5月至北京协和医院住院治疗。
既往月经规律,5d/28d,经量中等,偶有痛经。患者2019年8月于北京协和医院呼吸科确诊左肺支气管腺癌IVA期(双肺、纵隔淋巴结及心包受累,未见横膈以下转移),现口服甲磺酸奥希替尼 。2021年5月无明显诱因出现月经紊乱,周期2~3月,经期10~30d,经量如常,间断口服地屈孕酮
。2021年5月无明显诱因出现月经紊乱,周期2~3月,经期10~30d,经量如常,间断口服地屈孕酮 治疗,用药期间月经大致正常。2023年12月无明显诱因出现不规则阴道出血,自觉量多,每天需更换5片卫生巾,查血红蛋白
治疗,用药期间月经大致正常。2023年12月无明显诱因出现不规则阴道出血,自觉量多,每天需更换5片卫生巾,查血红蛋白 84g/L。2024年1月24日就诊北京协和医院妇科内分泌门诊,液基薄层细胞检测(TCT)、人乳头瘤病毒(HPV)检测未见异常,予醋酸甲地孕酮
84g/L。2024年1月24日就诊北京协和医院妇科内分泌门诊,液基薄层细胞检测(TCT)、人乳头瘤病毒(HPV)检测未见异常,予醋酸甲地孕酮 80 mg每日一次口服,服药期间出血较前减少。2024年2月27日超声检查提示子宫11.1cm×8.4cm×8.4cm,内膜厚约0.3cm,子宫肌层回声欠均;予促性腺激素释放激素激动剂(Gn RH-a)注射3针(末次用药2024年4月24日),用药期间始终有阴道少量出血。2024年4月24日门诊再次查体:宫颈外观呈花斑样改变,质地坚硬,前穹窿消失,子宫增大如孕10周。复查TCT、HPV均为阴性。复查超声:子宫9.5cm×8.5cm×7.6cm,内膜厚约0.4cm,子宫肌层回声欠均;右卵巢多发囊实性占位,较大者5.2cm×3.5cm,内见团块状中等回声0.5cm×0.4cm。2024年5月8日盆腔常规+增强磁共振成像
80 mg每日一次口服,服药期间出血较前减少。2024年2月27日超声检查提示子宫11.1cm×8.4cm×8.4cm,内膜厚约0.3cm,子宫肌层回声欠均;予促性腺激素释放激素激动剂(Gn RH-a)注射3针(末次用药2024年4月24日),用药期间始终有阴道少量出血。2024年4月24日门诊再次查体:宫颈外观呈花斑样改变,质地坚硬,前穹窿消失,子宫增大如孕10周。复查TCT、HPV均为阴性。复查超声:子宫9.5cm×8.5cm×7.6cm,内膜厚约0.4cm,子宫肌层回声欠均;右卵巢多发囊实性占位,较大者5.2cm×3.5cm,内见团块状中等回声0.5cm×0.4cm。2024年5月8日盆腔常规+增强磁共振成像 (MRI):子宫肌层增厚,较厚处3.7cm,增强扫描见不均匀强化,腺肌症可能;子宫内膜增厚,结合带边界欠清;右侧附件区多发混杂异常信号,较大者4.6cm×3.9cm,可见液平面,增强扫描未见明显强化,子宫内膜异位囊肿(巧囊)可能;盆腔积液,内见小片状出血信号,局部深部内膜异位症待除外(图1)。门诊建议行全子宫双附件切除术,患者因上呼吸道感染推迟手术。
(MRI):子宫肌层增厚,较厚处3.7cm,增强扫描见不均匀强化,腺肌症可能;子宫内膜增厚,结合带边界欠清;右侧附件区多发混杂异常信号,较大者4.6cm×3.9cm,可见液平面,增强扫描未见明显强化,子宫内膜异位囊肿(巧囊)可能;盆腔积液,内见小片状出血信号,局部深部内膜异位症待除外(图1)。门诊建议行全子宫双附件切除术,患者因上呼吸道感染推迟手术。
2024年5月27日(距离Gn RH-a末次注射33d)再次出现大量阴道出血,查血红蛋白66g/L,5月28日急诊入院。予输血 纠正贫血
纠正贫血 ,复查血红蛋白83g/L。于2024年5月30日行腹腔镜
,复查血红蛋白83g/L。于2024年5月30日行腹腔镜 探查,术中见子宫、双侧附件、肠管表面、盆壁腹膜散在白色斑块改变(图2);子宫增大如孕10周;双侧输卵管亦增粗、质硬;右侧卵巢增大约6cm×5cm,表面光滑,色苍白,部分实性质硬,部分囊性;左侧卵巢外观未见明显异常。术中切除子宫、右侧附件、及左侧输卵管。剖视标本:子宫切面灰粉、实性、质韧、编织状,宫腔及宫颈管内未见明显占位;右侧卵巢切面囊实性,囊壁光滑,厚0.1~0.3cm,囊液清亮;双侧输卵管质硬。
探查,术中见子宫、双侧附件、肠管表面、盆壁腹膜散在白色斑块改变(图2);子宫增大如孕10周;双侧输卵管亦增粗、质硬;右侧卵巢增大约6cm×5cm,表面光滑,色苍白,部分实性质硬,部分囊性;左侧卵巢外观未见明显异常。术中切除子宫、右侧附件、及左侧输卵管。剖视标本:子宫切面灰粉、实性、质韧、编织状,宫腔及宫颈管内未见明显占位;右侧卵巢切面囊实性,囊壁光滑,厚0.1~0.3cm,囊液清亮;双侧输卵管质硬。
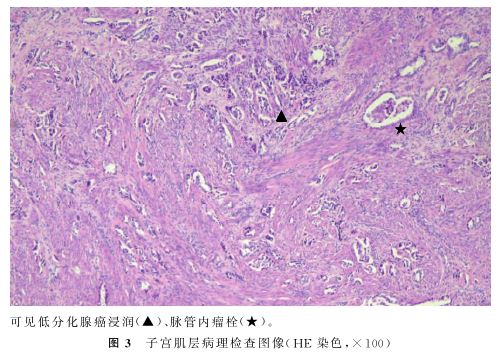
病理诊断:子宫及宫颈壁全层、(左侧、右侧)输卵管、(右)卵巢见低分化腺癌浸润,可见脉管内瘤栓(图3)。免疫组化染色结果:PD-L1(+)、TPS<1%(二者表示表达PD-L1的肿瘤细胞占比低于1%),CK7(+)、NapsinA(+)、TTF-1(+)、
CK20(+)、Ber-EP4(+)、PAX-8(-)。其中CK7、CK20、Ber-EP4染色阳性提示上皮细胞来源,NapsinA、TTF-1是肺腺癌特异性标记物,PAX-8阳性见于肾癌、甲状腺癌及Mullerian管来源癌。
结合病史、组织病理及免疫组化,符合肺腺癌转移。
术后4周复查癌胚抗原(CEA)较术前显著下降(8.5ng/mlvs.16.1ng/ml),目前肿瘤内科随诊中。
肺癌治疗经过:2019年8月于北京协和医院呼吸科确诊左肺支气管腺癌,c T4N3M1a,IVA期。肿瘤组织基因检测提示:EGFRp.L858R、p.L62R突变(EGFR表皮生长因子受体)。患者于2019年9月开始接受EGFR一线靶向治疗盐酸埃克替尼 12个月,服药期间CEA缓慢上升。因肿瘤位于右肺尖,血供丰富,穿刺活检风险较高,于2020年6月行血浆循环肿瘤DNA(ct DNA)检测,仍提示EGFRp.L858R突变及p.L62R突变,未检出EGFR耐药突变。2020年8月17日患者自愿口服二线EGFR靶向药物甲磺酸奥希替尼,无进展生存期(PFS)2个月。2020年10月21日胸部CT评估肺部病灶较前增大,CEA水平升高,尝试三线治疗(盐酸埃克替尼口服联合贝伐珠单抗
12个月,服药期间CEA缓慢上升。因肿瘤位于右肺尖,血供丰富,穿刺活检风险较高,于2020年6月行血浆循环肿瘤DNA(ct DNA)检测,仍提示EGFRp.L858R突变及p.L62R突变,未检出EGFR耐药突变。2020年8月17日患者自愿口服二线EGFR靶向药物甲磺酸奥希替尼,无进展生存期(PFS)2个月。2020年10月21日胸部CT评估肺部病灶较前增大,CEA水平升高,尝试三线治疗(盐酸埃克替尼口服联合贝伐珠单抗 ),PFS28个月。2022年9月复查CT,病灶较前增大(3.2cm→3.7cm),考虑缓慢进展,再次行ct DNA检测仍提示EGFRp.L858R突变。2023年1月复查CT评估肺部病灶较前增大,右肺门新见转移淋巴结,CEA水平再次升高,患者自行口服甲磺酸奥希替尼,同时接受外照射治疗,复查CEA较前下降。
),PFS28个月。2022年9月复查CT,病灶较前增大(3.2cm→3.7cm),考虑缓慢进展,再次行ct DNA检测仍提示EGFRp.L858R突变。2023年1月复查CT评估肺部病灶较前增大,右肺门新见转移淋巴结,CEA水平再次升高,患者自行口服甲磺酸奥希替尼,同时接受外照射治疗,复查CEA较前下降。

病例讨论
支气管肺癌是女性第四大常见癌症,但往往被认为与女性的生殖系统关联不大,其常见症状包括咳嗽 、咯血
、咯血 、呼吸困难
、呼吸困难 、胸痛
、胸痛 、体重减轻等。世界卫生组织(WHO)根据其生物学、治疗和预后将肺癌分为2大类:非小细胞肺癌(NSCLC)与小细胞肺癌(SCLC),其中NSCLC更为常见[1]。随着肺癌早期筛查的普及、放射治疗的进步,以及靶向治疗及免疫治疗的出现,NSCLC患者生存率得到显著改善,但仍然是全球癌症相关死亡的第二大原因[2]。约50%~60%的患者就诊时已出现远处转移,最常见的转移部位为区域淋巴结、肝脏、肾上腺、骨骼和大脑,女性生殖系统转移少见,主要为腺癌[3]。
、体重减轻等。世界卫生组织(WHO)根据其生物学、治疗和预后将肺癌分为2大类:非小细胞肺癌(NSCLC)与小细胞肺癌(SCLC),其中NSCLC更为常见[1]。随着肺癌早期筛查的普及、放射治疗的进步,以及靶向治疗及免疫治疗的出现,NSCLC患者生存率得到显著改善,但仍然是全球癌症相关死亡的第二大原因[2]。约50%~60%的患者就诊时已出现远处转移,最常见的转移部位为区域淋巴结、肝脏、肾上腺、骨骼和大脑,女性生殖系统转移少见,主要为腺癌[3]。
本例患者以难治性异常子宫出血伴子宫肥厚增大为主要表现,一直考虑为子宫腺肌症,虽诊治过程中存在不符合一般规律的现象,但在明确诊断为肺癌子宫卵巢转移前都还不明就里。反过来也顿悟,由于患者的子宫病变并非腺肌症,所以对Gn RH-a无明显反应,而宫颈也被肿瘤所侵犯,因此外观和质地都异于寻常。通过本病例,我们复习了NSCLC女性生殖系统转移的相关文献,以便了解其临床特点,提高临床认识,优化诊疗策略。
一、肺癌的生殖系统转移
NSCLC占肺癌病例的80%以上,主要分为鳞状细胞癌和非鳞状细胞癌,后者包括腺癌、大细胞癌等亚型,其中腺癌最为常见,约占NSCLC的85%,并且在无吸烟史人群中尤为突出[4-5]。NSCLC女性生殖系统转移较为罕见,主要以腺癌为主,卵巢转移发生率最高,其次是子宫肌层、子宫内膜和宫颈[6-7]。
1.卵巢转移:卵巢转移性恶性肿瘤约占5%至20%,以胃肠道(63%)或乳腺(7%)来源的恶性肿瘤转移(Krukenberg瘤)较为常见,常见于中青年女性,多具有腹痛、腹胀、消化道出血 或乳腺肿块等原发部位症状。影像学检查可发现双侧卵巢占位,实验室检查可有血清CEA、CA19-9、CA724、CA15-3等肿瘤标记物升高;显微镜下肿瘤通常由分泌大量黏液的印戒细胞组成,伴间质显著增生;免疫组化染色中胃肠道来源的Krukenberg瘤通常表达CK20、CDX2等标记,而CK7阳性率较低[8]。肺癌卵巢转移约占所有卵巢转移肿瘤的2%~4%,患者平均年龄为46岁[7],且随着女性肺癌发病率的上升,这一比例正在增加。肺癌卵巢转移通常无明显临床症状,多在影像学检查中意外发现。病理检查
或乳腺肿块等原发部位症状。影像学检查可发现双侧卵巢占位,实验室检查可有血清CEA、CA19-9、CA724、CA15-3等肿瘤标记物升高;显微镜下肿瘤通常由分泌大量黏液的印戒细胞组成,伴间质显著增生;免疫组化染色中胃肠道来源的Krukenberg瘤通常表达CK20、CDX2等标记,而CK7阳性率较低[8]。肺癌卵巢转移约占所有卵巢转移肿瘤的2%~4%,患者平均年龄为46岁[7],且随着女性肺癌发病率的上升,这一比例正在增加。肺癌卵巢转移通常无明显临床症状,多在影像学检查中意外发现。病理检查 是鉴别原发性和转移性卵巢恶性肿瘤的主要方法,但肺癌卵巢转移的组织学形态多变,易与卵巢上皮肿瘤混淆,需依赖免疫组织化学染色(IHC)进行鉴别。甲状腺转录蛋白-1(TTF-1)是一种核转录蛋白,在肺泡上皮细胞和甲状腺上皮细胞中高表达,是IHC中用于明确腺癌原发部位的重要标志物[9]。NapsinA是一种天冬氨酸蛋白酶,在正常Ⅱ型肺泡上皮细胞和80%以上的肺腺癌中表达,是TTF1染色的重要补充,联合使用可提高诊断准确率[10-11]。本例患者两项均为阳性表达。
是鉴别原发性和转移性卵巢恶性肿瘤的主要方法,但肺癌卵巢转移的组织学形态多变,易与卵巢上皮肿瘤混淆,需依赖免疫组织化学染色(IHC)进行鉴别。甲状腺转录蛋白-1(TTF-1)是一种核转录蛋白,在肺泡上皮细胞和甲状腺上皮细胞中高表达,是IHC中用于明确腺癌原发部位的重要标志物[9]。NapsinA是一种天冬氨酸蛋白酶,在正常Ⅱ型肺泡上皮细胞和80%以上的肺腺癌中表达,是TTF1染色的重要补充,联合使用可提高诊断准确率[10-11]。本例患者两项均为阳性表达。
2.子宫转移:肺癌子宫转移多见于子宫肌层,通常伴有腹痛和异常子宫出血。Kumar等[12]总结了63例盆腔外原发恶性肿瘤转移至子宫的病例,其中4.8%源于肺部且92%为肺腺癌,主要累及子宫肌层,多伴有卵巢转移。肺癌转移至子宫内膜更为罕见,其病理学特征与原发性子宫内膜癌 相似[13-15]。如前所述,TTF-1是区分肺腺癌与其他部位腺癌的特异性标志物,此外,接近90%的肺腺癌CK7染色阳性(+)、CK20染色阴性(-),原发性子宫内膜癌则相反[16]。因此,TTF-1(+)、NapsinA(+)、CK7(+)、CK20(-)、雌激素
相似[13-15]。如前所述,TTF-1是区分肺腺癌与其他部位腺癌的特异性标志物,此外,接近90%的肺腺癌CK7染色阳性(+)、CK20染色阴性(-),原发性子宫内膜癌则相反[16]。因此,TTF-1(+)、NapsinA(+)、CK7(+)、CK20(-)、雌激素 受体ER(-)和孕激素
受体ER(-)和孕激素 受体PR(-)高度提示原发性肺腺癌[17]。此外,EGFR突变在子宫内膜癌中少见,若检测到该突变,提示转移性子宫内膜癌可能[18]。
受体PR(-)高度提示原发性肺腺癌[17]。此外,EGFR突变在子宫内膜癌中少见,若检测到该突变,提示转移性子宫内膜癌可能[18]。
3.宫颈转移:子宫颈体积小,结构致密且血供较差,肿瘤组织难以穿透和生长,因此肺癌宫颈转移极为罕见,仅有少数个案报道。患者具有类似宫颈原发恶性肿瘤的典型症状,即接触性出血与宫颈占位[19-20]。在已确诊肺腺癌的患者中,如宫颈病变活检显示腺癌特征、TTF-1等肺腺癌特异性标记物染色阳性时,需考虑肺癌宫颈转移的可能性。本例患者的宫颈外观曾给术者深刻印象,宫颈外口形态虽正常,但质地坚硬,表面可见花斑,感觉来者不善,但又不似典型的宫颈癌 形似菜花且有异味,TCT和HPV均无异常表现也在情理之中。
形似菜花且有异味,TCT和HPV均无异常表现也在情理之中。
二、肺癌驱动突变
肿瘤驱动突变的发现推动了肺腺癌靶向治疗的发展,可以显著延长晚期/转移性NSCLC的无进展生存期。约60%~70%的转移性NSCLC患者携带驱动突变,其中以EGFR突变最为常见[21]。EGFR突变主要见于无吸烟史的亚洲女性肺腺癌患者,是NSCLC的一个重要分子亚型,其最常见的突变类型为19号外显子缺失(EGFRexon19del)和21号外显子L858R点突变(EGFRp.L858R)[22-23]。EGFR突变的NSCLC可能更具有侵袭性,携带不同EGFR突变的NSCLC倾向于发生不同部位的转移:EGFRexon19del与肺癌脑转移更相关,EGFRp.L858R与肝转移更相关[24-25]。有文献报道6名携带EGFR突变且发生子宫转移的肺腺癌患者,均为亚洲女性,3例携带EGFRp.L858R突变,3例携带EGFRexon19del突变[26]。
除EGFR突变外,间变性淋巴瘤激酶蛋白(ALK)编码基因重排导致的异常信号传导也参与肺腺癌的发生和转移。ALK是胰岛素 受体超家族的酪氨酸激酶受体,最常见的融合伴侣是棘皮动物微管相关蛋白样4(EML4),EML4-ALK融合基因存在于4%~5%的NSCLC病例中,年轻时发病是该类患者的一个显著特征,女性生殖系统转移亦有文献报道[27-29]。有研究显示,与ALK野生型及EGFR突变NSCLC相比,发生ALK重排的NSCLC转移发生率与转移部位数量显著增加,ALK重排阳性的肺癌患者对ALK靶向治疗高度敏感,其客观缓解率为50%~61%[30]。在伴有ALK重排的NSCLC卵巢转移患者中,使用ALK靶向治疗也可获得长期无进展生存[31]。本例患者不涉及ALK重排。
受体超家族的酪氨酸激酶受体,最常见的融合伴侣是棘皮动物微管相关蛋白样4(EML4),EML4-ALK融合基因存在于4%~5%的NSCLC病例中,年轻时发病是该类患者的一个显著特征,女性生殖系统转移亦有文献报道[27-29]。有研究显示,与ALK野生型及EGFR突变NSCLC相比,发生ALK重排的NSCLC转移发生率与转移部位数量显著增加,ALK重排阳性的肺癌患者对ALK靶向治疗高度敏感,其客观缓解率为50%~61%[30]。在伴有ALK重排的NSCLC卵巢转移患者中,使用ALK靶向治疗也可获得长期无进展生存[31]。本例患者不涉及ALK重排。
三、EGFR-TKI靶向治疗
对外科手术的影响EGFR酪氨酸酶抑制剂(EGFR-TKI)是目前EGFR突变NSCLC患者的标准治疗方案。EGFR-TKI耐受性良好,药物相关毒性包括腹泻 、痤疮样皮疹
、痤疮样皮疹 、口腔粘膜炎、甲沟炎、肝损害等,严重不良反应较为罕见[32]。作为EGFR抑制剂,EGFR-TKI可能具有潜在的抑制血管生成和组织愈合的作用,因此其对手术患者的影响更受外科医师的关注。
、口腔粘膜炎、甲沟炎、肝损害等,严重不良反应较为罕见[32]。作为EGFR抑制剂,EGFR-TKI可能具有潜在的抑制血管生成和组织愈合的作用,因此其对手术患者的影响更受外科医师的关注。
目前上市的EGFR-TKI包括厄洛替尼 、吉非替尼
、吉非替尼 、埃克替尼(第一代)、阿法替尼
、埃克替尼(第一代)、阿法替尼 、达克替尼(第二代)、奥希替尼(第三代)等药物。迄今为止,EGFR-TKI相关的组织愈合不良或围手术期出血事件少见[33],仅有少数个案报道提示厄洛替尼/吉非替尼与角膜手术后伤口延迟愈合相关[34-36]。此外,厄洛替尼可增加患者消化道穿孔风险,特别是在患者同时使用抗血管生成药物、皮质类固醇或非甾体类抗炎药,以及既往有消化性溃疡
、达克替尼(第二代)、奥希替尼(第三代)等药物。迄今为止,EGFR-TKI相关的组织愈合不良或围手术期出血事件少见[33],仅有少数个案报道提示厄洛替尼/吉非替尼与角膜手术后伤口延迟愈合相关[34-36]。此外,厄洛替尼可增加患者消化道穿孔风险,特别是在患者同时使用抗血管生成药物、皮质类固醇或非甾体类抗炎药,以及既往有消化性溃疡 或憩室病史时,穿孔风险进一步增加;厄洛替尼还可能与围手术期静脉血栓事件相关[33]。但目前对于围手术期是否应停用EGFR-TKI尚无临床共识,一般认为,相当于5个半衰期的停药间隔可将药物完全自体内消除。前述常见EGFR-TKI中埃克替尼血浆半衰期最短(约为6h),而达克替尼血浆半衰期最长(约为70h),因此建议停药时间最长可达2周。如何平衡围手术期风险与停药导致的原发疾病进展是外科医生需要面对的挑战,因此,亟需开展针对EGFR-TKI手术患者的病例登记研究,通过积累此类患者的围手术期结局资料,为EGFR-TKI围手术期使用的临床决策提供有价值的参考。
或憩室病史时,穿孔风险进一步增加;厄洛替尼还可能与围手术期静脉血栓事件相关[33]。但目前对于围手术期是否应停用EGFR-TKI尚无临床共识,一般认为,相当于5个半衰期的停药间隔可将药物完全自体内消除。前述常见EGFR-TKI中埃克替尼血浆半衰期最短(约为6h),而达克替尼血浆半衰期最长(约为70h),因此建议停药时间最长可达2周。如何平衡围手术期风险与停药导致的原发疾病进展是外科医生需要面对的挑战,因此,亟需开展针对EGFR-TKI手术患者的病例登记研究,通过积累此类患者的围手术期结局资料,为EGFR-TKI围手术期使用的临床决策提供有价值的参考。
本例手术过程极其困难,子宫大且组织弹性差,历时时间长,所幸患者术后恢复平顺,未发生出血、血栓、消化道穿孔、或伤口愈合不良等并发症。待病理提示真相,后知后觉,更感庆幸。
综上所述,本文通过1例原发性肺腺癌伴女性生殖系统转移的病例,拓展了对肺癌与生殖系统关联的认知,以及靶向药物对外科手术的潜在影响,学习了围术期相关的管理策略。随着肿瘤治疗的进步,肿瘤患者的生存期显著延长,合并其他系统疾病以及需要相关手术治疗的可能性随之增加,医生需要不断扩展知识、技能涉及面以应对新的形势和挑战。
来源:生殖医学杂志2025年3月第34卷第3期
