
以宫腔积液为首发症状的早期子宫颈胃型腺癌1例
作者:王乐靖,王 志,杜 丹,刘立红等,华中科技大学同济医学院附属武汉中心医院
1 病例报告
患者,82岁,因宫腔积液引流术后1+月,阴道流液3d于2023年2月27日入我院。1月前,患者因腹胀入胃肠外科诊治,妇科彩超检查示:子宫明显增大,宫底平脐,宫底体、宫腔明显扩张分离,宫腔内呈液性暗区(16.2cm×10.0cm×14.1cm),子宫内膜萎缩,双侧附件区未见明显异常,诊断为宫腔积液。后转入妇科,子宫颈液基细胞学检查(TCT)及人乳头瘤病毒(HPV)检查未见异常,肿瘤标志物 检查结果(2023年1月28日):糖类抗原199(CA199)152U/ml。在我院行宫腔积液引流及宫腔分段诊刮术,术后病理检查
检查结果(2023年1月28日):糖类抗原199(CA199)152U/ml。在我院行宫腔积液引流及宫腔分段诊刮术,术后病理检查 未见异常。3d前出现阴道流液,色淡黄,无明显阴道流血,伴腹胀。门诊子宫附件彩超检查示:子宫明显增大,宫底平脐,宫底体宫腔明显扩张分离,内呈液性暗区(15.9cm×10.1cm×13.0cm),宫腔无回声,子宫内膜未见增厚,子宫颈萎缩,双侧附件未见明显异常。考虑宫腔积液,收入院。G3P3,绝经
未见异常。3d前出现阴道流液,色淡黄,无明显阴道流血,伴腹胀。门诊子宫附件彩超检查示:子宫明显增大,宫底平脐,宫底体宫腔明显扩张分离,内呈液性暗区(15.9cm×10.1cm×13.0cm),宫腔无回声,子宫内膜未见增厚,子宫颈萎缩,双侧附件未见明显异常。考虑宫腔积液,收入院。G3P3,绝经 30+年。入院后查体:神志清楚,R、P平稳,BP165/76mmHg,心肺检查未见明显异常。妇科查体:外阴发育正常,阴道通畅,阴道内少许淡黄色分泌物;子宫颈萎缩,颈口闭合,子宫颈未见其他异常;宫体明显增大,双侧附件区未扪及明显异常。入院后行腹盆腔电子计算机断层扫描(CT)检查示:宫腔明显扩大,其内见大量水样低密度影(136mm×130mm×165mm),子宫颈体积增大,密度欠均匀;双侧附件未见明显异常,腹腔及腹膜后未见肿大淋巴结。盆腔磁共振成像
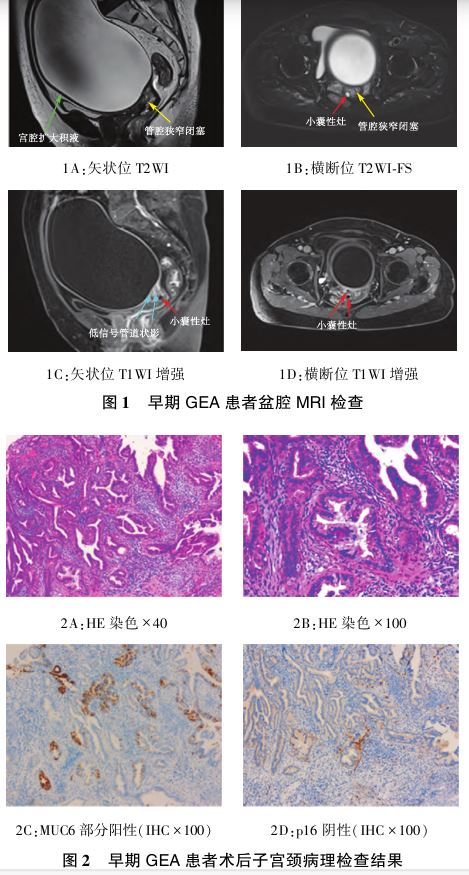
30+年。入院后查体:神志清楚,R、P平稳,BP165/76mmHg,心肺检查未见明显异常。妇科查体:外阴发育正常,阴道通畅,阴道内少许淡黄色分泌物;子宫颈萎缩,颈口闭合,子宫颈未见其他异常;宫体明显增大,双侧附件区未扪及明显异常。入院后行腹盆腔电子计算机断层扫描(CT)检查示:宫腔明显扩大,其内见大量水样低密度影(136mm×130mm×165mm),子宫颈体积增大,密度欠均匀;双侧附件未见明显异常,腹腔及腹膜后未见肿大淋巴结。盆腔磁共振成像 (MRI)检查示:宫腔扩大,见大量T1WI低信号T2WI高信号影(148mm×115mm×151mm),子宫肌层厚度约3mm,子宫颈中上段可见绕管腔环形分布T2WI稍高信号影,信号欠均匀,其边缘可见小囊状T2WI高信号影,子宫颈管腔狭窄闭塞(图1B黄色箭头所示);病灶呈不均匀强化,其内可见小囊状T1WI低信号无强化影(图1C、1D红色箭头所示),多条T1WI低信号管道状影与宫腔相通(图1C蓝色箭头所示);子宫颈T2WI信号欠均匀,阴道内见T1WI低信号T2WI高信号积液信号影,见图1。肿瘤标志物检查结果(2月27日):CA199236.97U/ml,人附睾蛋白4(HE4)99.90pmol/L,其他指标未见异常。术前诊断:宫腔积液,原因待查。
(MRI)检查示:宫腔扩大,见大量T1WI低信号T2WI高信号影(148mm×115mm×151mm),子宫肌层厚度约3mm,子宫颈中上段可见绕管腔环形分布T2WI稍高信号影,信号欠均匀,其边缘可见小囊状T2WI高信号影,子宫颈管腔狭窄闭塞(图1B黄色箭头所示);病灶呈不均匀强化,其内可见小囊状T1WI低信号无强化影(图1C、1D红色箭头所示),多条T1WI低信号管道状影与宫腔相通(图1C蓝色箭头所示);子宫颈T2WI信号欠均匀,阴道内见T1WI低信号T2WI高信号积液信号影,见图1。肿瘤标志物检查结果(2月27日):CA199236.97U/ml,人附睾蛋白4(HE4)99.90pmol/L,其他指标未见异常。术前诊断:宫腔积液,原因待查。
入院后行腹腔镜 探查术,术中见子宫增大如孕5月大小,饱满,其内可见清亮液体约900 ml。 宫腔液体排出后见子宫体凹陷失去正常形态,子宫极软,子宫肌层菲薄,子宫颈光滑,宫腔及子宫颈内未见新生物。 考虑患者年龄较大,且前期经保守治疗无效,不排除子宫恶性肿瘤可能性,患者及家属知情同意,行腹腔镜下全子宫切除术,剖视子宫:大小12 cm×9 cm×3 cm,子宫壁厚约0.7 cm,宫腔高度扩张,内壁尚光滑,子宫颈萎缩。 术后病理检查回报:子宫颈非HPV相关型原位胃型腺癌伴局灶可疑早期浸润,肿瘤细胞胞质丰富,透明或嗜酸性,可见核分裂象,癌细胞向上累及子宫内膜表面,未见明显神经及脉管侵犯;子宫壁菲薄,双侧输卵管慢性炎。 见图2。 免疫组化检查:P53(野生型),MUC6(部分 +),CK20(局灶 +),ER(-),p16(-),Ki67LI 热点区35%。 见图2。 术后诊断:早期子宫颈胃型腺癌(GEA)。 后行辅助放疗,采取容积弧形调强放疗(VMAT), 45Gy/25F/1. 8Gy。 随访至2024 年9 月11 日,未见复发征象。
探查术,术中见子宫增大如孕5月大小,饱满,其内可见清亮液体约900 ml。 宫腔液体排出后见子宫体凹陷失去正常形态,子宫极软,子宫肌层菲薄,子宫颈光滑,宫腔及子宫颈内未见新生物。 考虑患者年龄较大,且前期经保守治疗无效,不排除子宫恶性肿瘤可能性,患者及家属知情同意,行腹腔镜下全子宫切除术,剖视子宫:大小12 cm×9 cm×3 cm,子宫壁厚约0.7 cm,宫腔高度扩张,内壁尚光滑,子宫颈萎缩。 术后病理检查回报:子宫颈非HPV相关型原位胃型腺癌伴局灶可疑早期浸润,肿瘤细胞胞质丰富,透明或嗜酸性,可见核分裂象,癌细胞向上累及子宫内膜表面,未见明显神经及脉管侵犯;子宫壁菲薄,双侧输卵管慢性炎。 见图2。 免疫组化检查:P53(野生型),MUC6(部分 +),CK20(局灶 +),ER(-),p16(-),Ki67LI 热点区35%。 见图2。 术后诊断:早期子宫颈胃型腺癌(GEA)。 后行辅助放疗,采取容积弧形调强放疗(VMAT), 45Gy/25F/1. 8Gy。 随访至2024 年9 月11 日,未见复发征象。
2 讨 论
HPV 感染是导致子宫颈癌 的重要危险因素,但是存在部分子宫颈腺癌与HPV感染无关[1]。 随着HPV疫苗和子宫颈癌筛查的普及,HPV相关型子宫颈癌发生率势必会大幅度降低[2],非 HPV 相关型子宫颈癌的比例会逐渐升高。 GEA为非HPV 相关型子宫颈癌中最常见的类型[3],其发病率占所有子宫颈腺癌发病率的10%[1],仅次于非特异性子宫颈腺癌(UEA)。 与 UEA 相比,GEA 更容易出现脉管侵犯及远处转移,其复发率更高,约40%(UEA仅14.6%)[4],5 年生存率更低,为42%(UEA 为91%)[5]。 此外,与其他类型子宫颈腺癌相比,其临床表现更为隐匿及不典型,且单纯宫腔积液作为早期GEA的首发症状较为罕见,这增加了该病的早期诊断难度,易造成延误诊断甚至漏诊,所以此类病例必须引起临床医生和病理医生的高度重视。
的重要危险因素,但是存在部分子宫颈腺癌与HPV感染无关[1]。 随着HPV疫苗和子宫颈癌筛查的普及,HPV相关型子宫颈癌发生率势必会大幅度降低[2],非 HPV 相关型子宫颈癌的比例会逐渐升高。 GEA为非HPV 相关型子宫颈癌中最常见的类型[3],其发病率占所有子宫颈腺癌发病率的10%[1],仅次于非特异性子宫颈腺癌(UEA)。 与 UEA 相比,GEA 更容易出现脉管侵犯及远处转移,其复发率更高,约40%(UEA仅14.6%)[4],5 年生存率更低,为42%(UEA 为91%)[5]。 此外,与其他类型子宫颈腺癌相比,其临床表现更为隐匿及不典型,且单纯宫腔积液作为早期GEA的首发症状较为罕见,这增加了该病的早期诊断难度,易造成延误诊断甚至漏诊,所以此类病例必须引起临床医生和病理医生的高度重视。
2. 1 GEA的诊断 早期子宫颈癌规范化诊断的“三阶梯”程序为子宫颈脱落细胞学检查和(或)HPV检测、阴道镜检查 和子宫颈活组织检查。 HPV相关型子宫颈癌经过此程序能得到明确诊断,而GEA患者HPV检测为阴性且常缺乏子宫颈接触性出血这一典型症状,往往只表现为阴道流液或白带增多,导致患者转诊行阴道镜检查和子宫颈活检
和子宫颈活组织检查。 HPV相关型子宫颈癌经过此程序能得到明确诊断,而GEA患者HPV检测为阴性且常缺乏子宫颈接触性出血这一典型症状,往往只表现为阴道流液或白带增多,导致患者转诊行阴道镜检查和子宫颈活检 的概率较低。 此外, GEA 病灶多隐匿于子宫颈管内部,子宫颈外观多呈光滑肥大,形成桶状改变,很少见外生型菜花状肿物,即使行子宫颈活检也常因为无法满意取材导致GEA漏诊。 本病例TCT检查
的概率较低。 此外, GEA 病灶多隐匿于子宫颈管内部,子宫颈外观多呈光滑肥大,形成桶状改变,很少见外生型菜花状肿物,即使行子宫颈活检也常因为无法满意取材导致GEA漏诊。 本病例TCT检查 和HPV 检测未见异常,妇科查体示子宫颈萎缩,因此未行子宫颈活检。由于GEA子宫颈活检确诊率低,影像学检查对于提高术前诊断率尤为重要。 GEA超声检查可表现为子宫颈体积增大、蜂窝状囊性回声且血流信号增多,容易与子宫颈纳氏囊肿混淆,子宫颈纳氏囊肿超声检查表现为子宫颈前后唇内单发或多发的圆形、类圆形无回声结节,并且彩超检测多无血流信号。GEA 的MRI典型征象为“宇宙征”,即病变中央为小囊肿或实性成分,周围被较大的囊肿包围,此征象亦可用于GEA和子宫颈纳氏囊肿鉴别诊断[6]。 本病例盆腔MRI检查
和HPV 检测未见异常,妇科查体示子宫颈萎缩,因此未行子宫颈活检。由于GEA子宫颈活检确诊率低,影像学检查对于提高术前诊断率尤为重要。 GEA超声检查可表现为子宫颈体积增大、蜂窝状囊性回声且血流信号增多,容易与子宫颈纳氏囊肿混淆,子宫颈纳氏囊肿超声检查表现为子宫颈前后唇内单发或多发的圆形、类圆形无回声结节,并且彩超检测多无血流信号。GEA 的MRI典型征象为“宇宙征”,即病变中央为小囊肿或实性成分,周围被较大的囊肿包围,此征象亦可用于GEA和子宫颈纳氏囊肿鉴别诊断[6]。 本病例盆腔MRI检查 显示宫腔扩大积液,子宫颈信号欠均匀,未见典型的“宇宙征”。 对于血清学标志物,约有超过50%的GEA存在CA199的升高[7],本病例CA199指标(236 U/ml)与首次入院时(152 U/ml)相比有升高。GEA 的确诊依赖组织病理学检查,参照Kojima等[8]提出的3条标准:①黏液性胞质丰富;②透明或淡嗜酸性胞质;③细胞边界清晰。 专家共识表示联合使用MUC6、HIK1083、TFF2、Claudin-18、p16、p53、ER、PR、CDX2、CK20、PAX8 等免疫组化指标有助于GEA的诊断[9]。 其中MUC6是胃黏液标志物,一项荟萃分析表明MUC6区分GEA和非GEA子宫颈腺癌的特异性度为0.74,敏感度为0.51[10]。 另外一种胃黏蛋白 HIK1083与MUC6相比具有更高的特异度(0.94)和敏感度(0.64)[10]。p16 在GEA中一般呈阴性或局灶阳性,提示HPV感染阴性。本病例术后病理检查报原位GEA并伴可疑浸润,累及子宫内膜,免疫组化显示MUC6(部分 +),p16(-),ER(-),符合GEA 免疫组化特征。
显示宫腔扩大积液,子宫颈信号欠均匀,未见典型的“宇宙征”。 对于血清学标志物,约有超过50%的GEA存在CA199的升高[7],本病例CA199指标(236 U/ml)与首次入院时(152 U/ml)相比有升高。GEA 的确诊依赖组织病理学检查,参照Kojima等[8]提出的3条标准:①黏液性胞质丰富;②透明或淡嗜酸性胞质;③细胞边界清晰。 专家共识表示联合使用MUC6、HIK1083、TFF2、Claudin-18、p16、p53、ER、PR、CDX2、CK20、PAX8 等免疫组化指标有助于GEA的诊断[9]。 其中MUC6是胃黏液标志物,一项荟萃分析表明MUC6区分GEA和非GEA子宫颈腺癌的特异性度为0.74,敏感度为0.51[10]。 另外一种胃黏蛋白 HIK1083与MUC6相比具有更高的特异度(0.94)和敏感度(0.64)[10]。p16 在GEA中一般呈阴性或局灶阳性,提示HPV感染阴性。本病例术后病理检查报原位GEA并伴可疑浸润,累及子宫内膜,免疫组化显示MUC6(部分 +),p16(-),ER(-),符合GEA 免疫组化特征。
2. 2 GEA和绝经后宫腔积液 病理性宫腔积液的常见病因有生殖道畸形、子宫恶性病变如子宫颈癌和子宫内膜癌 等。GEA 是具有胃型分化的黏液性腺癌,腺体增生可深入子宫颈间质,形成囊腔与宫腔相通。 腺体分泌功能亢进,产生大量无色无味水样或黏液样分泌物,因子宫颈病变阻塞子宫颈管,宫腔内液体难以排出导致宫腔积液。 虽然绝经后的妇女由于雌激素
等。GEA 是具有胃型分化的黏液性腺癌,腺体增生可深入子宫颈间质,形成囊腔与宫腔相通。 腺体分泌功能亢进,产生大量无色无味水样或黏液样分泌物,因子宫颈病变阻塞子宫颈管,宫腔内液体难以排出导致宫腔积液。 虽然绝经后的妇女由于雌激素 水平下降、子宫颈萎缩、子宫颈管狭窄而容易出现宫腔积液,但是本病例有别于单纯子宫颈管萎缩导致的宫腔积液,表现为在进行宫腔引流术4周后再次迅速出现大量宫腔积液,致子宫增大如孕5月大小。 推测大量宫腔积液与GEA黏液分泌亢进及子宫颈萎缩致液体排出不畅有关。 此外宫腔分段诊刮未见明显异常,排除了子宫内膜癌的可能。尽管本病例出现了大量宫腔积液,但是由于其仅为原位癌伴可疑浸润,导致影像学检查及分段诊刮均未发现GEA诊断证据,待子宫全切术后病理检查方诊断为GEA。 鉴于此,对于绝经后长期阴道流液或者伴有宫腔积液的女性,不能仅依靠HPV 检测阴性和子宫颈活检阴性以及分段诊刮阴性就排除子宫颈癌,必要时应行宫腔镜
水平下降、子宫颈萎缩、子宫颈管狭窄而容易出现宫腔积液,但是本病例有别于单纯子宫颈管萎缩导致的宫腔积液,表现为在进行宫腔引流术4周后再次迅速出现大量宫腔积液,致子宫增大如孕5月大小。 推测大量宫腔积液与GEA黏液分泌亢进及子宫颈萎缩致液体排出不畅有关。 此外宫腔分段诊刮未见明显异常,排除了子宫内膜癌的可能。尽管本病例出现了大量宫腔积液,但是由于其仅为原位癌伴可疑浸润,导致影像学检查及分段诊刮均未发现GEA诊断证据,待子宫全切术后病理检查方诊断为GEA。 鉴于此,对于绝经后长期阴道流液或者伴有宫腔积液的女性,不能仅依靠HPV 检测阴性和子宫颈活检阴性以及分段诊刮阴性就排除子宫颈癌,必要时应行宫腔镜 下检查,甚至子宫颈锥切明确诊断,减少漏诊、误诊。综上所述,GEA作为一种特殊类型的子宫颈腺癌,具有高危型HPV阴性、症状体征不特异、以阴道流液为主,或伴有盆腔包块、术前诊断率低等特点。 本病例报道提示对于绝经多年后出现大量宫腔积液且HPV阴性患者,影像学检查及子宫颈活检或者分段诊刮未见特异性改变,接诊医生应警惕GEA的可能。 为保证取材充分,可行宫腔镜下子宫颈管组织活检或者子宫颈锥切,提高GEA术前诊断率。
下检查,甚至子宫颈锥切明确诊断,减少漏诊、误诊。综上所述,GEA作为一种特殊类型的子宫颈腺癌,具有高危型HPV阴性、症状体征不特异、以阴道流液为主,或伴有盆腔包块、术前诊断率低等特点。 本病例报道提示对于绝经多年后出现大量宫腔积液且HPV阴性患者,影像学检查及子宫颈活检或者分段诊刮未见特异性改变,接诊医生应警惕GEA的可能。 为保证取材充分,可行宫腔镜下子宫颈管组织活检或者子宫颈锥切,提高GEA术前诊断率。
参考文献略。
来源:王乐靖,王志,杜丹,等.以宫腔积液为首发症状的早期子宫颈胃型腺癌1例[J].实用妇产科杂志,2025,41(03):263-264.
