
MOG-IgG阳性:多发性硬化诊断中的“隐藏陷阱”?| 病例探究
一名46岁男性,因进行性单眼视力 丧失伴疼痛及左腿感觉异常就诊。检查结果显示其存在多灶性脱髓鞘病变和脑脊液寡克隆区带。患者最初被诊断为多发性硬化
丧失伴疼痛及左腿感觉异常就诊。检查结果显示其存在多灶性脱髓鞘病变和脑脊液寡克隆区带。患者最初被诊断为多发性硬化 (MS),但后续检查发现髓鞘少突胶质细胞糖蛋白lgG(MOG-1gG)阳性,引发了关于诊断准确性和治疗策略的深刻思考。该病例来自美国多发性硬化协会病例会议纪要,本文探讨了MOG-lqG阳性在MS患者中的意义及临床考量。
(MS),但后续检查发现髓鞘少突胶质细胞糖蛋白lgG(MOG-1gG)阳性,引发了关于诊断准确性和治疗策略的深刻思考。该病例来自美国多发性硬化协会病例会议纪要,本文探讨了MOG-lqG阳性在MS患者中的意义及临床考量。
病例报告
一名46岁白人男性,左侧视力进行性下降持续两周,伴有眼球运动疼痛、头痛 和畏光。患者进一步报告左下肢远端(LLE)出现数周的环状麻木和刺痛。患者无肠道或膀胱功能障碍,否认躯干有任何感觉症状。否认既往有任何创伤、手术、疫苗接种或感染史。患者此前从未发生过类似事件。患者病史以高血压
和畏光。患者进一步报告左下肢远端(LLE)出现数周的环状麻木和刺痛。患者无肠道或膀胱功能障碍,否认躯干有任何感觉症状。否认既往有任何创伤、手术、疫苗接种或感染史。患者此前从未发生过类似事件。患者病史以高血压 、高脂血症
、高脂血症 和烟草使用障碍
和烟草使用障碍 为主,且无自身免疫性疾病的个人或家族史。
为主,且无自身免疫性疾病的个人或家族史。
患者全身检查未见异常,生命体征、心肺和皮肤检查均正常。眼科检查 发现左眼视力(VA)较差,仅能在3英尺(约3米)处数手指,右眼高对比度视力正常。眼底检查
发现左眼视力(VA)较差,仅能在3英尺(约3米)处数手指,右眼高对比度视力正常。眼底检查 时患者还感到疼痛,左眼有传入性瞳孔缺损,但眼底镜检查未发现视神经乳头水肿
时患者还感到疼痛,左眼有传入性瞳孔缺损,但眼底镜检查未发现视神经乳头水肿 或苍白征象,血管显示正常。神经系统检查
或苍白征象,血管显示正常。神经系统检查 发现:双侧膝腱反射对称性活跃(3+),伴有交叉内收肌反射,左大脚趾振动觉中度减弱,其他颅神经(除视神经外)、运动、协调和步态评估均正常。
发现:双侧膝腱反射对称性活跃(3+),伴有交叉内收肌反射,左大脚趾振动觉中度减弱,其他颅神经(除视神经外)、运动、协调和步态评估均正常。
患者被收入住院神经内科接受进一步诊断评估和治疗。眼眶MRI显示左侧视神经眶内段T2信号异常并伴有对比增强,视神经鞘受累,符合视神经炎/神经束膜炎(图1)。脑部MRI显示T2/FLAIR高信号的脑室周围和皮质下白质病变,部分病变有对比增强(图2)。颈椎和胸椎MRI也显示多处符合活动性脱髓鞘(图3和4)。实验室检查包括代谢组、全血细胞计数 、炎症标志物(红细胞沉降率和C反应蛋白)以及莱姆抗体检测,均未发现异常。住院期间OCT显示双侧视网膜神经纤维层厚度正常(右眼84µm,左眼86µm),但左眼神经节细胞内丛状层轻度变薄(71µm),而右眼为75µm。
、炎症标志物(红细胞沉降率和C反应蛋白)以及莱姆抗体检测,均未发现异常。住院期间OCT显示双侧视网膜神经纤维层厚度正常(右眼84µm,左眼86µm),但左眼神经节细胞内丛状层轻度变薄(71µm),而右眼为75µm。
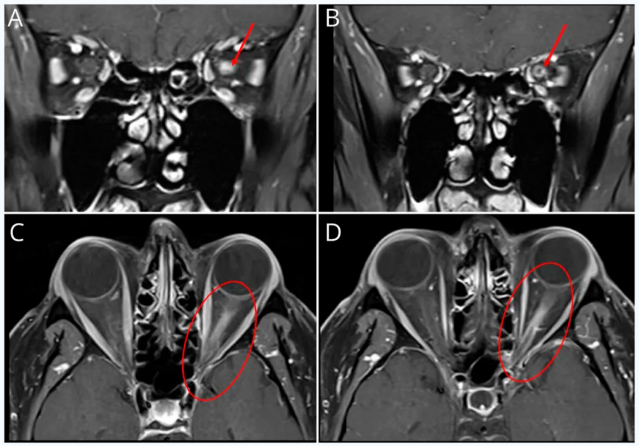
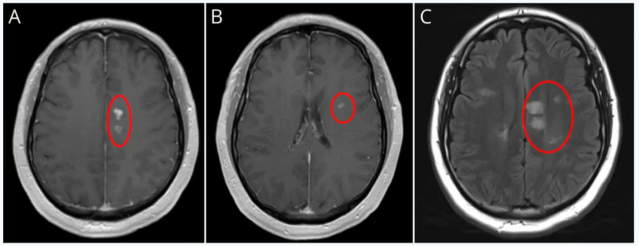
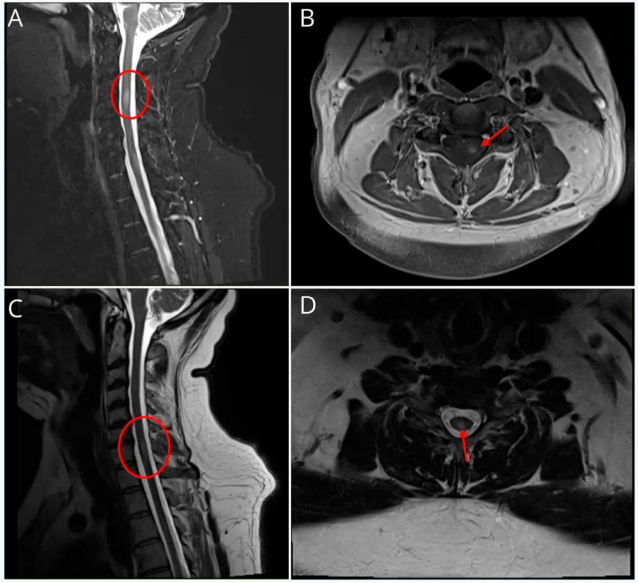
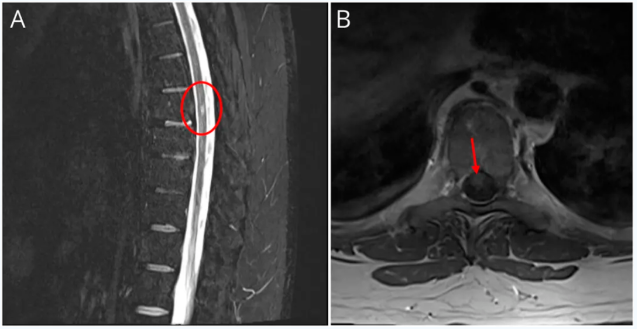
图:影像学检查
初诊及治疗随访
根据2017年McDonald标准,他通过脊髓和脑室周围病变的空间分布以及脑和脊髓中同时存在活动性和慢性病变的时间分布,被诊断为多发性硬化(MS)。腰椎穿刺被推迟,出院前仍有几项实验室检查结果待定。患者接受了5天的静脉注射甲基强的松龙治疗,视力指数改善至20/50(高对比度),出院后计划在MS中心接受治疗。出院后,血清髓鞘少突胶质细胞糖蛋白-免疫球蛋白G(MOG-IgG)(活细胞检测)结果为阳性,阳性滴度为1:100。水通道蛋白4(AQP-4)抗体检测为阴性。
在2周后的随访中,患者报告左脚持续麻木(较之前左下肢远端受累有所改善)。左眼视力从初次就诊时的视力指数显著提高到20/25。然而,由于某些临床和影像学特征以及MOG-IgG阳性,患者对MS的既定诊断受到质疑。建议进行额外的实验室检查和腰椎穿刺以进一步评估。
血清学检查包括甲状腺功能、维生素B12 、甲基丙二酸、铜、铜蓝蛋白
、甲基丙二酸、铜、铜蓝蛋白 和锌,结果均在正常范围内,抗核抗体为阴性。腰椎穿刺后细胞计数、蛋白质、葡萄糖
和锌,结果均在正常范围内,抗核抗体为阴性。腰椎穿刺后细胞计数、蛋白质、葡萄糖 和IgG指数正常,但有证据表明存在2型脑脊液寡克隆区带(OCB)。
和IgG指数正常,但有证据表明存在2型脑脊液寡克隆区带(OCB)。
仔细考量现有数据后,医生确定患者诊断为多发性硬化(MS),而非MOG抗体相关疾病(MOGAD)。诊断依据包括患者的整体临床表现和OCB阳性。医生建议患者开始接受疾病修饰疗法(DMT),但患者拒绝接受。
一年后,患者再次就诊,出现亚急性眩晕 、步态不稳和热敏感。检查显示轻度眼外肌功能障碍(引发眩晕症状),并伴有串联步态障碍。复查MRI显示右侧延髓出现新的增强病变。患者接受了另一疗程的甲基强的松龙治疗,并同意开始长期免疫治疗。复查抗MOG IgG抗体滴度检测结果仍为1:100。随访OCT显示左眼视网膜神经纤维层(62 µm)和神经节细胞内丛状层(55 µm)严重变薄。
、步态不稳和热敏感。检查显示轻度眼外肌功能障碍(引发眩晕症状),并伴有串联步态障碍。复查MRI显示右侧延髓出现新的增强病变。患者接受了另一疗程的甲基强的松龙治疗,并同意开始长期免疫治疗。复查抗MOG IgG抗体滴度检测结果仍为1:100。随访OCT显示左眼视网膜神经纤维层(62 µm)和神经节细胞内丛状层(55 µm)严重变薄。
鉴别诊断考虑
对于该病例,可以考虑将复发型多发性硬化(RMS)和MOG抗体相关疾病(MOGAD)作为两大主要鉴别诊断。患者表现为多灶性炎症活动、脑和脊髓慢性活动性脱髓鞘病变、脑脊液寡克隆带,这些都支持RMS的诊断。然而,一些不典型于MS的特征包括视神经炎(ON)导致的严重视力丧失、广泛的视神经强化和神经周围受累、对类固醇强烈而显著的反应,以及存在明确阳性滴度(≥1:100)的MOG-IgG,所有这些特征都可能提示MOGAD的诊断。
MRI检查结果显示颅内病变数量少且边界不清,也支持MOGAD的诊断,尽管短节段脊髓病变更倾向于RMS。虽然在该特例中未观察到,但中央静脉征的存在也会更强烈地提示MS而非MOGAD的诊断。此外,与RMS相比,MOGAD引起的视神经炎更常见严重的视神经变薄,这可以通过光学相干断层扫描观察到。
视神经脊髓炎 谱系障碍(NMOSD)是另一种以视神经炎和脊髓损伤
谱系障碍(NMOSD)是另一种以视神经炎和脊髓损伤 为特征的神经炎症性疾病。本例患者AQP-4抗体检测阴性,排除了AQP-4抗体相关的NMOSD。虽然可以考虑血清阴性的NMOSD,但由于本例患者存在整体临床放射学综合征且MOG-IgG持续阳性,因此排除了血清阴性NMOSD。
为特征的神经炎症性疾病。本例患者AQP-4抗体检测阴性,排除了AQP-4抗体相关的NMOSD。虽然可以考虑血清阴性的NMOSD,但由于本例患者存在整体临床放射学综合征且MOG-IgG持续阳性,因此排除了血清阴性NMOSD。
应考虑可能引起视神经炎和脊髓损伤的感染性疾病,例如支原体、梅毒 、水痘带状疱疹病毒
、水痘带状疱疹病毒 、HIV、人类T淋巴细胞病毒(HTLV)或其他感染性疾病,应根据临床表现进行相应的检测和排查。也可考虑感染后/副感染性症状,例如病毒性疾病后的急性播散性脑脊髓炎
、HIV、人类T淋巴细胞病毒(HTLV)或其他感染性疾病,应根据临床表现进行相应的检测和排查。也可考虑感染后/副感染性症状,例如病毒性疾病后的急性播散性脑脊髓炎 。患者否认任何先前或相关的感染症状,且缺乏其他提示这些诊断的发现。
。患者否认任何先前或相关的感染症状,且缺乏其他提示这些诊断的发现。
其他炎症或风湿性疾病,例如结节病 、白塞氏病和血管炎
、白塞氏病和血管炎 ,与实体瘤或淋巴瘤
,与实体瘤或淋巴瘤 相关的肿瘤病变,也可在鉴别诊断中应考虑。鉴于缺乏相关表现,认为这些疾病在本例中发生的概率较低。
相关的肿瘤病变,也可在鉴别诊断中应考虑。鉴于缺乏相关表现,认为这些疾病在本例中发生的概率较低。
最终诊断和治疗方案
鉴于患者符合McDonald标准、脑脊液寡克隆区带阳性、缺乏前部视神经受累以及存在颅内和短节段脊髓征象,其表现被认为更符合RMS而非MOGAD。患者开始接受B细胞耗竭治疗。首次就诊两年后的随访显示,自开始B细胞耗竭治疗以来,患者总体情况稳定,无复发或新病变形成的证据。
讨论
随着对MS相关疾病和类似疾病的认识不断增加,在确诊MS之前通常会进行广泛的血清学检测,以确保“没有更好的解释”。在这些检测中,通常会进行MOG抗体评估,因为MOGAD看起来与MS相似,但可能需要不同的治疗策略。据报道,MS患者群中MOG-IgG阳性率很低,一项研究指出,仅有0.29%的MS患者MOG抗体检测呈阳性(明确阳性滴度>1:100)。然而,在临床实践中,随着对初次脱髓鞘事件患者进行MOG-IgG抗体检测的增加,这种情况正变得越来越常见。
OCB阳性在MOG-IgG阳性患者中也不常见,但在10%–20%的MOG-IgG阳性患者中可见,有时呈短暂存在。此外,最近的MOGAD诊断共识标准表明,低滴度MOG(定义为基于细胞检测的1:10至<1:100)和OCB阳性是MOGAD的“危险信号”,因为“低滴度”MOG阳性可见于MS和其他疾病。
由于临床诊断的不确定性,MOG-IgG和OCB双重阳性可能构成诊断和治疗难题。虽然目前的诊断标准在大多数情况下更为精确,但并不总是能够准确区分MS病例和MOGAD病例,尤其是在MOG-IgG滴度明显阳性的情况下。此外,人们越来越认识到,MS和MOGAD等中枢神经系统脱髓鞘疾病可能存在重叠特征,这进一步模糊了诊断的确定性。
最近的研究探讨了OCB和MOG-IgG双阳性的潜在临床意义。MOGAD患者的OCB阳性与更高的复发风险相关。据报道,MOG-IgG/OCB双阳性患者的MRI病变负担更重,且更常出现“多灶性”临床表现。鉴于此,本病例中的患者属于MOG/OCB双阳性,其临床表现与最初的多灶性临床表现一致,且在一年内复发。
目前,该领域尚未就如何管理多发性硬化中MOG阳性或MOG/OCB双阳性患者达成明确共识。具有这些表现的患者通常可能由于OCB阳性而被诊断为MS,但由于如上所述的临床病程可能不同,管理考虑也可能会有所不同。根据目前可用的数据,对于MOG-IgG阳性的MS或MOG/OCB双阳性患者,由于复发风险、更高的MRI病变负担和多灶性表现,考虑更高效的治疗可能是明智之举。对于这类患者,医护人员可以考虑使用常用于治疗MS和MOGAD的疗法,例如B细胞耗竭剂。但是,最终决定应始终取决于临床表现以及患者和医护人员之间的共同决策。
参考文献:Elfasi A, Goldman MD, Riley C, Zamvil SS, Newsome SD. "Will the Real Demyelinating Disorder Please Stand Up?": From the National Multiple Sclerosis Society Case Conference Proceedings. Neurol Neuroimmunol Neuroinflamm. 2025 May;12(3):e200380.
