
子宫上皮样滋养细胞肿瘤1例并文献复习
作者:曾雅静,朱秀君,肖静,蔡林儿,广州中医药大学第二临床医学院,广州中医药大学第二附属医院
一、病例资料
患者,女,38岁,因“反复不规则阴道出血半年余”于2020年7月15日至广州中医药大学第二附属医院诊疗。
患者孕4产2,2010年孕6周行无痛人工流产 术,2013年因葡萄胎行清宫(具体情况不详),2014年和2018年各剖宫产一孩。避孕套避孕,无再生育需求。平素月经规律,3~4d/28~32d,量中。2019年10月20日,月经来潮,较既往月经量增多,持续20d未净。2019年11月11日至当地医院就诊,妇科彩超提示子宫前壁低回声结节(大小31mm×29mm),考虑子宫肌瘤
术,2013年因葡萄胎行清宫(具体情况不详),2014年和2018年各剖宫产一孩。避孕套避孕,无再生育需求。平素月经规律,3~4d/28~32d,量中。2019年10月20日,月经来潮,较既往月经量增多,持续20d未净。2019年11月11日至当地医院就诊,妇科彩超提示子宫前壁低回声结节(大小31mm×29mm),考虑子宫肌瘤 ;宫腔少量积液(深7mm)。给予对症止血治疗后,出血量有所减少,间有阴道出血量增多情况。2020年3月和2020年4月再次到当地医院就诊,均考虑子宫肌瘤,给予对症处理后,阴道仍有点滴出血。2020年5月26日,当地医院复查B超:子宫肌瘤(大小55mm×40mm);宫腔内低实性回声团块(大小27mm×18mm),未排除粘膜下肌瘤可能;双附件未见异常。2020年5月29日行诊断性刮宫术,术后病理:(子宫内膜)恶性肿瘤,建议免疫组化协助诊断。遂于2020年6月6日转至当地上级医院,查血清β-HCG6322U/L。腹部磁共振(MR)平扫+增强:子宫及宫颈增大并异常强化,符合恶性肿瘤性病变;肝内小结节,未排转移瘤可能;腹膜后淋巴结未及异常。病理会诊及免疫组化结果:肿瘤细胞CK(+)、Vimentin(-)、CK5/6(-)、P63(+)、CEA(-)、ER(-)、PR(-)、 B-catenin(膜+)、P53(弱+)、MLH1(+)、MSH2(+)、MSH6(+)、PMS2(+)、Ki-67(50%+)、HCG(+)。 结合组织形态、免疫表型及临床病史,符合妊娠滋养细胞肿瘤
;宫腔少量积液(深7mm)。给予对症止血治疗后,出血量有所减少,间有阴道出血量增多情况。2020年3月和2020年4月再次到当地医院就诊,均考虑子宫肌瘤,给予对症处理后,阴道仍有点滴出血。2020年5月26日,当地医院复查B超:子宫肌瘤(大小55mm×40mm);宫腔内低实性回声团块(大小27mm×18mm),未排除粘膜下肌瘤可能;双附件未见异常。2020年5月29日行诊断性刮宫术,术后病理:(子宫内膜)恶性肿瘤,建议免疫组化协助诊断。遂于2020年6月6日转至当地上级医院,查血清β-HCG6322U/L。腹部磁共振(MR)平扫+增强:子宫及宫颈增大并异常强化,符合恶性肿瘤性病变;肝内小结节,未排转移瘤可能;腹膜后淋巴结未及异常。病理会诊及免疫组化结果:肿瘤细胞CK(+)、Vimentin(-)、CK5/6(-)、P63(+)、CEA(-)、ER(-)、PR(-)、 B-catenin(膜+)、P53(弱+)、MLH1(+)、MSH2(+)、MSH6(+)、PMS2(+)、Ki-67(50%+)、HCG(+)。 结合组织形态、免疫表型及临床病史,符合妊娠滋养细胞肿瘤 ,诊断考虑:(1)上皮样滋养细胞肿瘤;(2)绒毛膜癌。当地医院建议患者行化疗。患者因个人原因于2020年7月15日转至我院进一步治疗。
,诊断考虑:(1)上皮样滋养细胞肿瘤;(2)绒毛膜癌。当地医院建议患者行化疗。患者因个人原因于2020年7月15日转至我院进一步治疗。
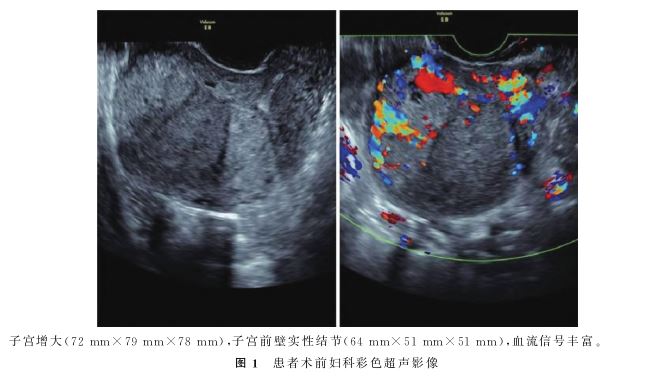
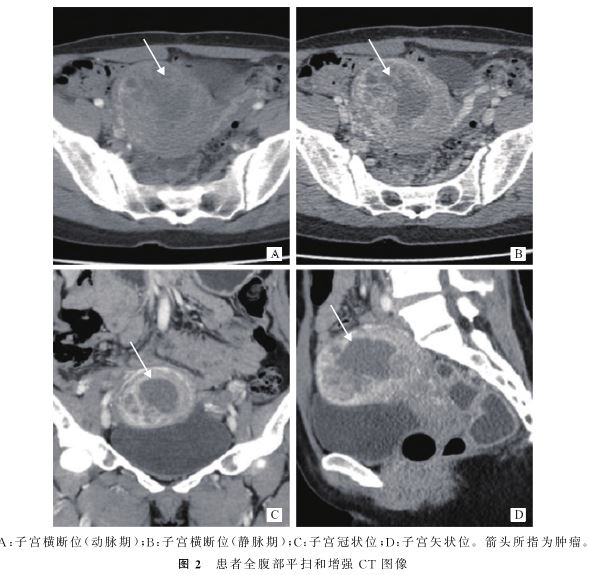
入院时,患者一般情况好,阴道少量出血,无腹痛。妇科检查 :外阴阴道正常,宫颈光滑;子宫增大如孕3月,宫体可触及直径约6cm肿块,质中、无压痛;双附件无异常。术前血β-HCG7823U/L。妇科彩超:子宫增大(72mm×79mm×78mm);子宫前壁实性结节(大小64mm×51mm×51mm),血流信号丰富(图1)。全胸+全腹部计算机断层扫描(CT)平扫+增强:子宫内占位(大小56mm×65mm×60mm)(图2)。结合病史,符合滋养细胞肿瘤诊断;肝S8段低密度灶(直径10mm),考虑肝囊肿
:外阴阴道正常,宫颈光滑;子宫增大如孕3月,宫体可触及直径约6cm肿块,质中、无压痛;双附件无异常。术前血β-HCG7823U/L。妇科彩超:子宫增大(72mm×79mm×78mm);子宫前壁实性结节(大小64mm×51mm×51mm),血流信号丰富(图1)。全胸+全腹部计算机断层扫描(CT)平扫+增强:子宫内占位(大小56mm×65mm×60mm)(图2)。结合病史,符合滋养细胞肿瘤诊断;肝S8段低密度灶(直径10mm),考虑肝囊肿 可能性大;右肺上叶后段小结节(直径6mm),考虑炎性增生结节;腹膜后未见明显肿大淋巴结。病理玻片会诊结果:滋养细胞起源恶性肿瘤,考虑上皮样滋养细胞肿瘤(ETT)可能性大。
可能性大;右肺上叶后段小结节(直径6mm),考虑炎性增生结节;腹膜后未见明显肿大淋巴结。病理玻片会诊结果:滋养细胞起源恶性肿瘤,考虑上皮样滋养细胞肿瘤(ETT)可能性大。
经科内集体讨论,考虑ETT是相对耐药的滋养细胞肿瘤,且目前病灶局限于子宫,患者无再生育意愿,经与患方沟通后,于2020年7月20日行腹腔镜 下全子宫切除术+双侧输卵管切除术。术中见:子宫前壁下段与膀胱致密粘连,子宫增大如孕3月、质软;双侧输卵管卵巢外观形态正常;左侧卵巢动静脉血管明显迂曲增粗;子宫前壁内膜见大小约2cm×1
下全子宫切除术+双侧输卵管切除术。术中见:子宫前壁下段与膀胱致密粘连,子宫增大如孕3月、质软;双侧输卵管卵巢外观形态正常;左侧卵巢动静脉血管明显迂曲增粗;子宫前壁内膜见大小约2cm×1
cm病灶、浸润浅肌层,子宫前壁至宫底部见肿物大小约6cm×7cm,切面色黄(似蛋黄样)、质软;双侧输卵管未见异常(图3)。术后免疫组化:HCG(部分+)、P63(部分弱+)、CK(+)、inhibin-α(个别细胞+)、Ki-67(90%)、PLAP(个别细胞+)、E-Cadherin(+)、CK5/6(-)、h PL(散在个别细胞+)、SALL-4(-)、CD30(-)、P53(80%+)。经病理科内集体讨论,得到以下结果:组织类型为上皮样滋养细胞肿瘤(ETT);病灶局限于宫体,宫颈管、输卵管、宫旁、阴道切缘、脉管均为阴性;肿瘤大于1/2浸润(肌壁厚5.3cm,肿瘤浸润肌层深度4.8cm);存在大片肿瘤坏死;高倍视野下观察到的核分裂象的数量为41个。根据FIGO2000分期为I期,术后予辅助化疗。

术后1周,血β-HCG降至1683U/L,化疗前血β-HCG294U/L。于2020年8月1日开始行甲氨蝶呤 +放线菌素-D/环磷酰胺
+放线菌素-D/环磷酰胺 +依托泊苷
+依托泊苷 +长春新碱
+长春新碱 (EMA-CO)方案化疗。第1天:放线菌素-D(0.5mg每天1次静脉滴注)、依托泊苷(140mg每天1次静脉滴注)、甲氨蝶呤(140mg每天1次静脉推注、280mg每天1次静脉滴注);第2天:放线菌素-D(0.5mg每天1次静脉滴注)、依托泊苷(140mg每天1次静脉滴注)、亚叶酸钠
(EMA-CO)方案化疗。第1天:放线菌素-D(0.5mg每天1次静脉滴注)、依托泊苷(140mg每天1次静脉滴注)、甲氨蝶呤(140mg每天1次静脉推注、280mg每天1次静脉滴注);第2天:放线菌素-D(0.5mg每天1次静脉滴注)、依托泊苷(140mg每天1次静脉滴注)、亚叶酸钠 (15mg/12h,肌肉注射);第8天:长春新碱(2mg每天1次静脉推注)、环磷酰胺(800mg每天1次静脉滴注)。间隔1周后行第2疗程。第2程化疗后血β-HCG降至阴性后继续巩固2程化疗。共行4个疗程的EMA-CO方案化疗,过程顺利,患者未出现严重骨髓抑制或胃肠道反应延迟化疗情况。治疗结束后定期规律随访,至投稿前未出现肿瘤复发征象。
(15mg/12h,肌肉注射);第8天:长春新碱(2mg每天1次静脉推注)、环磷酰胺(800mg每天1次静脉滴注)。间隔1周后行第2疗程。第2程化疗后血β-HCG降至阴性后继续巩固2程化疗。共行4个疗程的EMA-CO方案化疗,过程顺利,患者未出现严重骨髓抑制或胃肠道反应延迟化疗情况。治疗结束后定期规律随访,至投稿前未出现肿瘤复发征象。
二、讨论
上皮样滋养细胞肿瘤(ETT)为罕见的恶性滋养细胞肿瘤(GTN),占整个妊娠滋养细胞疾病的1.39%~2.00%[1],1998年Shih等[2]首次报道该疾病起源于绒毛膜中间滋养叶细胞。据报道ETT平均发病年龄为38.8岁,主要见于育龄期女性,绝经 后女性较为罕见[3-4]。部分学者认为ETT与既往妊娠相关,可继发于各种妊娠,包括足月分娩
后女性较为罕见[3-4]。部分学者认为ETT与既往妊娠相关,可继发于各种妊娠,包括足月分娩 、自然流产
、自然流产 、异位妊娠
、异位妊娠 或葡萄胎,或继发于前次GTN[5-6],也有一些病例并无明确的前次妊娠史[7]。本例患者为1名38岁的育龄期女性,其过往妊娠史包括两次足月妊娠后进行的剖宫产(手术间隔2年),以及1次葡萄胎病史(时间间隔7年)。患者的发病年龄与现有文献资料中的ETT平均发病年龄相吻合。至于此次ETT的发病是否直接关联于她之前的妊娠经历,由于未进行深入的遗传学检测,目前尚无法得出确凿结论。
或葡萄胎,或继发于前次GTN[5-6],也有一些病例并无明确的前次妊娠史[7]。本例患者为1名38岁的育龄期女性,其过往妊娠史包括两次足月妊娠后进行的剖宫产(手术间隔2年),以及1次葡萄胎病史(时间间隔7年)。患者的发病年龄与现有文献资料中的ETT平均发病年龄相吻合。至于此次ETT的发病是否直接关联于她之前的妊娠经历,由于未进行深入的遗传学检测,目前尚无法得出确凿结论。
因其临床表现的非特异性,所以难以在早期准确诊断ETT。ETT的常见症状为异常阴道出血[8],部分患者可能出现异常排液或分泌物增多的现象;当合并宫外转移时可出现其他症状,肺部是最常见的子宫外转移部位,占所有病例的19.0%[9]。鉴于ETT的这些非特异性临床表现以及其在临床上的罕见性,术前诊断成为了一大挑战。特别是当肿瘤位于宫体时,ETT常被误诊为子宫肌瘤;而位于宫颈的ETT则可能被误诊为宫颈癌 。这种误诊情况不仅增加了治疗的难度,还可能延误患者的最佳治疗时机。在本病例中,患者经历了长达8个多月的阴道异常出血,但在外院多次就诊,均被按照子宫肌瘤进行了相应的治疗。这种误诊一定程度上导致了病情的延误。
。这种误诊情况不仅增加了治疗的难度,还可能延误患者的最佳治疗时机。在本病例中,患者经历了长达8个多月的阴道异常出血,但在外院多次就诊,均被按照子宫肌瘤进行了相应的治疗。这种误诊一定程度上导致了病情的延误。
在ETT的诊断过程中,虽然血清β-HCG水平的检测是重要的参考指标,但其改变却并不具有特异性。大多数ETT患者的血清β-HCG水平通常不会显著升高,约有70%的病例其β-HCG值保持在2500U/L以下,而超过10000U/L的情况仅见于约7.1%的病例[10]。值得注意的是,患者的血清β-HCG水平与ETT的进展及预后之间并未显示出直接的正比关系,这意味着,即使血清β-HCG水平不高也不能排除ETT的可能性,而β-HCG水平越高也不一定意味着越差的预后[11]。针对本例患者的具体情况,其确诊时的血清β-HCG水平为6322U/L,术前最高值达到7823U/L,虽处于相对较高范围但并未达到极端异常。经过手术治疗后,患者的血清β-HCG水平显著下降,特别是在接受第2程化疗后,β-HCG值已恢复至完全正常水平。这一变化趋势不仅反映了患者对治疗的积极响应,也进一步强调了监测血清β-HCG水平在ETT疗效评估中的重要性。
影像学检查在ETT的鉴别诊断中的特异性相对有限。超声检查中,ETT常表现为子宫肌层内边界较清楚的单发结节,可凸向宫腔[12]。由于ETT病灶内的血管不丰富,导致多普勒信号值偏低,因此传统的多普勒血流成像对于ETT的诊断价值受到一定限制。为了克服这一局限性,超声造影技术被引入并显示出更高的诊断准确性。超声造影能够更精确地描绘ETT病灶的强化模式,通常表现为周边环状增强伴随球状向心性强化,其向心充盈过程完全且消退迅速。这种独特的增强模式与GTN病灶的弥漫性和持续性强化模式存在显著差异,有助于两者的鉴别诊断[13]。此外,磁共振成像 (MRI)在ETT的评估中也发挥着一定作用。ETT病灶的MRI图像呈现为实性结构,且扩散加权成像(DWI)显示增强。虽CT和MRI作为主要手段诊断术前ETT作用有限,但它们在验证和补充其他诊断信息、评估子宫外肿瘤种植及转移情况方面具有重要意义。这些信息对于制定更为精确的手术方案、选择最佳的治疗策略具有不可或缺的参考价值。本例患者的B超显示子宫体内存在一个单发的实性结节,且边界较为模糊,不够清晰,结节内部显示出较为丰富的血流信号,这一发现提示了结节可能具有较高的血管化程度。CT图像显示,该病灶主要局限于子宫体内,未发现有子宫外的扩散或淋巴结转移的征象。这一信息对于评估患者的病情严重程度、制定治疗计划及预测预后都具有重要的参考价值。
(MRI)在ETT的评估中也发挥着一定作用。ETT病灶的MRI图像呈现为实性结构,且扩散加权成像(DWI)显示增强。虽CT和MRI作为主要手段诊断术前ETT作用有限,但它们在验证和补充其他诊断信息、评估子宫外肿瘤种植及转移情况方面具有重要意义。这些信息对于制定更为精确的手术方案、选择最佳的治疗策略具有不可或缺的参考价值。本例患者的B超显示子宫体内存在一个单发的实性结节,且边界较为模糊,不够清晰,结节内部显示出较为丰富的血流信号,这一发现提示了结节可能具有较高的血管化程度。CT图像显示,该病灶主要局限于子宫体内,未发现有子宫外的扩散或淋巴结转移的征象。这一信息对于评估患者的病情严重程度、制定治疗计划及预测预后都具有重要的参考价值。
ETT的病理特征在大体上可表现为单发或多发,质地各异,包括实性、囊性或囊实性。该患者的情况属于多发实性病灶,具体位于子宫前壁及宫底,颜色及质地与鸡蛋黄相似,这反映了ETT在宏观形态上的多样性。ETT的镜下表现为高度异型性
的绒毛膜型中间型滋养细胞周围围绕着嗜酸性玻璃样基质及广泛的坏死区域,形成了典型的“地图样”改变。这种特殊的病理模式对于ETT的诊断具有重要意义,尽管它也可能因其与鳞状细胞癌 相似的某些特征而导致误诊[14]。在本例诊断过程中确实遇到了挑战。免疫组化并未给出特别明确的指向性,镜下观察时与宫颈鳞状细胞癌存在相似之处,这进一步增加了诊断的难度。然而,通过科内多位资深教授的深入讨论,并结合患者的临床表现和其他相关信息,最终成功地明确了ETT的诊断。这一过程也充分体现了多学科合作和综合分析在复杂病例诊断中的重要性。
相似的某些特征而导致误诊[14]。在本例诊断过程中确实遇到了挑战。免疫组化并未给出特别明确的指向性,镜下观察时与宫颈鳞状细胞癌存在相似之处,这进一步增加了诊断的难度。然而,通过科内多位资深教授的深入讨论,并结合患者的临床表现和其他相关信息,最终成功地明确了ETT的诊断。这一过程也充分体现了多学科合作和综合分析在复杂病例诊断中的重要性。
ETT与绒毛膜癌在治疗上存在显著差异,后者通常对化疗具有高度敏感性,而前者则对放/化疗相对不敏感,因此,目前ETT的公认治疗方案主要侧重于手术治疗[15]。手术切除全子宫或转移灶是ETT的主要治疗手段。由于ETT是一种非激素依赖性肿瘤,其卵巢转移的风险相对较低,因此在决定是否切除卵巢时,可以更多地考虑患者的年龄和生育意愿。在本例中,患者为38岁女性,已完成生育并无再生育的意愿,且病灶局限于子宫内,因此在手术时选择了全子宫切除,并同时进行了双侧输卵管的机会性切除,而保留了双侧卵巢,以维护患者的内分泌功能和生活质量。查阅文献暂无手术方式的推荐,我们认为对于病灶局限、术前评估手术难度不高的,可选择腹腔镜手术,取出标本时注意无瘤原则,腹腔镜子宫切除术后取出标本时将标本放入取物袋中,将袋口外翻至阴道口后再取出标本,可避免种植转移。
目前,ETT患者术后辅助化疗的作用存在争议,Ⅰ期患者切除子宫后即可达到完全缓解,故不推荐术后辅助化疗,而对于转移和复发的患者可考虑术后辅助化疗。目前,尚无标准的化疗方案及疗程数,化疗方案建议多药联合,可选择依托泊苷+甲氨蝶呤+放线菌素-D/顺铂 -依托泊苷(EMA-EP)、甲氨蝶呤+放线菌素-D/环磷酰胺+依托泊苷+长春新碱(EMA-CO)、氟尿嘧啶
-依托泊苷(EMA-EP)、甲氨蝶呤+放线菌素-D/环磷酰胺+依托泊苷+长春新碱(EMA-CO)、氟尿嘧啶 +放线菌素-D+依托泊苷+长春新碱(FAEV)等[16]。ETT的高危因素包括距离前次妊娠间隔时间≥2年、有丝分裂像>5个/10个高倍镜视野、有坏死和深部浸润。具有以上任何1个高危因素,均需行系统治疗。考虑该患者存在深肌层浸润、肿瘤坏死及有丝分裂指数高等高危因素,且患者术前β-HCG水平较高,故建议术后行辅助化疗,方案选择经典EMA-CO方案,共进行4程化疗,此后规律复查血β-HCG均正常。
+放线菌素-D+依托泊苷+长春新碱(FAEV)等[16]。ETT的高危因素包括距离前次妊娠间隔时间≥2年、有丝分裂像>5个/10个高倍镜视野、有坏死和深部浸润。具有以上任何1个高危因素,均需行系统治疗。考虑该患者存在深肌层浸润、肿瘤坏死及有丝分裂指数高等高危因素,且患者术前β-HCG水平较高,故建议术后行辅助化疗,方案选择经典EMA-CO方案,共进行4程化疗,此后规律复查血β-HCG均正常。
ETT相关报道的病例数量极为有限,且大多以个案或小样本形式呈现。这种现状导致缺乏大规模、长期随访的研究来深入剖析该疾病转归。由于该肿瘤的临床表现缺乏特异性,使得诊断过程中容易出现漏诊现象,因此,临床医师亟需加强对该疾病的认识和警惕性。在治疗策略上,手术治疗为首选方案,但术后是否需要进行辅助化疗以及化疗的具体方案,尚未形成统一的共识。临床决策往往依据患者的具体分期情况、是否存在不良预后因素等个性化因素来制定[17]。同时,强调长期且规律的随访对于监测肿瘤复发或转移、评估治疗效果至关重要。
本例中,患者通过综合治疗成功达到了治愈状态,并且在后续的随访期间内,未观察到肿瘤复发或转移的迹象,目前仍处于持续的随访监测之中。这一成功案例为临床医生提供了宝贵的借鉴,强调了综合治疗与严格随访在罕见肿瘤管理中的重要性。
参考文献略。
来源:生殖医学杂志2025年4月第34卷第4期
