
血常规仪器报警:疟原虫感染红细胞?
作者:万云莉 张金蓉,云南省临沧市云县人民医院
患者男,49岁,在缅甸务工,务工期间间断出现发热 ,具体体温未监测。伴畏寒、寒战,无咳嗽
,具体体温未监测。伴畏寒、寒战,无咳嗽 、咳痰,无全身酸痛、乏力、流涕、鼻阻等不适,病后自行口服药物并至当地诊所输液治疗(具体情况不详),症状未缓解,10余天后返回原户籍地,在当地卫生院输液治疗后症状仍未好转。
、咳痰,无全身酸痛、乏力、流涕、鼻阻等不适,病后自行口服药物并至当地诊所输液治疗(具体情况不详),症状未缓解,10余天后返回原户籍地,在当地卫生院输液治疗后症状仍未好转。
近2天来,患者诉上述症状加重,测体温最高可达40.0℃,给予退热处理后体温能降至正常,但易反复。病程中,患者无咳嗽、咳痰,无心悸 、胸闷、呼吸困难
、胸闷、呼吸困难 ,无恶心、呕吐
,无恶心、呕吐 ,无腹痛、腹胀、腹泻
,无腹痛、腹胀、腹泻 ,无尿频、尿急、尿痛等症状。今为进一步系统诊治,来我院就诊。门诊以“发热查因”收住入院。患病以来,患者精神、饮食、睡眠差,大小便正常,体重变化不详。
,无尿频、尿急、尿痛等症状。今为进一步系统诊治,来我院就诊。门诊以“发热查因”收住入院。患病以来,患者精神、饮食、睡眠差,大小便正常,体重变化不详。
案例经过
血液分析仪结果
血常规 结果:白细胞轻度减少,血小板减少。散点图异常:血细胞分析仪
结果:白细胞轻度减少,血小板减少。散点图异常:血细胞分析仪 DIFF通道三维散点图中,中性粒细胞右下方、嗜酸性粒细胞左侧出现异常散点。
DIFF通道三维散点图中,中性粒细胞右下方、嗜酸性粒细胞左侧出现异常散点。
报警信息:淋巴细胞减少,疟原虫 感染红细胞?触发仪器复检规则后自动推片。
感染红细胞?触发仪器复检规则后自动推片。

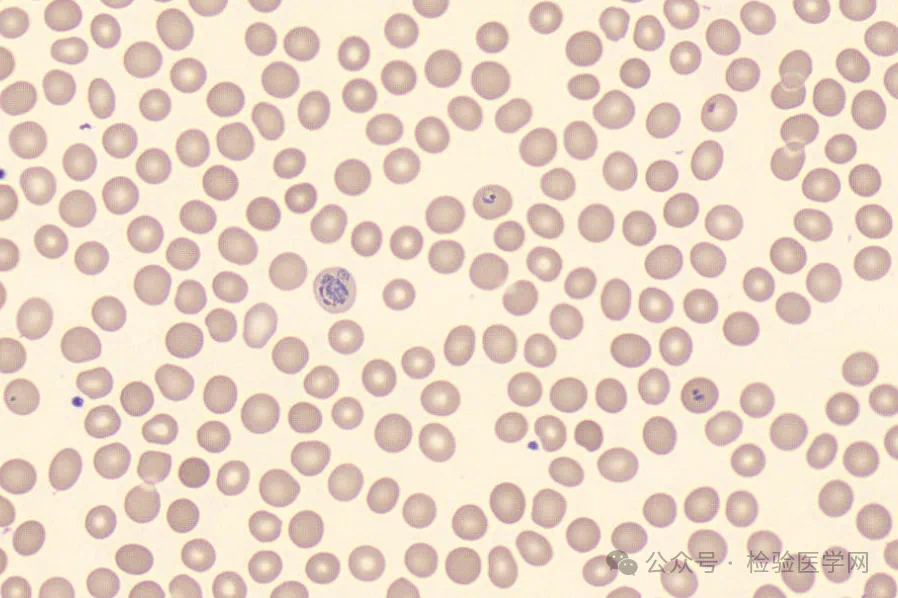
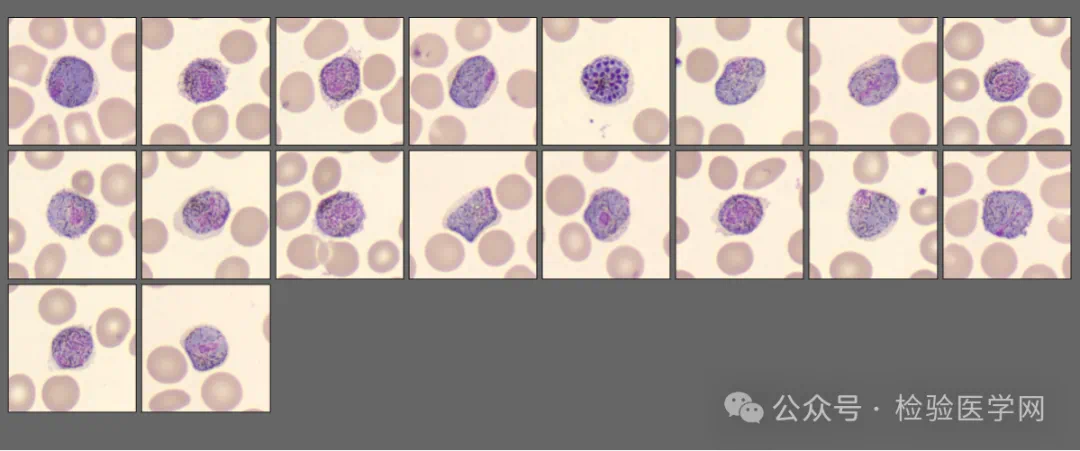
阅片仪复检结果
涂片后,可见疟原虫寄生的红细胞体积胀大,色淡。在显微镜下可见各期疟原虫,包括环状体、滋养体、配子体、裂殖体等。
疟原虫抗原金标法试剂检测
T2(+),进一步证实了间日疟原虫感染。

结合以上结果,并将血液标本同时送检云县疾控中心,核酸检测 为间日疟原虫阳性。
为间日疟原虫阳性。
讨论与总结
散点图在疟原虫感染诊断中的作用
血常规异常散点图可作为疟原虫感染的初步筛查工具[1]。散点图上的异常散点可能代表被疟原虫感染的红细胞或其他异常细胞。
血细胞分析仪的局限性
虽然血细胞分析仪提供了感染红细胞的报警信息及研究参数,并对疟原虫报警有比较高的灵敏度,且血液分析仪散点图特征性改变在疟原虫感染检测中具有重要的提示作用,但是仪器的报警只能作为筛查提示,确认疟原虫还需要镜检。不同类型的疟原虫对染料敏感性不同,可能导致仪器检测对疟原虫漏检。
综合诊断的重要性
疟原虫感染的诊断不能仅凭仪器散点图的变化和报警提示,还需结合患者的流行病学史、显微镜镜检(厚血膜、薄血膜涂片法)、疟原虫快速检测试剂盒、核酸检测等综合手段进行确诊。
薄血涂片 法中,疟原虫形态完整、典型,但原虫密度低,容易漏检;厚血涂片由于疟原虫密度高,容易检出,但制作过程中红细胞溶解,原虫形态可能会发生改变,可能影响虫种鉴定[2]。
法中,疟原虫形态完整、典型,但原虫密度低,容易漏检;厚血涂片由于疟原虫密度高,容易检出,但制作过程中红细胞溶解,原虫形态可能会发生改变,可能影响虫种鉴定[2]。
疟原虫的感染途径、生活史、不同时期形态[3]
感染途径
疟原虫主要通过雌性按蚊叮咬人体进行传播。当按蚊叮咬疟疾 病人时,病人血液里的疟原虫就会被吸入蚊胃中,经过发育繁殖,成为有感染性的子孢子,并进入蚊唾液腺。当健康人被带有子孢子的按蚊叮咬时,子孢子就会随蚊唾液进入人体血液,从而引发疟疾。
病人时,病人血液里的疟原虫就会被吸入蚊胃中,经过发育繁殖,成为有感染性的子孢子,并进入蚊唾液腺。当健康人被带有子孢子的按蚊叮咬时,子孢子就会随蚊唾液进入人体血液,从而引发疟疾。
此外,疟原虫也可能通过血液传播(如输血 )和母婴传播感染。
)和母婴传播感染。
生活史
疟原虫的一生要经历人和按蚊两个宿主,其生活史包括无性世代和有性世代。无性世代在人体进行,有性世代在雌性按蚊内进行,包括红细胞外期、红细胞内期、配子生殖阶段、孢子生殖阶段。
红细胞外期:子孢子随蚊唾液进入人血后,进入肝实质细胞开始裂体生殖,产生裂殖子。裂殖子破坏肝细胞而出,侵入红细胞,开始红细胞内期的发育。
红细胞内期:裂殖子进入红细胞后,经过一系列发育阶段(如环状体、大滋养体、裂殖体),最终使红细胞破裂,裂殖子散到血浆中,部分侵入其它的红细胞,重复进行裂体生殖。
配子生殖阶段:在红细胞内的大、小配子体被按蚊摄入后,在蚊胃中进行有性生殖,形成配子并结合成合子。
孢子生殖阶段:在蚊体内,合子发育成动合子,穿入蚊胃壁进入卵囊。卵囊细胞核及胞质经多次分裂产生数百甚至上万的子孢子。子孢子成熟后卵囊破裂,子孢子逸出进入蚊体腔(血腔),大多到达按蚊唾液腺中。当雌性按蚊再次叮咬人时,子孢子进入人体,开始新一轮的生活史循环。
间日疟原虫的不同时期形态
同一血膜中可发现间日疟各期原虫。环状体:核1个,较大,胞质较厚,常呈感叹号 或逗号状,有时也可见双核的环状体。非洲虫种有些类似“荷包蛋”,体积比淋巴细胞还大。大滋养体:较大,呈阿米巴样,形状不规则。核位于胞质中或外边,胞质常缩成圆形或断裂呈数块,色素分布不均较大。常可见空泡。裂殖体:裂殖子12-24个,通常16-18个,排列不规则,较大。疟色素黄褐色,常聚集一侧。配子体:较大,圆形,色素粗大。雌配子体较大,核小,胞质深蓝色,雄配子体较小,核大,胞质浅蓝色。(口诀:雄中间,雌旁边。雄疏松,雌致密)。
或逗号状,有时也可见双核的环状体。非洲虫种有些类似“荷包蛋”,体积比淋巴细胞还大。大滋养体:较大,呈阿米巴样,形状不规则。核位于胞质中或外边,胞质常缩成圆形或断裂呈数块,色素分布不均较大。常可见空泡。裂殖体:裂殖子12-24个,通常16-18个,排列不规则,较大。疟色素黄褐色,常聚集一侧。配子体:较大,圆形,色素粗大。雌配子体较大,核小,胞质深蓝色,雄配子体较小,核大,胞质浅蓝色。(口诀:雄中间,雌旁边。雄疏松,雌致密)。
常见的疟原虫检测方法[2,4]
薄、厚血膜涂片显微镜镜检
骨髓穿刺涂片镜检
疟疾免疫学检测 (酶联免疫吸附试验
(酶联免疫吸附试验 、间接免疫荧光试验
、间接免疫荧光试验 、快速检测实验)
、快速检测实验)
分子生物学检测(聚合酶链式反应 )
)
【参考文献】
[1] Ningombam A, Sarkar A, Acharya S, et al. Application of Sysmex XN-Series Automated Haematology Analyser in the Rapid Detection of Malaria. Indian J Hematol Blood Transfus. 2020 Jul;36(3):512-518.
[2] Zhong Y, Dan Y, Cai Y, Lin J, et al. Efficient Malaria Parasite Detection From Diverse Images of Thick Blood Smears for Cross-Regional Model Accuracy. IEEE Open J Eng Med Biol. 2023 Oct 30;4:226-233.
[3] Savi MK. An Overview of Malaria Transmission Mechanisms, Control, and Modeling. Med Sci (Basel). 2022 Dec 23;11(1):3.
[4] Romanello M, Napoli CD, Green C, et al. The 2023 report of the Lancet Countdown on health and climate change: the imperative for a health-centred response in a world facing irreversible harms. Lancet. 2023 Dec 16;402(10419):2346-2394.
来源:检验医学网
