
林奇综合征相关性子宫内膜癌患者保留生育治疗病案讨论
作者:尹苑麟,郑 莹,彭诗意,陈思敬,杨 帆等,四川大学华西第二医院子宫内膜癌 保留生育功能治疗多学科协作组 出生缺陷与相关妇儿疾病教育部重点实验室
保留生育功能治疗多学科协作组 出生缺陷与相关妇儿疾病教育部重点实验室
1 病历摘要
患者,31岁,因月经紊乱10+年,加重2+月,于2020年6月10日入四川大学华西第二医院住院治疗。10+年前患者无明显诱因出现月经紊乱,表现为经量增多伴经期及周期延长,间断予以黄体酮 治疗,停药后月经仍紊乱。2+年前因阴道大量流血于外院行诊断性刮宫术(简称诊刮),自诉诊刮未见异常。2+月前患者症状加重,外院诊刮子宫内膜病理检查
治疗,停药后月经仍紊乱。2+年前因阴道大量流血于外院行诊断性刮宫术(简称诊刮),自诉诊刮未见异常。2+月前患者症状加重,外院诊刮子宫内膜病理检查 (简称病检)提示子宫内膜腺体复杂性增生伴不典型增生,本院病理会诊结果提示子宫内膜复杂性不典型增生伴灶性癌变,考虑诊断“子宫内膜恶性肿瘤”。患者遂于本院门诊就诊,2020年5月25日阴道彩超检查示子宫内膜(单层)厚约0.6 cm,内膜回声不均匀。患者患病以来精神、食欲可,大小便正常,体质量无明显变化。既往史无特殊,月经及生育史:G0P0,初潮年龄13岁,经期15 d,周期50~60 d,末次月经2020年4月24日。家族成员无癌症史。
(简称病检)提示子宫内膜腺体复杂性增生伴不典型增生,本院病理会诊结果提示子宫内膜复杂性不典型增生伴灶性癌变,考虑诊断“子宫内膜恶性肿瘤”。患者遂于本院门诊就诊,2020年5月25日阴道彩超检查示子宫内膜(单层)厚约0.6 cm,内膜回声不均匀。患者患病以来精神、食欲可,大小便正常,体质量无明显变化。既往史无特殊,月经及生育史:G0P0,初潮年龄13岁,经期15 d,周期50~60 d,末次月经2020年4月24日。家族成员无癌症史。
查体:T 36.6℃,P 90次/min,R 20次/min,BP93/67 mm Hg,体质量指数(BMI)20.39 kg/m2。内科查体无特殊。专科查体:子宫颈光滑;子宫前位、常大、表面光滑、无压痛;双侧附件区未扪及异常。因患者未生育、保留生育功能愿望强烈,患者及家属充分知情后,由本院子宫内膜癌保留生育功能治疗多学科团队进行全面评估:①妇科肿瘤 科:专科查体无特殊;肿瘤标志物
科:专科查体无特殊;肿瘤标志物 检查结果示癌抗原125(CA125)7.0 U/ml,癌抗原19-9(CA19-9)10.0 U/ml,人附睾蛋白4(HE4)52.0 pmol/L;乳腺彩超、子宫颈细胞学筛查等相关检查未见明显异常。②病理科:会诊外院诊刮标本结果示子宫内膜复杂性增生伴不典型增生及癌变,高分化子宫内膜样腺癌形成。免疫组化(immunohistochemistry,IHC)结果为ER(+++)、PR(+++)、P53野生型表达;DNA错配修复(mismatch repair,MMR)蛋白检测结果为MSH6完全性表达缺失,MSH2、MLH1、PMS2均无表达缺失;分子分型提示高度微卫星不稳定性(microsatellite instability-high,MSI-H)型。③放射科:盆腹腔磁共振成像
检查结果示癌抗原125(CA125)7.0 U/ml,癌抗原19-9(CA19-9)10.0 U/ml,人附睾蛋白4(HE4)52.0 pmol/L;乳腺彩超、子宫颈细胞学筛查等相关检查未见明显异常。②病理科:会诊外院诊刮标本结果示子宫内膜复杂性增生伴不典型增生及癌变,高分化子宫内膜样腺癌形成。免疫组化(immunohistochemistry,IHC)结果为ER(+++)、PR(+++)、P53野生型表达;DNA错配修复(mismatch repair,MMR)蛋白检测结果为MSH6完全性表达缺失,MSH2、MLH1、PMS2均无表达缺失;分子分型提示高度微卫星不稳定性(microsatellite instability-high,MSI-H)型。③放射科:盆腹腔磁共振成像 (magnetic resonance imaging,MRI)检查提示宫体腔内可见散在大小不等异常信号影,较大者位于宫底部,约1.0 cm×0.6 cm×1.0 cm(前后×上下×左右),子宫结合带完整,子宫颈、双侧附件、膀胱、直肠、盆腹膜、盆壁、淋巴结等未见明显异常。④生殖内分泌科:性激素及甲状腺功能检查
(magnetic resonance imaging,MRI)检查提示宫体腔内可见散在大小不等异常信号影,较大者位于宫底部,约1.0 cm×0.6 cm×1.0 cm(前后×上下×左右),子宫结合带完整,子宫颈、双侧附件、膀胱、直肠、盆腹膜、盆壁、淋巴结等未见明显异常。④生殖内分泌科:性激素及甲状腺功能检查 未见明显异常,抗苗勒管激素(AMH)1.02 ng/ml,胰岛素
未见明显异常,抗苗勒管激素(AMH)1.02 ng/ml,胰岛素 释放试验示胰岛素抵抗指数0.47。⑤医学遗传科:基因检测报告提示MSH6基因c.3083C>G(p.S1028∗),杂合胚系变异,美国医学遗传学与基因组学学会(ACMG)评级为致病性,变异来源为新发。MSH6基因的功能丧失变异与林奇综合征相关,该疾病呈常染色体
释放试验示胰岛素抵抗指数0.47。⑤医学遗传科:基因检测报告提示MSH6基因c.3083C>G(p.S1028∗),杂合胚系变异,美国医学遗传学与基因组学学会(ACMG)评级为致病性,变异来源为新发。MSH6基因的功能丧失变异与林奇综合征相关,该疾病呈常染色体 显性遗传模式,外显率高。若有生育需求,可考虑胚胎植入前单基因病遗传学检测(preimplantation genetic testing for monogenic disorders, PGT-M),以降低再发风险。多学科会诊(multi-disciplinary treatment,MDT)讨论后诊断为:高分化子宫内膜样腺癌ⅠA1期[国际妇产科联盟(FIGO)2009],林奇综合征。告知其林奇综合征相关性子宫内膜癌(Lynch syndrome-associated endometrial cancer,LS-EC) 并非保留生育功能的绝对禁忌证,但存在较高风险。患者及家属充分知情后,因患者年轻未婚未育,仍坚决要求保留生育功能,并签署知情同意书,故于2020年6月10日入本院行宫腔镜
显性遗传模式,外显率高。若有生育需求,可考虑胚胎植入前单基因病遗传学检测(preimplantation genetic testing for monogenic disorders, PGT-M),以降低再发风险。多学科会诊(multi-disciplinary treatment,MDT)讨论后诊断为:高分化子宫内膜样腺癌ⅠA1期[国际妇产科联盟(FIGO)2009],林奇综合征。告知其林奇综合征相关性子宫内膜癌(Lynch syndrome-associated endometrial cancer,LS-EC) 并非保留生育功能的绝对禁忌证,但存在较高风险。患者及家属充分知情后,因患者年轻未婚未育,仍坚决要求保留生育功能,并签署知情同意书,故于2020年6月10日入本院行宫腔镜 评估和治疗。
评估和治疗。
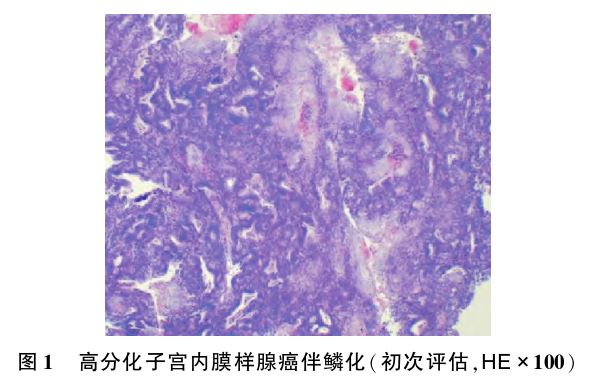
初次评估(2020年6月11日):行宫腔镜下子宫内膜多点活检术。宫腔镜探查见:宫腔前壁正中12点、宫底正中可见鱼肉样组织,最大位于宫底,大小约1.0 cm×1.0 cm,苍白、质朽,表面未见异型血管,左侧及右侧宫角处均可见指状突起,右侧壁、后壁5点处可见息肉样突起,表面未见异型血管,予以切取上述部位子宫内膜组织分点送病检。术后病检提示:高分化子宫内膜样腺癌伴较广泛鳞状细胞分化(见图1);IHC结果示ER(+++)、PR(+++)、P53野生型表达;MMR蛋白检测结果示:MLH1(+++)、PMS2(+++)、MSH2(+++),MSH6(-)。术后严密随访下予醋酸甲羟孕酮 (medroxyprogesterone acetate,MPA)口服250 mg/d联合宫腔安置左炔诺孕酮
(medroxyprogesterone acetate,MPA)口服250 mg/d联合宫腔安置左炔诺孕酮 宫内节育器(levonorgestrel intrauterine system,LNG-IUS)进行保留生育功能治疗。期间每月复查肝功能未见明显异常,嘱3个月后再次行宫腔镜评估病灶变化情况。
宫内节育器(levonorgestrel intrauterine system,LNG-IUS)进行保留生育功能治疗。期间每月复查肝功能未见明显异常,嘱3个月后再次行宫腔镜评估病灶变化情况。
一阶段评估(2020年10月12日):肿瘤标志物正常。盆腹腔MRI检查结果示:宫腔内节育环影;宫腔内散在结片状异常信号影,未见确切肌层侵犯;比较初评前MRI(2020年5月19日)结节明显减少、缩小;子宫颈、双侧附件、膀胱、直肠、淋巴结均未见明显异常。宫腔镜探查见:子宫前壁正中、宫底正中可见鱼肉样组织,最大位于宫底,大小约1.0 cm×0.5 cm,余各壁与初评宫腔镜所见相似。予以切取上述部位子宫内膜组织分点送病检,术中更换LNG-IUS。术后病检结果示:子宫内膜复杂性增生及灶性不典型增生,未见癌,子宫内膜腺体萎缩,间质蜕膜样变;IHC结果示ER(+++)、PR(+)、P53野生型表达。子宫内膜对孕激素 类药物治疗反应尚可,建议继续规范治疗后诊刮送检。考虑患者肿瘤达部分缓解,治疗有效,术后继续严密随访下予MPA口服250 mg/d联合LNG-IUS治疗。
类药物治疗反应尚可,建议继续规范治疗后诊刮送检。考虑患者肿瘤达部分缓解,治疗有效,术后继续严密随访下予MPA口服250 mg/d联合LNG-IUS治疗。
二阶段评估(2021年3月4日):肿瘤标志物正常。盆腹腔MRI检查结果示:宫腔内节育环影;宫底近左侧宫角处内膜间小结节影,未见肌层侵犯;比较一阶段评估前MRI(2020年9月8日),宫底部及宫腔偏左侧结节未见明确显示,左侧宫角处结节较前缩小;余未见明显异常。宫腔镜探查见左侧宫角有一0.3 cm×0.5 cm指状突起,余各壁未见明显异常,予
以切取左侧宫角内膜及余各壁内膜组织分点送病检。术中更换LNG-IUS。术后病检结果示:子宫内膜腺体萎缩,间质蜕膜样变,所附肌壁组织均未见异常。IHC结果示ER(+)、PR(-)、P53野生型表达。考虑患者肿瘤达到完全缓解。因患者系子宫内膜癌,术后继续原方案巩固1个疗程。
三阶段评估(2021年9月23日):肿瘤标志物正常。盆腹腔MRI检查结果示:宫腔内节育环影;内膜较薄,其内未见确切异常信号;余影像学表现同前。比较二阶段评估前MRI(2021年1月19日),左侧宫角内膜间小结节影未显示。宫腔镜探查见:右侧宫角近宫底处稍凸起,表面可见明显异生血管,其余各壁内膜菲薄,充血明显,切取右侧宫角内膜及余各壁内膜组织分点送病检。术中更换LNG-IUS。术后病检结果未见明显异常;IHC结果示ER(++)、PR(-)、P53野生型表达。因患者未婚,无即刻生育计划,术后仅予以宫内安置LNG-IUS进行维持治疗,建议每半年复查1次宫腔细胞学检查。
维持治疗期间患者每半年复查肿瘤标志物、宫腔细胞学、阴道彩超(必要时行盆腹腔MRI)等检查,均未见肿瘤复发征象,每年复查胃肠镜未见异常。患者肿瘤完全缓解20个月后有生育需求,要求行辅助生殖助孕。为避免林奇综合征向子代传递,可考虑行三代辅助生殖技术 助孕,即胚胎植入前遗传学检测(preimplantation genetic testing,PGT)。患者因个人原因及男方精液检查
助孕,即胚胎植入前遗传学检测(preimplantation genetic testing,PGT)。患者因个人原因及男方精液检查 提示少弱畸精症,最终选择二代辅助生殖技术助孕,即卵胞浆内单精子注射(intracytoplasmicsperm injection,ICSI)技术。予以多周期“拮抗剂”方案促排卵后,分别于2023年8月19日及2023年11月9日移植冻胚,均未着床。于2024年4月及2025年1月自然妊娠
提示少弱畸精症,最终选择二代辅助生殖技术助孕,即卵胞浆内单精子注射(intracytoplasmicsperm injection,ICSI)技术。予以多周期“拮抗剂”方案促排卵后,分别于2023年8月19日及2023年11月9日移植冻胚,均未着床。于2024年4月及2025年1月自然妊娠 后自然流产
后自然流产 。随访至今,患者无疾病复发及转移。
。随访至今,患者无疾病复发及转移。
2 讨 论
尹苑麟(妇科住院医师):根据患者病史及相关检查现总结病例如下:①患者系育龄期女性,G0P0;②因月经紊乱10+年,加重2+月入院,入院前彩超检查提示子宫内膜回声不均匀,诊刮病检提示高分化子宫内膜样腺癌形成。IHC结果提示MSH6完全性表达缺失。分子分型MSI-H型。诊断高分化子宫内膜样腺癌ⅠA1期(FIGO 2009);③患者基因检测提示:MSH6基因c.3083C>G杂合胚系致病突变,诊断林奇综合征;④因患者有强烈保留生育愿望,经本院子宫内膜癌保留生育功能MDT讨论,予以全面评估,宫腔镜初评提示宫内无残留、MRI检查提示宫外无转移,术后予宫腔内安置LNG-IUS及口服MPA 250 mg/d进行保留生育功能治疗。二阶段宫腔镜评估子宫内膜无异常,考虑肿瘤达到完全缓解。上述方案巩固治疗3个月后,因患者暂无即刻生育需求,后予以LNG-IUS维持治疗。患者肿瘤完全缓解20个月后有生育计划,遂取LNG-IUS行辅助生殖技术助孕。随访至今,患者胚胎移植2次均失败,自然妊娠2次均自然流产,疾病无复发。对于LS-EC患者保留生育治疗的风险及效果,文献报道有限,但本例患者子宫内膜病变逆转,达完全缓解,故结合本病例的保留生育功能治疗提起讨论,为今后相关研究提供依据。
彭诗意(妇科住院医师):林奇综合征又称遗传性非息肉性结直肠癌 (hereditary non-polyposis coloncancer,HNPCC),属常染色体显性遗传性疾病,是遗传性结直肠癌最常见的病因。林奇综合征会增加患各种肿瘤的风险,子宫内膜癌是女性林奇综合征最常见的肠外肿瘤,40%~60%的子宫内膜癌为林奇综合征女性的首发肿瘤,故在林奇综合征中子宫内膜癌可视为前哨癌。LS-EC主要由MMR基因(MLH1、MSH2、MSH6或PMS2)中的1个或多个基因胚系突变所引起。与散发性子宫内膜癌临床表现相比,患者更年轻,BMI偏低,多无雌激素
(hereditary non-polyposis coloncancer,HNPCC),属常染色体显性遗传性疾病,是遗传性结直肠癌最常见的病因。林奇综合征会增加患各种肿瘤的风险,子宫内膜癌是女性林奇综合征最常见的肠外肿瘤,40%~60%的子宫内膜癌为林奇综合征女性的首发肿瘤,故在林奇综合征中子宫内膜癌可视为前哨癌。LS-EC主要由MMR基因(MLH1、MSH2、MSH6或PMS2)中的1个或多个基因胚系突变所引起。与散发性子宫内膜癌临床表现相比,患者更年轻,BMI偏低,多无雌激素 相关刺激症状及体征,病灶好发于子宫下段。2022年美国国家综合癌症网络(NCCN)指南建议,在条件允许时对所有新诊断为子宫内膜癌的患者都应进行林奇综合征筛查,针对LS-EC的筛查,首选初筛方法是利用IHC检测MLH1、MSH2、PMS2或MSH6蛋白的表达水平。对于IHC结果显示MLH1蛋白伴或不伴PMS2蛋白表达缺失的患者,需进一步行MLH1启动子甲基化分析。若甲基化检测结果为阳性,则提示该肿瘤为散发性;反之若结果为阴性,则建议行MMR基因胚系突变检测。对于IHC检测中MSH2、MSH6或PMS2蛋白表达缺失的患者,推荐直接行MMR基因胚系突变检测。而对于IHC检测显示MMR蛋白表达完整,但临床上存在林奇综合征疑似表现的患者,应考虑行微卫星不稳定性(microsatellite instability,MSI)检测。若MSI检测结果呈现MSI-H,则同样建议行MMR基因胚系突变检测。
相关刺激症状及体征,病灶好发于子宫下段。2022年美国国家综合癌症网络(NCCN)指南建议,在条件允许时对所有新诊断为子宫内膜癌的患者都应进行林奇综合征筛查,针对LS-EC的筛查,首选初筛方法是利用IHC检测MLH1、MSH2、PMS2或MSH6蛋白的表达水平。对于IHC结果显示MLH1蛋白伴或不伴PMS2蛋白表达缺失的患者,需进一步行MLH1启动子甲基化分析。若甲基化检测结果为阳性,则提示该肿瘤为散发性;反之若结果为阴性,则建议行MMR基因胚系突变检测。对于IHC检测中MSH2、MSH6或PMS2蛋白表达缺失的患者,推荐直接行MMR基因胚系突变检测。而对于IHC检测显示MMR蛋白表达完整,但临床上存在林奇综合征疑似表现的患者,应考虑行微卫星不稳定性(microsatellite instability,MSI)检测。若MSI检测结果呈现MSI-H,则同样建议行MMR基因胚系突变检测。
目前国内外指南均认可的子宫内膜癌保留生育适应证为:①病理组织类型为子宫内膜样癌(endometrialendometrioid carcinoma,EEC),高分化(G1);②影像学检查提示肿瘤局限在子宫内膜;③无可疑或转移的病变;④年龄<40岁,有强烈的生育愿望;⑤无药物治疗或妊娠等禁忌证;⑥患者充分知情同意。对于LS-EC患者是否可以接受保留生育治疗,目前尚未达成共识。Ingrid等报道了2例接受保留生育治疗的G1ⅠA期LS-EC患者,其中1例达到完全缓解后自然妊娠并活产,另1例达到完全缓解后借助体外受精(IVF)妊娠并活产。郑莹等报道了1例接受保留生育功能治疗的子宫内膜不典型增生(atypical endometrial hyperplasia,AEH)合并林奇综合征的患者,经保留生育治疗后达完全缓解。欧洲妇科肿瘤学会(ESGO)/欧洲人类生殖与胚胎学会(ESHRE)/欧洲妇科内镜学会(ESGE)《子宫内膜癌保留生育功能治疗指南》提出林奇综合征患者可能同时具有高雌激素状态,这可能是导致子宫内膜癌的原因,并且可以用孕激素治疗。同时该指南也提出保留生育治疗在错配修复缺陷(MMR-D)型患者中更可能出现抵抗和复发,此时宫腔镜手术切除病灶对治疗效果至关重要。《林奇综合征相关性子宫内膜癌筛查与防治中国专家共识(2023年版)》指出LS-EC并非保留生育治疗的绝对禁忌,但需给患方充分知情告知并选择个体化的保留生育功能治疗策略。由于具有肿瘤遗传发病风险,一般不推荐或慎重推荐选择保留生育功能治疗。
陈思敬(妇科主治医师):目前分子分型对子宫内膜癌全面分期手术患者的预后评估和辅助治疗方案选择具有重要的指导意义。但不同分子分型子宫内膜癌患者保留生育功能治疗的临床价值仍在探索,并不清楚。ESGO/ESHRE/ESGE指南基于Pro Mis E的分子分型方法,将患者分为POLE突变(POLEmut)型、MMR-D型、p53突变(p53abn)型、p53野生(p53wt)型。MMR-D型占子宫内膜癌的20%~30%。
在子宫内膜癌MMR-D型保留生育治疗研究中,郑莹等报道了一项针对80例保留生育治疗的子宫内膜癌患者的分子特征进行分析,结果显示MMR-D型患者需要最长的中位治疗时间才能达到完全缓解,多因素分析中MMR-D型是影响累积完全缓解率的不良因素。劭裕文等分析了不同分子特征对子宫内膜癌和AEH患者保留生育功能治疗结局的影响。该研究发现子宫内膜癌和AEH患者的分子分型分布特征相似,共计纳入171例患者,其中MMR-D型9例,结果显示MMR-D型患者的1年累积复发率高于p53wt型患者;中位复发时间短于p53wt型患者。多因素分析中MMR-D型是影响子宫内膜癌和AEH患者复发的独立危险因素。Chung等研究了57例采用高效孕激素治疗的子宫内膜癌患者,其中MMR-D型9例、p53wt型45例,中位随访时间38.4月,结果显示MMR-D型患者完全缓解率和部分缓解率均明显低于p53wt型,6个月时MMR-D型患者完全缓解率为11.1%,而p53wt型患者完全缓解率为53.3%,该研究结果提示MMR-D型患者可能对孕激素治疗的反应较差。Catena等从69例保留生育功能治疗的子宫内膜癌和AEH患者中筛选出6例MMR-D型患者,其中3例基因检测确诊林奇综合征,所有确诊林奇综合征实用妇产科杂志2025年4月第41卷第4期 Journal of Practical Obstetrics and Gynecology2025Apr.Vol.41,No.4
的患者都达完全缓解,然而没有1例妊娠,所有患者均疾病复发,这突出了林奇综合征对AEH和子宫内膜癌结果的不利影响。总之,MMR-D型患者目前应谨慎施予保留生育治疗并严密随访,由于林奇综合征可能对AEH和子宫内膜癌保留生育治疗结果有不利影响,未来应将MMR-D型中林奇综合征和MLH1高甲基化分开研究,且由于目前MMR-D型保留生育治疗纳入的病例较少,其研究结论的可靠性需要进一步扩大样本量来验证。
杨帆(妇科副主任医师):LS-EC超适应证保留患者生育功能是非常具有挑战性的,除了达到疾病的缓解,还要重视疾病对子代的影响。林奇综合征主要由MMR基因中的1个或多个基因胚系突变导致,并以常染色体显性方式遗传。林奇综合征患者的每个子女都有50%的机会遗传林奇综合征相关的致病性变异。为降低后代再发风险,可以对此类家庭进行产前和胚胎植入前基因检测。PGT是一种先进的辅助生殖技术,通过在胚胎移植前对胚胎进行遗传学检测,筛选出无遗传病的胚胎进行移植,从而降低子代遗传病的风险。PGT主要包括以下几种类型:胚胎植入前非整倍体检测(PGT-A)、PGT-M、胚胎植入前染色体结构重排检测(PGT-SR)。在进入PGT-M周期前,需要进行预试验。目前对于家系完整的患者临床上推荐采用致病基因突变位点的直接检测联合遗传多态位点(SNP/STR)连锁分析构建单体型以确保检测结果的准确性,避免因等位基因脱扣(allele dropout,ADO)导致的误诊。而对于家系样本不全或新发突变的患者,常规的家系连锁分析方法无法成功构建单体型。近年来,三代测序技术因其单分子检测与长读长测序等特点,可被用于PGT-M中进行直接单体型构建,为家系样本不全或新发突变的患者进行PGT-M提供了可行方案。最后,PGT-M的准确率并非百分之百,且胚胎活检的细胞可能不能完全代表整个胚胎的情况,因此即使通过PGT-M选择了正常胚胎,妊娠后仍需进行产前诊断来确认胎儿是否携带致病突变。
郑莹(妇科主任医师):本病例为LS-EC保留生育治疗成功的案例(虽未活产但妊娠2次),从本例患者的诊断和治疗可以总结以下经验:①LS-EC不是保留生育功能的绝对禁忌证,虽其与散发性子宫内膜癌发病机制不同,但LS-EC患者可能同时具有高雌激素状态,孕激素治疗可以逆转子宫内膜病变,可以在患者充分知情同意后考虑尝试保留生育治疗。②LS-EC超适应证保留生育功能是非常具有挑战性的,需要多学科诊疗。MDT团队涵盖妇科恶性肿瘤、辅助生殖、生殖内分泌、放射、病理、医学遗传等多个学科的专家,需要从专业角度对患者进行全面评估,结合多学科意见,为患者制定个性化的治疗方案。③2023年FIGO分期建议,所有子宫内膜癌患者均应完善分子分型检测,MMR-D型患者是否能接受保留生育治疗尚有争议,目前应谨慎施予保留生育治疗并严密随访。④林奇综合征具有子代遗传风险,可选择PGT-M助孕。针对新发突变和家系样本采集不全的患者,常规的家系连锁分析方法无法成功构建单体型,三代测序PGT-M可提供有效的替代方案。⑤LS-EC患者的妊娠率及活产率相对较低,其生育力管理需贯穿疾病治疗全程。在保留生育功能治疗前,应系统评估患者的卵巢储备及生育潜能;治疗过程中需通过精细化的宫腔镜手术操作最大程度保护子宫内膜功能;而在疾病达到完全缓解后,则需通过延长无疾病复发期来实现生育目标。值得注意的是,延长无疾病复发期期间须建立规范的肿瘤随访体系,通过定期监测肿瘤标志物、影像学评估及妇科检查 等手段实现早期复发预警。同时应强调,随访期间需对林奇综合征相关异时性肿瘤进行监测。
等手段实现早期复发预警。同时应强调,随访期间需对林奇综合征相关异时性肿瘤进行监测。
综上所述,患者血液标本行MMR基因胚系突变检测,是目前诊断林奇综合征的金标准。LS-EC不是保留生育的绝对禁忌证,如患者及家属充分知情同意后仍有强烈保留生育意愿,可实施保留生育治疗。保留生育治疗达到完全缓解后,应尽快妊娠。PGT-M可以降低子代发生林奇综合征的风险。
参考文献略。
来源:尹苑麟,郑莹,彭诗意,等.林奇综合征相关性子宫内膜癌患者保留生育治疗病案讨论[J].实用妇产科杂志,2025,41(04):288-291.
