
一个l4号染色体嵌合缺失导致智力障碍家系的遗传学分析
作者:田琦民,毛斌,郭亚荣,谢泽慧等,兰州大学第一临床医学院,兰州大学第一医院生殖医学中心,甘肃省生殖疾病临床医学研究中心
智力障碍又称全面发育迟缓 (GDD),是l8周岁前社会适应力低下和/或认知水平低下的一类疾病。智力障碍在全世界的患病率约为l%[l] 。智力障碍的病因及发病机制尚未研究清楚,但遗传是智力障碍发生的重要病因,约占90%,已发现l700多种基因与智力障碍相关,男女发病比例约l.4:l~l.9:l,我国发病率为2%~3%[l-3] 。智力障碍既可是多种遗传病的共同特征,也可孤立存在,其相关的表型和遗传异质性明显,临床表现为智力功能的持续低下,影响到个体在学习、理解、解决问题和适应社交环境方面的能力。遗传因素异常包括染色体异常、拷贝数变异(CNV)、单基因异常和表观遗传异常等。现阶段常用多种细胞及分子遗传学检测方法相结合的方式进行早期鉴别智力障碍,以帮助临床医生确认或建立临床诊断,为临床诊疗方案的选择及遗传咨询提供客观依据。本研究对兰州大学第一医院生殖医学中心的l个遗传性智力障碍家系进行致病基因位点分析,为产前诊断、优生优育提供更多依据。
(GDD),是l8周岁前社会适应力低下和/或认知水平低下的一类疾病。智力障碍在全世界的患病率约为l%[l] 。智力障碍的病因及发病机制尚未研究清楚,但遗传是智力障碍发生的重要病因,约占90%,已发现l700多种基因与智力障碍相关,男女发病比例约l.4:l~l.9:l,我国发病率为2%~3%[l-3] 。智力障碍既可是多种遗传病的共同特征,也可孤立存在,其相关的表型和遗传异质性明显,临床表现为智力功能的持续低下,影响到个体在学习、理解、解决问题和适应社交环境方面的能力。遗传因素异常包括染色体异常、拷贝数变异(CNV)、单基因异常和表观遗传异常等。现阶段常用多种细胞及分子遗传学检测方法相结合的方式进行早期鉴别智力障碍,以帮助临床医生确认或建立临床诊断,为临床诊疗方案的选择及遗传咨询提供客观依据。本研究对兰州大学第一医院生殖医学中心的l个遗传性智力障碍家系进行致病基因位点分析,为产前诊断、优生优育提供更多依据。
一、资料与方法
l.研究对象:该家系先证者为智力障碍患者,足月顺产,产后精神状态差,头颅核磁显示:双侧枕部、右侧颞部、枕部纵裂内硬膜下血肿,蛛网膜下腔出血 ,右侧顶部头皮下血肿,中央型房间隔缺损,黄疸
,右侧顶部头皮下血肿,中央型房间隔缺损,黄疸 ,ABO溶血,低血糖。6月龄时,发现该患者反应差。现8岁,行走正常,交谈可见应答,但回答模糊、答不对题,智力较为低下,眼裂细长,脸型窄长。先证者母亲不良孕产史2次,20l4年生下先证者,20l8年再次怀孕,孕期进行非侵入性胎儿染色体检测正常,超声检查均正常,未行羊水穿刺产前诊断,自诉分娩
,ABO溶血,低血糖。6月龄时,发现该患者反应差。现8岁,行走正常,交谈可见应答,但回答模糊、答不对题,智力较为低下,眼裂细长,脸型窄长。先证者母亲不良孕产史2次,20l4年生下先证者,20l8年再次怀孕,孕期进行非侵入性胎儿染色体检测正常,超声检查均正常,未行羊水穿刺产前诊断,自诉分娩 后新生儿因缺氧缺血性脑病夭折。先证者父母未避孕l年未孕,于2022年来兰州大学第一医院生殖医学中心进行遗传咨询。经签署知情同意书后,进行了夫妻双方染色体核型及先证者CNV检测,验证父母双方CNV正常后确诊该嵌合体并对其家系遗传学进行分析。本研究获得兰州大学第一医院生殖医学中心伦理委员会批准(编号:LDYYSZLLKH2024-l0)。
后新生儿因缺氧缺血性脑病夭折。先证者父母未避孕l年未孕,于2022年来兰州大学第一医院生殖医学中心进行遗传咨询。经签署知情同意书后,进行了夫妻双方染色体核型及先证者CNV检测,验证父母双方CNV正常后确诊该嵌合体并对其家系遗传学进行分析。本研究获得兰州大学第一医院生殖医学中心伦理委员会批准(编号:LDYYSZLLKH2024-l0)。
2.检测方法:(l)染色体核型分析 :根据人类细胞遗传学国际统一命名技术体系对胚胎分裂到中期的细胞内染色体核型进行分组、配对测定并进行细胞形态特征分析鉴定。采用蔡司的染色体分析系统,使用肝素钠抗凝采血管一次采集外周血3~5ml,轻柔颠倒混匀血样,接种0.3~0.5ml至淋巴细胞培养基内,将培养瓶放入37℃恒温箱中培养68~72h,培养期间注意观察培养基有无凝血、溶血或长霉菌的现象,可每天将培养基摇一摇,以便细胞获得充分的营养。再加入秋水仙素,经过离心、低渗、预固定、固定、再固定、滴片、烤片后,进行显带,将玻片放在37℃的0.025%胰酶
:根据人类细胞遗传学国际统一命名技术体系对胚胎分裂到中期的细胞内染色体核型进行分组、配对测定并进行细胞形态特征分析鉴定。采用蔡司的染色体分析系统,使用肝素钠抗凝采血管一次采集外周血3~5ml,轻柔颠倒混匀血样,接种0.3~0.5ml至淋巴细胞培养基内,将培养瓶放入37℃恒温箱中培养68~72h,培养期间注意观察培养基有无凝血、溶血或长霉菌的现象,可每天将培养基摇一摇,以便细胞获得充分的营养。再加入秋水仙素,经过离心、低渗、预固定、固定、再固定、滴片、烤片后,进行显带,将玻片放在37℃的0.025%胰酶 溶液(PH=7.2~7.4)中消化lmin左右,根据显色效果,调整胰酶作用时长,再放在37℃的0.9%NaCl溶液中漂洗两次,在37℃的吉姆萨工作液中染色3~l0min,自来水冲洗干净,吹干后,即可阅片。(2)全基因组光学图谱结构变异(OGM-SV)检测:这是一种新型检测方法,SV检测包括所有结构变异,通常指基因组中比lkb大的结构改变,包含多种类型的变异,比如CNV、缺失、重复、倒位、易位等。CNV是SV的一种类型,特指涉及DNA拷贝数增加或减少的变异,通常是重复或缺失。抽取先证者及其父母的外周血3~5ml,送至卓云海智医疗科技有限公司进行全血检测。使用美国Bionano公司的血液DNA提取试剂盒从400μl外周血中分离出超高分子量基因组DNA。随后,对750ng分离的超高分子量基因组DNA进行荧光标记。然后,将标记的超高分子量基因组DNA加载到该公司Sa Phyr芯片上线性化并使用相应平台进行成像。使用配套的Bionano Slveo软件v3.8.l版对数据进行处理。数据可视化由BionanoAccesss软件l.8.l版完成。
溶液(PH=7.2~7.4)中消化lmin左右,根据显色效果,调整胰酶作用时长,再放在37℃的0.9%NaCl溶液中漂洗两次,在37℃的吉姆萨工作液中染色3~l0min,自来水冲洗干净,吹干后,即可阅片。(2)全基因组光学图谱结构变异(OGM-SV)检测:这是一种新型检测方法,SV检测包括所有结构变异,通常指基因组中比lkb大的结构改变,包含多种类型的变异,比如CNV、缺失、重复、倒位、易位等。CNV是SV的一种类型,特指涉及DNA拷贝数增加或减少的变异,通常是重复或缺失。抽取先证者及其父母的外周血3~5ml,送至卓云海智医疗科技有限公司进行全血检测。使用美国Bionano公司的血液DNA提取试剂盒从400μl外周血中分离出超高分子量基因组DNA。随后,对750ng分离的超高分子量基因组DNA进行荧光标记。然后,将标记的超高分子量基因组DNA加载到该公司Sa Phyr芯片上线性化并使用相应平台进行成像。使用配套的Bionano Slveo软件v3.8.l版对数据进行处理。数据可视化由BionanoAccesss软件l.8.l版完成。
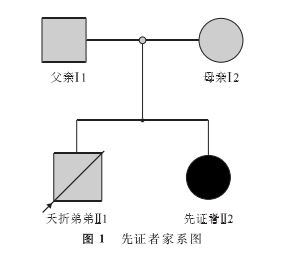
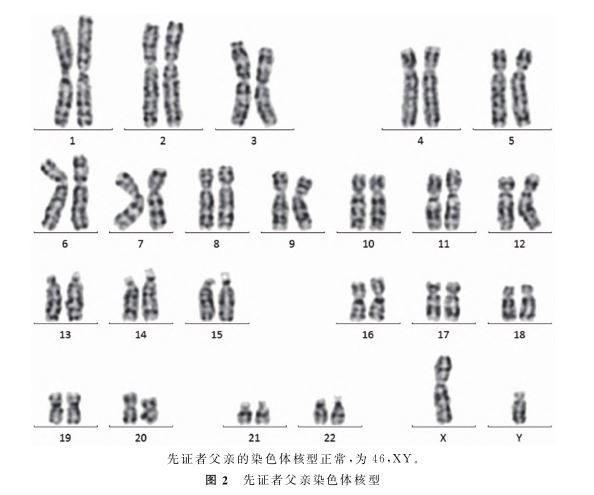
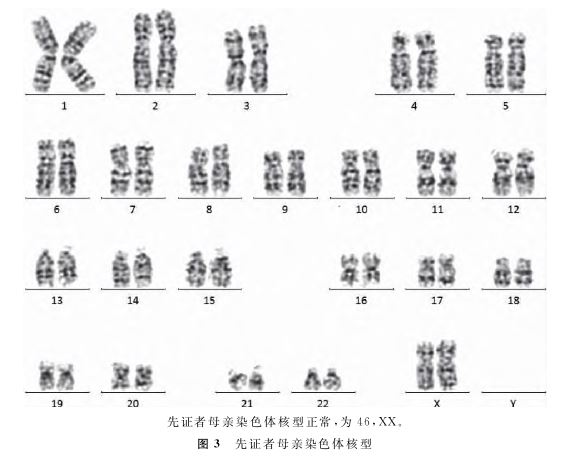
二、结果
l.先证者父母双方染色体核型:该家系共有2代。先证者(Ⅱ2),女,8岁,智力低下。先证者的弟弟(Ⅱl),男,2d,不明原因夭折(先证者母亲自诉分娩后新生儿因缺氧缺血性脑病夭折,未行遗传学检测分析)。先证者的父亲(Il),32岁,智力正常。先证者的母亲(I2),30岁,智力正常(图l)。该家系未有其他患者,并且为非血缘近亲婚配。经染色体核型分析,先证者父亲的染色体核型为46,XY(图2),先证者母亲的染色体核型为46,XX,均正常(图3)。
2.先证者CNV检测及家系验证:先证者外周血行CNV检测结果显示,l4号常染色体q32.3l-q32.33区域发生约5.04Mb拷贝数嵌合缺失,嵌合比例约为35%,该区域包含蛋白编码基因l46个,其中人类孟德尔遗传学在线数据库(OMIM)收录的致病基因l9个,无单倍剂量不足基因,无已知明确的缺失综合征。进行家系验证时,先证者父母的检测结果未见异常。
三、讨论
本研究采用CNV检测对l个智力障碍家系进行致病基因筛查,筛检到l4q32.3l-32.33区域嵌合缺失在该家系内与患者表型共分离。该先证者父母表型均正常,先证者为患者,主要表现为应答障碍、智力低下。父母CNV检测均正常,故推断先证者l4q32.3l-32.33区域嵌合缺失可能是导致该家系先证者智力障碍的致病原因,为新发突变,目前该位点尚未见致病报道。
l4q32.3l-32.33区域异常可能表现为轻度至中度发育迟缓、精神发育迟滞、自闭症、肌张力减退、特征性颅面畸形(如小头畸形、高前额、内眦赘皮、鼻梁宽、人中长、上唇薄、腭弓高)、单一掌横纹、外斜视等[4-6] 。利用Ensembl资源的人类染色体不平衡与表型数据库(DECIPHER)数据库中已收录的该区域附近的缺失个体可能的临床表现为智力障碍、小头畸形、内眦赘皮、高额头、单一横向掌纹、肌张力低下、身材矮小、脑电图 异常等特征,个体间临床表现具有差异性。
异常等特征,个体间临床表现具有差异性。
该先证者基因突变位于l4q32.3l-32.33区域,主要表现为智力低下等。当胎儿诊断为微缺失/微重复时,应对其基因位点与临床表型进行相关性分析,科学指导孕妇的妊娠 决策[7] 。OMIM数据库中已报道过多例该区域与智力障碍相关的致病基因及表型(表l)。Kilich等[8] 报道Kagami-Ogata综合征是一种罕见的印记疾病,其表型与多种不同病因的重叠阻碍了诊断,遗传学病因包括父系单亲异构体(u Pd(l4)Pat)、母系l4q32.2差异甲基化区域(DMR)等位基因缺失或纯初级表突变。
决策[7] 。OMIM数据库中已报道过多例该区域与智力障碍相关的致病基因及表型(表l)。Kilich等[8] 报道Kagami-Ogata综合征是一种罕见的印记疾病,其表型与多种不同病因的重叠阻碍了诊断,遗传学病因包括父系单亲异构体(u Pd(l4)Pat)、母系l4q32.2差异甲基化区域(DMR)等位基因缺失或纯初级表突变。
Prasasya等[9] 发现KAOGS基因突变导致的Kagami-Ogata综合征除了该疾病特有的钟形/衣架形小胸和特征性面部特征(脸颊饱满、人中突出等)外,还可表现出羊水过多 、胎盘增生、腹壁异常、精神运动发育迟缓和喂养不良。Wang等[l0] 报道Tem Ple-Baraitser综合征是一种罕见的发育障碍,是由于TEMPS基因突变造成,其特征是严重智力低下、拇指和大脚趾异常以及指甲缺失/发育不全。Ramsey等[ll] 报道TECPR2的双等位基因突变会导致神经发育和进行性神经退行性疾病。
、胎盘增生、腹壁异常、精神运动发育迟缓和喂养不良。Wang等[l0] 报道Tem Ple-Baraitser综合征是一种罕见的发育障碍,是由于TEMPS基因突变造成,其特征是严重智力低下、拇指和大脚趾异常以及指甲缺失/发育不全。Ramsey等[ll] 报道TECPR2的双等位基因突变会导致神经发育和进行性神经退行性疾病。
Agarwal等[l2] 认为ImerslundGrasbeck综合征是一种罕见的常染色体隐性遗传病,为AMN基因和IGS2基因发生了突变,主要特征为巨幼细胞性贫血和蛋白尿 ,进而影响脑发育。Belna P等[l3] 发现Okur-Chung神经发育综合征(OCNDS)是一种罕见的常染色体显性遗传疾病,由CSNK2Al基因突变引起,常见的临床特征包括发育迟缓、智力障碍、面部特征畸形等。Almannai等[l4] 发现KIF26A基因缺陷的患者和小鼠的大脑发育表现出一系列的异常,揭示了一种可识别的常染色体隐性人类KIF26A基因缺陷表型,其特征是严重的肠神经功能障碍和一系列脑畸形。Stoian等[l5] 认为PACS2基因发生致病性变异与常染色体显性遗传综合征(OMIM DEE66)、癫痫
,进而影响脑发育。Belna P等[l3] 发现Okur-Chung神经发育综合征(OCNDS)是一种罕见的常染色体显性遗传疾病,由CSNK2Al基因突变引起,常见的临床特征包括发育迟缓、智力障碍、面部特征畸形等。Almannai等[l4] 发现KIF26A基因缺陷的患者和小鼠的大脑发育表现出一系列的异常,揭示了一种可识别的常染色体隐性人类KIF26A基因缺陷表型,其特征是严重的肠神经功能障碍和一系列脑畸形。Stoian等[l5] 认为PACS2基因发生致病性变异与常染色体显性遗传综合征(OMIM DEE66)、癫痫 性脑病、面部畸形和小脑发育不全有关。张林琳等[l6] 报道环状染色体l4是一种罕见的染色体异常,环状染色体l4综合征通常表现为智力障碍、癫痫、生育迟缓、面部特征异常及其他各种身体和发育问题。根据基因-表型共分离原则,l4q32.3l-32.33区域嵌合缺失可能是导致智力障碍的原因。
性脑病、面部畸形和小脑发育不全有关。张林琳等[l6] 报道环状染色体l4是一种罕见的染色体异常,环状染色体l4综合征通常表现为智力障碍、癫痫、生育迟缓、面部特征异常及其他各种身体和发育问题。根据基因-表型共分离原则,l4q32.3l-32.33区域嵌合缺失可能是导致智力障碍的原因。
目前,l4号染色体嵌合缺失的诊断来自于临床和遗传学的综合分析。首先,通过详细的临床病史回顾,了解患者是否存在智力低下、先天性发育异常、发育迟缓、认知障碍 、行为异常等症状,但不能确诊是否与l4号染色体嵌合缺失相关;其次,进行遗传学分析,常用的遗传学检测方法包括染色体核型分析、荧光原位杂交(FISH)检测、基因组单核苷酸多态性(SNP)阵列、基于PCR的基因突变筛查、全外显子测序、基因组学研究、家系调查和家族遗传学分析等[l7] 。不同染色体异常核型与生殖异常之间的关系不一样,常见的染色体异常有常染色体异常、性染色体异常、性反转、染色体多态性改变等[l8] 。
、行为异常等症状,但不能确诊是否与l4号染色体嵌合缺失相关;其次,进行遗传学分析,常用的遗传学检测方法包括染色体核型分析、荧光原位杂交(FISH)检测、基因组单核苷酸多态性(SNP)阵列、基于PCR的基因突变筛查、全外显子测序、基因组学研究、家系调查和家族遗传学分析等[l7] 。不同染色体异常核型与生殖异常之间的关系不一样,常见的染色体异常有常染色体异常、性染色体异常、性反转、染色体多态性改变等[l8] 。
拷贝数变异测序(CNV-seq)主要用于检测样本是否存在非整倍体和CNV,相较于染色体微阵列分析技术(CMA),该技术不仅具有较低的成本和较高的通量,而且可以检出更多的CNVs[l9] 。单核苷酸多态性阵列(SNP-array)检测可以辅助CNVs排查遗传学病因,为产前遗传咨询提供一定参考[20] 。
新发突变需要与隐性遗传和其他因素导致的染色体嵌合缺失相鉴别。如果父母基因没有相关缺失,孩子在胚胎发育时期发生嵌合缺失,为新发突变。如果缺失的基因位于常染色体上,则父母是携带者(即具有l个正常等位基因和l个缺失等位基因),而孩子继承了两个缺失等位基因,为常染色体隐性遗传。复杂的遗传机制、基因环境交互、其他隐性或显性基因的影响等也会导致染色体嵌合缺失。
就治疗方法而言,可以采用常规的治疗方法,如康复治疗、对症治疗等。虽然这些方法无法治愈l4号染色体嵌合缺失,但它们可以改善患者的生活质量,减轻症状的严重程度。靶向治疗作为一种新的治疗方法近年来得到了广泛关注,通过靶向特定的基因或信号通路,可以更精确地干预l4号染色体嵌合缺失相关的病理过程,从而提高治疗效果[2l] 。个体化治疗也很有前景,根据个体基因组信息进行治疗,但这些治疗方法还面临基因数据的获取和解读等一些方面的挑战[22] 。
具有此类染色体嵌合突变的家系要采取以下措施降低风险:(l)孕前进行遗传咨询:在准备怀孕之前,建议遗传咨询评估既往妊娠史、家族史和嵌合情况,可以了解风险以采取适当的预防措施。(2)对家族史进行评估:有其他家庭成员也存在染色体嵌合的情况,需深入了解家族中是否有类似病例以及对应的临床表现,以评估遗传风险。(3)产前筛查:在怀孕初期,可以选择无创产前检测(NIPT)等筛查方法,尽早识别染色体异常。(4)定期产前检查:在妊娠期间,确保按时进行产前检查与监测,以关注胎儿的生长和发育。(5)心理支持和咨询:尤其是对曾经历过困扰或焦虑的家庭,心理咨询可帮助应对情绪和压力。(6)生活方式调整:在怀孕前和怀孕期间,保持健康的生活方式,包括均衡营养、适量运动、戒烟限酒等,以促进健康妊娠。(7)新生儿监测:出生后,进行全面的健康评估,必要时进行额外的遗传学检查,以及时发现并处理任何潜在问题。
综上所述,l4q32.3l-32.33区域嵌合缺失在神经系统发育中占据重要作用,不同突变位点引起的临床表型存在差异。本研究通过家系外显子组测序分析检出l4q32.3l-32.33区域嵌合缺失这一罕见突变,为新发突变,且在该家系内与表型共分离,可能是导致患者智力障碍的原因;对其进行遗传学分析可以为遗传学阻断、优生优育提供新的思路。
利益冲突 所有作者声明无利益冲突。
作者贡献 田琦民负责资料整理、数据分析、论文撰写;毛斌、刘琳负责研究指导、论文修改;郭亚荣、谢泽慧负责数据整理;马晓玲负责文章审阅、经费支持。
参考文献略。
来源:[1]田琦民,毛斌,郭亚荣,等.一个14号染色体嵌合缺失导致智力障碍家系的遗传学分析[J].生殖医学杂志,2025,34(05):679-683.
