
CAMK2A基因变异致常染色体显性智力发育障碍53型一例
作者:郝重阳,刘万超,金紫荷,刘丽颖等,承德医学院,沧州市人民医院儿科
2017年有研究提出CAMK2A(calcium/calmod-ulin-dependent protein kinaseⅡ-alpha)基因(OMIM:114078)变异可致常染色体 显性智力发育障碍
显性智力发育障碍 53型(mental retardation,autosomal dominant 53,MRD53)[ 1] 。
53型(mental retardation,autosomal dominant 53,MRD53)[ 1] 。
其临床可表现为智力障碍、癫痫 发作、行为异常、全面性发育迟缓
发作、行为异常、全面性发育迟缓 和肌张力
和肌张力 减退等。现报告1例表现为智力障碍、癫痫发作和行为异常的MRD53患儿,是因CAMK2A基因外显子11由胞嘧啶(C)变为胸腺嘧啶(T),导致精氨酸
减退等。现报告1例表现为智力障碍、癫痫发作和行为异常的MRD53患儿,是因CAMK2A基因外显子11由胞嘧啶(C)变为胸腺嘧啶(T),导致精氨酸 变为半胱氨酸的新发错义突变引起的。以期通过该病例提高临床医生对MRD53的认识,为患儿家庭提供遗传咨询和优生优育指导。
变为半胱氨酸的新发错义突变引起的。以期通过该病例提高临床医生对MRD53的认识,为患儿家庭提供遗传咨询和优生优育指导。
1病例报告
患儿男,9岁2个月,因间断抽搐6年余,行为异常4年余,于2022年2月17日就诊于沧州市人民医院小儿神经专病门诊。患儿系其母第2胎第2产,单卵双胎,孕36周早产 ,出生时哭声响亮,Apgar评分不详,出生体质量2 600 g,另一胎胎死宫内。患儿3个月龄会抬头,7个月龄会坐,16个月龄会走,1岁会喊爸妈,后语言发育落后,目前口齿不清。患儿1岁时因先天性斜视行手术治疗。家族史未见异常,父母均体健。患儿2岁10个月起病,以癫痫发作为主,表现为刚入睡出现全身抖动、口角抽动、流涎、咬牙、呼之不应,持续约1~2 min缓解,数天至1周发作1次,2015年10月就诊于北京大学第一医院,视频脑电图
,出生时哭声响亮,Apgar评分不详,出生体质量2 600 g,另一胎胎死宫内。患儿3个月龄会抬头,7个月龄会坐,16个月龄会走,1岁会喊爸妈,后语言发育落后,目前口齿不清。患儿1岁时因先天性斜视行手术治疗。家族史未见异常,父母均体健。患儿2岁10个月起病,以癫痫发作为主,表现为刚入睡出现全身抖动、口角抽动、流涎、咬牙、呼之不应,持续约1~2 min缓解,数天至1周发作1次,2015年10月就诊于北京大学第一医院,视频脑电图 示:双侧Rolandic区棘波、棘慢波、多棘慢波发放,睡眠期为著;血常规
示:双侧Rolandic区棘波、棘慢波、多棘慢波发放,睡眠期为著;血常规 、肝肾功能、血糖、血脂、电解质、血氨
、肝肾功能、血糖、血脂、电解质、血氨 大致正常;血尿
大致正常;血尿 代谢筛查提示线粒体能量代谢障碍、非酮症性双羧酸尿症、生物素缺乏及营养障碍;智力测验:总智商
代谢筛查提示线粒体能量代谢障碍、非酮症性双羧酸尿症、生物素缺乏及营养障碍;智力测验:总智商 ≤45。诊断为:癫痫;局灶性发作;智力障碍。予口服丙戊酸钠
≤45。诊断为:癫痫;局灶性发作;智力障碍。予口服丙戊酸钠 口服液,10 mL/次,每日2次,根据患儿发作次数及形式调整药物及剂量,病情控制良好,动态复查肝肾功能及视频脑电图。患儿5岁出现行为异常,表现为反应减低、无目的跑动、转圈,伴自言自语或不自主发声,于2018年8月就诊于北京大学第一医院,视频脑电图示:双侧Rolandic区及中线区(Cz、Pz)棘波、棘慢波、多棘慢波发放,睡眠期为著,非快速眼动睡眠期放电指数75%。加用氯硝西泮
口服液,10 mL/次,每日2次,根据患儿发作次数及形式调整药物及剂量,病情控制良好,动态复查肝肾功能及视频脑电图。患儿5岁出现行为异常,表现为反应减低、无目的跑动、转圈,伴自言自语或不自主发声,于2018年8月就诊于北京大学第一医院,视频脑电图示:双侧Rolandic区及中线区(Cz、Pz)棘波、棘慢波、多棘慢波发放,睡眠期为著,非快速眼动睡眠期放电指数75%。加用氯硝西泮 (具体剂量不详),予口服丙戊酸钠口服液加量至12 mL/次,每日2次,发作次数较前减少。
(具体剂量不详),予口服丙戊酸钠口服液加量至12 mL/次,每日2次,发作次数较前减少。
2022年2月17日查体:身高130 cm,体质量30 kg,神志清,精神反应可,营养中等,特殊面容(双眼外眦下斜、眼距宽),周身未见色素脱失斑、牛奶咖啡斑及血管瘤 等,心肺腹查体未见异常;四肢肌力、肌张力正常,腱反射正常存在,病理征及脑膜刺激征
等,心肺腹查体未见异常;四肢肌力、肌张力正常,腱反射正常存在,病理征及脑膜刺激征 均阴性;智力发育落后,语速及反应慢,计算力及记忆力差。2022年2月18日视频脑电图示:睡眠期右侧中央、顶区棘波、棘慢波发放。
均阴性;智力发育落后,语速及反应慢,计算力及记忆力差。2022年2月18日视频脑电图示:睡眠期右侧中央、顶区棘波、棘慢波发放。
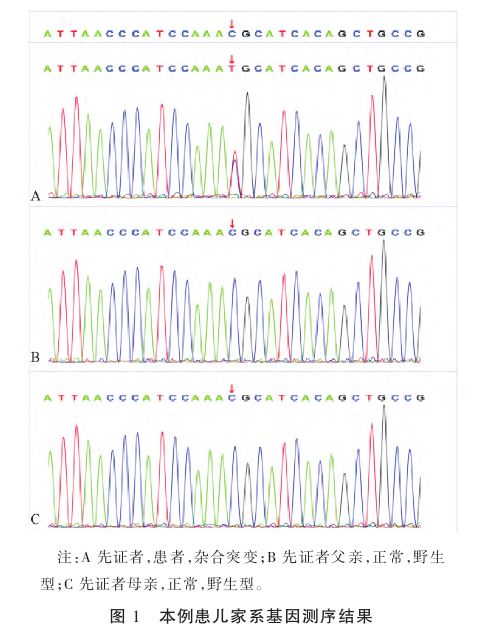
该患儿无癫痫发作家族史,为明确诊断,经家属知情同意后,采集先证者及其父母外周血进行全外显子组测序(北京智因东方转化医学研究中心有限公司)。结果显示患儿携带CAMK2A基因c.775(exon11)C>T杂合变异,突变位点为5号染色体,外显子11由C变为T,导致精氨酸变为半胱氨酸[p.R259C(p.Arg259Cys)(NM_001363989)],其父母均未发生变异(见图1),该突变为新发突变。根据美国医学遗传学与基因组学学会(American College of Medical Genetics and Genomics,ACMG)《遗传变异分类标准与指南》,该变异初步判定为致病性变异(PS2+PM1+PM2+PP2+PP3)。强致病证据PS2:患儿父母该位点无变异,此变异为新发突变;中等致病证据PM1:错义变异位于致病热点区(突变左右10 bp范围内存在3个以上有害突变)或CCR区域(constrained coding regions);中等致病证据PM2:在所有正常人群数据库中变异频率小于0.000 5;支持致病证据PP2:GnomAD(Genome AggregationDatabase)数据库中针对错义突变的Z评分≥3.09的基因(评分越高表示相应基因转录本更为保守,发生错义突变后致病的可能性越大);支持致病证据PP3:两种统计方法预测变异会对基因或基因产物功能造成有害影响。
2讨论
CAMK2A基因编码钙/钙调蛋白依赖性蛋白激酶Ⅱ(CAMKⅡ)的亚基,CAMKⅡ是一种丝氨酸 /苏氨酸激酶,是一种寡聚蛋白,由不同但相关的亚基α、β、γ和δ组成,每个亚基由1个单独的基因编码,在大脑中含量丰富,尤其是在突触后密度(post-synaptic density,PSD)中。CAMKⅡ形成由4个基因(CAMK2A、CAMK2B、CAMK2G和CAMK2D)编码的4种同工型(a、b、c、d)的同聚或异聚十二聚体[2-3] ,当Ca2 + 结合的钙调蛋白(Ca2+ /CaM)随着细胞内Ca2+ 升高而增加时,Ca2+ /CaM与调节片段的结合使调节片段与激酶结构域分离,随后发生Thr286/287自磷酸化,产生了具有完全活性的自磷酸化CAMKⅡ,可导致CAMK2A功能障碍,从而引起神经发育障碍性疾病的发生,包括焦虑和抑郁、癫痫、孤独症谱系障碍
/苏氨酸激酶,是一种寡聚蛋白,由不同但相关的亚基α、β、γ和δ组成,每个亚基由1个单独的基因编码,在大脑中含量丰富,尤其是在突触后密度(post-synaptic density,PSD)中。CAMKⅡ形成由4个基因(CAMK2A、CAMK2B、CAMK2G和CAMK2D)编码的4种同工型(a、b、c、d)的同聚或异聚十二聚体[2-3] ,当Ca2 + 结合的钙调蛋白(Ca2+ /CaM)随着细胞内Ca2+ 升高而增加时,Ca2+ /CaM与调节片段的结合使调节片段与激酶结构域分离,随后发生Thr286/287自磷酸化,产生了具有完全活性的自磷酸化CAMKⅡ,可导致CAMK2A功能障碍,从而引起神经发育障碍性疾病的发生,包括焦虑和抑郁、癫痫、孤独症谱系障碍 等[4-6] 。
等[4-6] 。
2.1 CAMK2A基因与MRD53通过检索万方数据库知识服务平台、中国知网、维普网、PubMed,检索时间为建库至2024年11月,共检索到3篇文献共19例CAMK2A基因杂合突变的MRD53病例,其中18例新发变异,1例患者为父系DNA缺失;共有11个错义变异(包括1个在3例患者中发现的复发变异),3个剪接位点变异(包括1个在2例患者中发现的复发变异),1个移码变异[1,3,7] 。CAMK2A在突触可塑性、学习和记忆中起关键作用,其基因变异可伴随发育迟滞、智力障碍和行为异常等问题的出现。另外,CAMK2A包括1个激酶结构域、1个调控结构域和1个关联结构域。到目前为止,大多数报道的错义突变都集中在激酶结构域[7] ,本研究中的Arg259Cys突变位点也在该区域。
2.2 CAMK2A基因与神经发育障碍性疾病CAMK2A变异体影响激酶活性的自动抑 制并增加Thr286/287的自磷酸化,具有自磷酸化活性的CAMKⅡ生成增多,从而增强其不依赖于Ca2+ 的活性,影响神经发育。Akita等[3] 对976例智力残疾、癫痫和(或)发育迟缓患者进行全外显子组测序,共发现3例CAMK2A变异体,癫痫发作是3例患者共有的临床表现,患者1为c.635C>A,3个月龄时癫痫发作,为局灶性阵挛发作伴呼吸暂停,存在身高发育落后及小头畸形;患者2为c.704C>T,4个月龄时癫痫发作,为局灶性发作伴呼吸暂停,存在心律失常 及身高发育落后;患者3为c.817-1G>A,3个月龄时癫痫发作,表现为眼睛偏向左侧,呈紧张性角弓反张姿势,存在肌张力减退,进行性小脑萎缩,存在身高发育落后。Stephenson等[6] 报告1例孤独症谱系障碍患者存在CAMK2A基因突变,为p.Glu183Val变异体,Glu183Val变异体可减少CAMKⅡ底物磷酸化,异聚体变异体和野生型CAMK2A的Thr286/287自磷酸化水平均降低,这表明该突变体以显性-负性方式起作用。海马神经元中Glu183Val突变体破坏了树突形态和突触传递,表明CAMK2A活性受损与神经发育表型相关[8] 。
及身高发育落后;患者3为c.817-1G>A,3个月龄时癫痫发作,表现为眼睛偏向左侧,呈紧张性角弓反张姿势,存在肌张力减退,进行性小脑萎缩,存在身高发育落后。Stephenson等[6] 报告1例孤独症谱系障碍患者存在CAMK2A基因突变,为p.Glu183Val变异体,Glu183Val变异体可减少CAMKⅡ底物磷酸化,异聚体变异体和野生型CAMK2A的Thr286/287自磷酸化水平均降低,这表明该突变体以显性-负性方式起作用。海马神经元中Glu183Val突变体破坏了树突形态和突触传递,表明CAMK2A活性受损与神经发育表型相关[8] 。
本例患儿出现CAMK2A基因c.775(exon11)C>T杂合变异,临床上表现为癫痫发作、智力及行为异常,以上均表明CAMK2A基因在神经系统发育中具有重要作用。
2.3 CAMK2A基因或可作为MRD53的治疗靶点目前MRD53尚无特效药物治疗,主要为对症支持治疗,基因测序发现的基因变异或为治疗相关研究提供新思路和新方向。研究显示,CAMK2A基因可作为治疗疾病的一个潜在靶点,其过表达减少了肌肉组织中Ca2+ 的积累,导致肌肉湿重比例升高、肌纤维横截面积增大,并使肌肉组织中的胶原沉积显著减少,表明CAMK2A可以减轻肌肉细胞中的钙超载,改善去神经性肌萎缩,CAMK2A可能成为去神经性肌萎缩的一个关键调节靶点[9] 。未来可从CAMK2A基因对神经发育的作用着手,进一步深入研究其对癫痫、发育迟缓等MRD53相关症状的靶向治疗。
综上,本病例丰富了CAMK2A基因突变谱,体现了基因检测在MRD53诊断中的价值。MRD53作为罕见的常染色体显性遗传性疾病之一,主要由CAMK2A基因突变所导致,其临床表型多样,主要特征是内眦赘皮、眼距过宽、斜视、睑裂下斜、智力障碍、癫痫发作、全面性发育迟缓、全身性肌张力减退、失语和运动发育迟缓。临床医生应提高对该病的认识,给予对症支持治疗,对于癫痫发作主要应用抗癫痫发作药物治疗,对于发育及行为障碍应及时进行精准的康复训练。针对MRD53患儿的家庭,即使先证者基因检测为新发突变,在生育下一胎时也建议行遗传学检测,达到精准诊断的同时做到优生优育。
参考文献略。
来源:郝重阳,刘万超,金紫荷,等.CAMK2A基因变异致常染色体显性智力发育障碍53型一例[J].国际生殖健康/计划生育杂志,2025,44(03):201-203.
