
脊柱骨母细胞瘤继发动脉瘤样骨囊肿:1例
作者:三峡大学附属仁和 医院骨科 黄冲宇
医院骨科 黄冲宇
骨母细胞瘤(OB)是一种罕见的原发性骨肿瘤 ,约占所有原发性骨肿瘤的1%,占所有良性骨肿瘤的3%。1935年,Jaffe首次将OB描述为“骨母细胞瘤-骨样瘤”。1956年,Jaffe和Lich⁃tenstein分别独立地将其描述为“良性骨母细胞瘤”。1984年,Dorfman提出了“侵袭性骨母细胞瘤”的交界性成骨性肿瘤实体,并发现与高复发率和恶性转化潜能有关。据报道,10%~15%的OB中存在动脉瘤
,约占所有原发性骨肿瘤的1%,占所有良性骨肿瘤的3%。1935年,Jaffe首次将OB描述为“骨母细胞瘤-骨样瘤”。1956年,Jaffe和Lich⁃tenstein分别独立地将其描述为“良性骨母细胞瘤”。1984年,Dorfman提出了“侵袭性骨母细胞瘤”的交界性成骨性肿瘤实体,并发现与高复发率和恶性转化潜能有关。据报道,10%~15%的OB中存在动脉瘤 样骨囊肿(ABCs)。ABCs由Jaffe和Lichenstein于1942年首次在文献中描述,是一种罕见的侵袭性、扩张性和溶骨性病变,约占所有骨肿瘤的1%,约占所有原发性脊柱肿瘤的15%,有作者报道了33例脊柱ABCs病变主要位于胸椎(24.2%)和腰椎(33.3%)。与OB类似,ABCs最常累及脊柱后部结构;还可能延伸到椎体和椎管内。OB与ABCs同时出现在人群中相当罕见,当病变定位在腰椎时更为罕见。本文报道1例L3椎体OB继发ABCs的病例,并对相关文献进行综述。
样骨囊肿(ABCs)。ABCs由Jaffe和Lichenstein于1942年首次在文献中描述,是一种罕见的侵袭性、扩张性和溶骨性病变,约占所有骨肿瘤的1%,约占所有原发性脊柱肿瘤的15%,有作者报道了33例脊柱ABCs病变主要位于胸椎(24.2%)和腰椎(33.3%)。与OB类似,ABCs最常累及脊柱后部结构;还可能延伸到椎体和椎管内。OB与ABCs同时出现在人群中相当罕见,当病变定位在腰椎时更为罕见。本文报道1例L3椎体OB继发ABCs的病例,并对相关文献进行综述。
病例报道
患者女性,39岁,因“腰背部疼痛伴活动受限3周余,加重伴左足母趾麻木4d”入院,患者自诉3周前无明显诱因出现腰背部疼痛不适,劳动后加重,自行予以理疗后症状反复,4d前疼痛进行性加重伴左足麻木。患者既往体健,无特殊病史。入院查体:腰背部皮肤无红肿、破溃,脊柱未见明显畸形,脊柱腰段叩击痛(+),棘旁竖脊肌压痛(+),双下肢直腿抬高试验 (-),“4”字试验(-),足母趾麻木,双下肢肌力可,肌力5级,双下肢无感觉障碍,末梢血运可。背部疼痛视觉模拟评分(VAS)6分,入院后CT及腰椎MRI提示L3椎体附件骨质膨大,其内可见片状长T1、短T2信号影,边缘见不规则长T1、长T2信号影包绕,部分病灶内可见液-液平面,大小约3.0cm×2.1cm×1.2cm,相应水平硬膜囊受压,椎管变窄(图1a),考虑为骨纤维异常增殖症合并动脉瘤样骨囊肿可能,骨母细胞瘤或其他骨肿瘤待排。
(-),“4”字试验(-),足母趾麻木,双下肢肌力可,肌力5级,双下肢无感觉障碍,末梢血运可。背部疼痛视觉模拟评分(VAS)6分,入院后CT及腰椎MRI提示L3椎体附件骨质膨大,其内可见片状长T1、短T2信号影,边缘见不规则长T1、长T2信号影包绕,部分病灶内可见液-液平面,大小约3.0cm×2.1cm×1.2cm,相应水平硬膜囊受压,椎管变窄(图1a),考虑为骨纤维异常增殖症合并动脉瘤样骨囊肿可能,骨母细胞瘤或其他骨肿瘤待排。
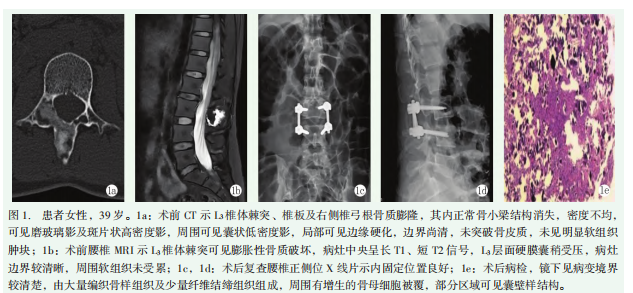
完善相关术前检查、术前评估,排除手术禁忌证,患者在全麻插管下行“L3椎体病灶切除+椎管减压+椎弓根螺钉内固定+同种异体骨植骨术”,术中可见L3棘突、椎板结构异常,形成囊性变,内含豆腐渣样松软组织,充分取出后送病检。病检提示镜下见病变境界较清楚,由大量编织骨样组织及少量纤维结缔组织组成,编织骨样组织排列密集,呈类圆形,周围有增生的骨母细胞被覆,编织骨样组织有少量分化尚好的纤维结缔组织,部分区域可见囊壁样结构(图1e),病检送上级医院复检,结果为骨母细胞瘤伴钙化,局部呈动脉瘤样骨囊肿改变。患者术后1个月后复查,X线片示内固定位置良好(图1c,1d)。免疫组化:CKpan(-)、Vimentin(+)、EMA(+)、Ki-67(Li约1%)、CD34(血管+)、SMA(灶+)、CD45(+)、CD68(部分+)、CD163(+)、Desmin(-)。患者术后复查未诉特殊不适,行走自如,背部VAS评分1分。
讨论和文献综述
OB可发生于任何年龄段,发病高峰年龄为10~30岁,男女比例为2∶1~2.5∶1。在脊柱OB中颈椎、胸椎和腰椎出现频率是相等的。OB可累及任何部位,但最常累及的部位是脊柱后部附件(36%~40%),尤其是在椎弓根和椎板,并可延伸至椎体,Versteeg等回顾性分析了102例脊柱OB,发现45%的肿瘤在椎体的前部和后部均有延伸。目前,OB在病理学上分为2个亚型,包括良性OB和上皮样OB。虽然脊柱上皮样OB是良性肿瘤,但常引起明显的骨质破坏、软组织浸润和硬膜外扩张,具有明显生物学侵袭性,故有些学者也将其称为恶性OB或侵袭性OB。WHO指出,上皮样OB的存在并不表明OB总是具有侵袭性的临床过程,所以更倾向于使用“上皮样OB”这一命名。有学者利用RNA测序方法,在上皮样OB细胞中首次鉴定了COL1A1-FYN融合基因,在后续的研究中发现了FOS-ANKH和FOS-RUNX2融合基因。骨样骨瘤和OB是形态相似的成骨性肿瘤,OB是有明确的中央钙化的肿瘤巢,由编织骨的骨小梁组成,内含饱满的圆形或卵圆形偏心核的成骨细胞,骨小梁排列整齐,中间有纤维血管基质,内含血管和破骨细胞。OB的直径通常>2cm,而骨样骨瘤的直径<1.5cm。ABCs最常见于20岁以下的患者,但已报道的年龄为2~69岁。ABCs分为两类:原发性病变(PABCs)和继发性病变(SABCs)。近70%的ABCs为原发性,其余30%继发于其他肿瘤,如骨母细胞瘤、巨细胞瘤、血管瘤 、骨肉瘤
、骨肉瘤 等,PABCs是一种独立的肿瘤,其中癌基因泛素特异性蛋白酶USP6参与了PABCs的形成,而SABCs可能是由于血液动力学异常引起静脉压升高,导致出血,或由潜在肿瘤变性的囊性改变引起的。
等,PABCs是一种独立的肿瘤,其中癌基因泛素特异性蛋白酶USP6参与了PABCs的形成,而SABCs可能是由于血液动力学异常引起静脉压升高,导致出血,或由潜在肿瘤变性的囊性改变引起的。
影像学评估 X线片是初步评估OB的首选,其典型表现为局限性、膨胀性圆形肿块,周围界限清楚,瘤体内常有斑点状或索状基质钙化或骨化影,混有溶骨性透亮影,病灶边缘常有明显的硬化环。50%的患者在X线片上无法观察到OB,仅以X线检查作为诊断手段,可能会导致误诊。但X线在脊柱侧弯 和后凸畸形的诊断中具有一定的优势。而ABCs在X线片上表现为皂泡样或气球样膨胀性改变。CT可精确定位瘤巢,其最优越的方面是其对细微钙化检测及骨质破坏类型的敏感性。OB最特征性CT表现是具有硬化壳的溶骨性膨胀性病变,其钙化在所有病变中均有发现。大多数OB在CT平扫
和后凸畸形的诊断中具有一定的优势。而ABCs在X线片上表现为皂泡样或气球样膨胀性改变。CT可精确定位瘤巢,其最优越的方面是其对细微钙化检测及骨质破坏类型的敏感性。OB最特征性CT表现是具有硬化壳的溶骨性膨胀性病变,其钙化在所有病变中均有发现。大多数OB在CT平扫 图像上呈低至等密度,而在ABCs中可以显示病灶内的液-液平面,另外,CT也存在对病变范围低估的缺陷。在MRI上,OB最显著的表现是反应性水肿
图像上呈低至等密度,而在ABCs中可以显示病灶内的液-液平面,另外,CT也存在对病变范围低估的缺陷。在MRI上,OB最显著的表现是反应性水肿 ,包括骨髓水肿、软组织水肿,MRI增强扫描可能有助于区分瘤巢和水肿。T1加权上表现为低等信号,T2加权上表现为中等至高强度信号,代表了此类病变的高度血管性质。特征性的瘤周水肿被描述为“耀斑现象”,是由肿瘤的广泛弥漫性、反应性炎症引起。同时,MRI可能高估病变的范围和肿瘤的恶性程度。虽然MRI在显示钙化方面不如CT,但在显示椎管内压迫、软组织侵犯等方面尤其有价值。ABCs在MRI表现上,T1加权像呈低信号,T2加权像呈高信号,内含液-液平面的囊性肿块。PET是评价OB最敏感的方法。也有学者认为全身骨扫描可以显示病灶部位有明显的放射性摄取聚集,是OB最敏感的诊断工具。虽然OB和ABCs的影像学特征已被独立描述,但没有将两种病变放在一起的影像学描述。总之,脊柱OB继发ABCs是一种罕见的肿瘤,具有一些独特的放射学特征。
,包括骨髓水肿、软组织水肿,MRI增强扫描可能有助于区分瘤巢和水肿。T1加权上表现为低等信号,T2加权上表现为中等至高强度信号,代表了此类病变的高度血管性质。特征性的瘤周水肿被描述为“耀斑现象”,是由肿瘤的广泛弥漫性、反应性炎症引起。同时,MRI可能高估病变的范围和肿瘤的恶性程度。虽然MRI在显示钙化方面不如CT,但在显示椎管内压迫、软组织侵犯等方面尤其有价值。ABCs在MRI表现上,T1加权像呈低信号,T2加权像呈高信号,内含液-液平面的囊性肿块。PET是评价OB最敏感的方法。也有学者认为全身骨扫描可以显示病灶部位有明显的放射性摄取聚集,是OB最敏感的诊断工具。虽然OB和ABCs的影像学特征已被独立描述,但没有将两种病变放在一起的影像学描述。总之,脊柱OB继发ABCs是一种罕见的肿瘤,具有一些独特的放射学特征。
发病机理与特点 目前关于OB继发ABCs的病因尚未明确。通过免疫组化分析,CD98在骨肿瘤中的表达以OB最高,发现60%~80%的OB显示FOS重排,FOS表达增加,可作为临床诊断的可靠标志物,并且以更高的分辨率分析并确定NF2基因是OB中22q12缺失的最有可能的靶点,NF2的缺失破坏了Hippo信号通路,这是破骨细胞形成和骨稳态的关键成分。研究表明,miR-135b-5p表达沉默PPM1E蛋白,激活AMPK抑制OB细胞增殖,可能是一个新的抗癌microRNA。在经典Wnt/β-catenin信号通路的自分泌激活被报道可以直接调节肿瘤的增殖,Wnt途径中的上游蛋白(wntless,WLS)在一些肿瘤中高表达,在涉及人和小鼠的体外遗传学研究表明,WLS在成骨细胞分化和骨矿化中起关键作用,所有的OB都可见YJ5(一种WLS特异性抗体)的强免疫反应性,ABCs显示YJ5免疫染色缺失/弱阳性。成骨细胞特异基因是一种新发现的转录因子,对成骨细胞分化和骨形成至关重要,其表达受Runx2蛋白控制,而成骨细胞特异基因和Runx2主要表达在最终分化为成骨细胞的线粒体膜细胞中,所以Runx2、成骨细胞特异基因在OB中呈强核表达。
临床表现 临床上,患者最常见的症状是持续的颈部或背部疼痛、椎旁肌肉僵硬,疼痛特征为夜间比白天轻的钝痛,并且这种疼痛对NSAIDs药物不敏感。由于OB的侵袭性和较大的体积累及椎间孔导致神经根受压和椎管狭窄 ,所以多达50%的患者可出现根性症状,表现为下肢麻木、神经根疼痛和异常感觉,甚至还可能出现截瘫。同时,脊柱侧弯是脊柱OB的常见表现,这种畸形可能是疼痛性脊柱侧弯,侧弯被认为是对疼痛的代偿反应,并迅速进展。这种现象最常见于胸椎和腰椎OB,大多数患者在适当的手术干预后,畸形改善或完全消失。由于脊柱OB的罕见性或非特异性症状,所以在病程的早期很少被诊断。ABCs患者常表现出的症状为非特异性、隐匿起病的疼痛、肿胀,部分病例出现病理性骨折
,所以多达50%的患者可出现根性症状,表现为下肢麻木、神经根疼痛和异常感觉,甚至还可能出现截瘫。同时,脊柱侧弯是脊柱OB的常见表现,这种畸形可能是疼痛性脊柱侧弯,侧弯被认为是对疼痛的代偿反应,并迅速进展。这种现象最常见于胸椎和腰椎OB,大多数患者在适当的手术干预后,畸形改善或完全消失。由于脊柱OB的罕见性或非特异性症状,所以在病程的早期很少被诊断。ABCs患者常表现出的症状为非特异性、隐匿起病的疼痛、肿胀,部分病例出现病理性骨折 。
。
治疗 手术治疗 对于脊柱OB继发ABCs保守治疗无效,主要是采用手术治疗。目前,OB的分期采用的是Enneking分期,分为3期:潜伏期(S1)、活跃期(S2)、侵袭期(S3)。对于Enneking分期的1期和2期病变应行完整的病灶内刮除,3期病变需要更广泛的整块全切除术,以确保切除所有受累的软组织,降低复发率,Lucas等对75例OB的分析和Versteeg等对73例OB分析发现病灶内切除术后总复发率为18%~19%,广泛切除术后复发率为20%。由于OB继发ABCs的高度血管性质和完整切除的重要程度,术前接受了栓塞治疗,再进行肿瘤切除和脊柱内固定,这样显著减少了术中出血量,提供了清晰的术中视野,有助于完整的手术切除。同时,随着显微镜技术在脊柱外科的应用,也为脊柱外科医生能完整切除肿瘤,减少硬脊膜破裂损伤、神经副损伤提供了可能。
近些年来,随着计算机导航技术和手术机器人在脊柱外科的普及,运用术中三维实时导航系统辅助置钉可提高椎弓根螺钉置入的精确率,降低手术风险,减少手术时间,因此,对精确定位和引导肿瘤完整切除非常有用。CT引导下的射频消融被认为是治疗OB的金标准。目前在临床上应用消融技术包括经皮射频热消融、激光热消融、冷冻消融。经皮射频热消融技术是利用穿刺针经皮穿刺放置在病灶中心,产热引起肿瘤蛋白质变形、凝固性坏死。但同时也有一定的局限性,当肿瘤与神经非常接近时,必须考虑热细胞毒性对脊髓和神经根的危害。与这一机制相反,冷冻消融以快速冷却为机制,造成渗透导致肿瘤细胞脱水和死亡,同时还可以实时可视化冰球延伸,多根冷冻探针产生协同效应,消融肿瘤。磁共振成像 引导下聚焦超声术是一种无针消融技术,以超声束的形式集中在病灶部位消融。不需要切口,也没有辐射暴露,更有利于儿童和青少年的治疗,该技术的局限性是无法进行活检,只能治疗浅表病变,并且需要有足够的声学窗口。但是,这并不影响MRgFUS成为治疗OB的一种有效的替代治疗选择。
引导下聚焦超声术是一种无针消融技术,以超声束的形式集中在病灶部位消融。不需要切口,也没有辐射暴露,更有利于儿童和青少年的治疗,该技术的局限性是无法进行活检,只能治疗浅表病变,并且需要有足够的声学窗口。但是,这并不影响MRgFUS成为治疗OB的一种有效的替代治疗选择。
目前,单侧双通道脊柱内镜技术(UBE)逐渐在脊柱外科兴起,与传统手术相比,UBE具有切口小、软组织损伤小、术后疼痛 轻、恢复快等优点,但是微创技术还需要脊柱外科医生不断探索、创新,尤其是在脊柱肿瘤方面。目前,外科手术治疗中应用机器人系统也越来越普遍,机器人系统手术中所独有的特点,如稳定性和精确性深受医生和患者的共同认可。
轻、恢复快等优点,但是微创技术还需要脊柱外科医生不断探索、创新,尤其是在脊柱肿瘤方面。目前,外科手术治疗中应用机器人系统也越来越普遍,机器人系统手术中所独有的特点,如稳定性和精确性深受医生和患者的共同认可。
辅助治疗 脊柱OB继发ABCs是否需要放、化疗是专家们争论不休的问题。有学者认为,放疗实际上可能与晚期肉瘤样改变有关,并且它是一种潜在的无效的治疗方法。也有学者认为对于不能手术整块切除的En⁃neking3期OB,可在病灶内切除后辅助治疗,对于不可切除的病灶或复发病例,可联合或单独使用放疗和化疗。关于化疗,有报道使用多柔比星 、顺铂
、顺铂 和甲氨蝶呤
和甲氨蝶呤 治疗已被证实可获得长达33个月的无进展、无复发的病例。蟾蜍素是由蟾蜍耳腺和皮肤腺的干燥分泌物制成的中药,有研究表明,内质网应激有助于蟾蜍灵诱导成OB细胞凋亡,可能作为一种新的抗骨母细胞瘤剂进行研究。最新研究表明,地诺塞麦(Denosumab)是一种人单克隆抗体,以高亲和力和特异性靶向结合核因子k-B受体活化因子配体(RANKL),竞争性抑制RANKL与核因子k-B受体活化因子(RANK)结合,导致破骨细胞的形成、活性和存活减少,引起肿瘤减小和病变内骨化增加。ABCs内多核巨细胞上RANKL的表达提示,抑制RANKL可能会降低破骨细胞活性,从而控制疾病进展。短期的Denosumab治疗使肿瘤减小、骨化,有助于手术切除,对于可切除的OB继发ABCs,手术切除仍然是最好的治疗方法,而对于不可切除的,Denosum⁃ab的副作用明显少于其他化疗和放疗,可能是一种新的治疗方法。
治疗已被证实可获得长达33个月的无进展、无复发的病例。蟾蜍素是由蟾蜍耳腺和皮肤腺的干燥分泌物制成的中药,有研究表明,内质网应激有助于蟾蜍灵诱导成OB细胞凋亡,可能作为一种新的抗骨母细胞瘤剂进行研究。最新研究表明,地诺塞麦(Denosumab)是一种人单克隆抗体,以高亲和力和特异性靶向结合核因子k-B受体活化因子配体(RANKL),竞争性抑制RANKL与核因子k-B受体活化因子(RANK)结合,导致破骨细胞的形成、活性和存活减少,引起肿瘤减小和病变内骨化增加。ABCs内多核巨细胞上RANKL的表达提示,抑制RANKL可能会降低破骨细胞活性,从而控制疾病进展。短期的Denosumab治疗使肿瘤减小、骨化,有助于手术切除,对于可切除的OB继发ABCs,手术切除仍然是最好的治疗方法,而对于不可切除的,Denosum⁃ab的副作用明显少于其他化疗和放疗,可能是一种新的治疗方法。
小结
综上所述,腰椎OB继发ABCs在人群中罕见,其诊断和治疗往往具有挑战性。手术切除仍然是目前最重要的治疗手段,但综合治疗的重要性与日俱增,为了准确的手术评估,应结合多模式影像学表现。手术入路应根据肿瘤浸润的位置、范围和大小来决定,尽可能切除以降低复发率。在不适合完全手术切除的情况下,可以酌情进行辅助治疗。早发现、早治疗可获得满意的临床结果,提高生存率。微创技术的进步正在颠覆传统的治疗方式,并可能成为未来的主流治疗方法。
来源:中国矫形外科杂志2025年6月第33卷第11期
