
卵巢SMARCA4缺失性未分化肉瘤1例
作者:杨雨琴,蒋雨芯,姜 旖,袁 琳等,南京医科大学第一附属医院
1 病例报告
患者,36岁,因发现盆腔肿物4月,下腹痛伴反复发热 12 d于2023年12月5日收住于本院。4月前,当地医院体检妇科超声检查
12 d于2023年12月5日收住于本院。4月前,当地医院体检妇科超声检查 提示右侧附件区囊肿,大小37 mm×35 mm,定期随访。12 d前患者发生下腹痛伴反复发热,体温最高达39℃,于当地医院住院治疗。腹盆腔CT检查
提示右侧附件区囊肿,大小37 mm×35 mm,定期随访。12 d前患者发生下腹痛伴反复发热,体温最高达39℃,于当地医院住院治疗。腹盆腔CT检查 示:肝脏、胆囊、脾脏、胰腺、双肾未见明显异常;盆腔巨大团块状混杂稍低密度影,大小约11.6 cm×10.2 cm,增强后实性成分渐进性强化,动脉期内见血管影,右侧卵巢来源囊腺癌可能,左侧附件区囊性灶,大小约1.4 cm×4.0 cm。当地医院予头孢唑肟
示:肝脏、胆囊、脾脏、胰腺、双肾未见明显异常;盆腔巨大团块状混杂稍低密度影,大小约11.6 cm×10.2 cm,增强后实性成分渐进性强化,动脉期内见血管影,右侧卵巢来源囊腺癌可能,左侧附件区囊性灶,大小约1.4 cm×4.0 cm。当地医院予头孢唑肟 钠抗炎及补液对症支持治疗,腹痛较前好转,体温恢复正常,患者要求上级医院就诊,遂于2023年12月5日至本院。12岁初潮,月经规律,末次月经2023年11月14日,量色如常。G1P1。2021年妊娠期糖尿病
钠抗炎及补液对症支持治疗,腹痛较前好转,体温恢复正常,患者要求上级医院就诊,遂于2023年12月5日至本院。12岁初潮,月经规律,末次月经2023年11月14日,量色如常。G1P1。2021年妊娠期糖尿病 史,饮食控制,产后复查血糖恢复正常。2001年双侧臀部纤维瘤剔除史。无家族肿瘤史。
史,饮食控制,产后复查血糖恢复正常。2001年双侧臀部纤维瘤剔除史。无家族肿瘤史。
入院查体:生命体征平稳,心肺查体无异常,腹软,下腹部轻压痛,无反跳痛。妇科检查 :外阴经产式,发育正常;阴道通畅,无异常分泌物;子宫颈正常大小,表面光滑,质地中,无举痛,无接触性出血;宫体中位,正常大小,活动好,无压痛;三合诊
:外阴经产式,发育正常;阴道通畅,无异常分泌物;子宫颈正常大小,表面光滑,质地中,无举痛,无接触性出血;宫体中位,正常大小,活动好,无压痛;三合诊 :子宫右后方可扪及直径约12 cm囊实性包块,与直肠关系密切,向右侧盆壁延伸。盆腔磁共振成像
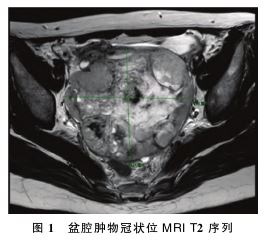
:子宫右后方可扪及直径约12 cm囊实性包块,与直肠关系密切,向右侧盆壁延伸。盆腔磁共振成像 (MRI)检查示:盆腔见一团片状长T1长T2信号影,大小约12 cm×10 cm×12 cm,中央伴坏死囊变及出血,实性成分弥散受限,表观扩散系数(ADC)减低,增强扫描实性成分明显强化,右侧附件来源恶性肿瘤可能,生殖源性肿瘤可能(卵黄囊瘤?无性细胞瘤?),上皮源性肿瘤可能;直肠左前缘腹膜结节软组织影,约1.1 cm,转移可能;左侧附件区囊腺瘤可能,大小约1.5 cm×3.9 cm;盆腔少许积液。见图1。
(MRI)检查示:盆腔见一团片状长T1长T2信号影,大小约12 cm×10 cm×12 cm,中央伴坏死囊变及出血,实性成分弥散受限,表观扩散系数(ADC)减低,增强扫描实性成分明显强化,右侧附件来源恶性肿瘤可能,生殖源性肿瘤可能(卵黄囊瘤?无性细胞瘤?),上皮源性肿瘤可能;直肠左前缘腹膜结节软组织影,约1.1 cm,转移可能;左侧附件区囊腺瘤可能,大小约1.5 cm×3.9 cm;盆腔少许积液。见图1。
胸部CT检查 示:右肺上叶磨玻璃结节,右肺中叶及左肺下叶实性小结节,建议随诊复查。纵膈、两侧肺门、腋窝、胸膜、胸腔内未见异常。结核
示:右肺上叶磨玻璃结节,右肺中叶及左肺下叶实性小结节,建议随诊复查。纵膈、两侧肺门、腋窝、胸膜、胸腔内未见异常。结核 感染T细胞检测(T-SPOT)阴性。妇科肿瘤
感染T细胞检测(T-SPOT)阴性。妇科肿瘤 指标:糖类抗原125(CA125)267.0 U/ml,人附睾蛋白4(HE4)、甲胎蛋白(AFP)、癌胚抗原(CEA)、糖类抗原724(CA724)、糖类抗原199(CA199)均在正常范围内。血钙正常。
指标:糖类抗原125(CA125)267.0 U/ml,人附睾蛋白4(HE4)、甲胎蛋白(AFP)、癌胚抗原(CEA)、糖类抗原724(CA724)、糖类抗原199(CA199)均在正常范围内。血钙正常。
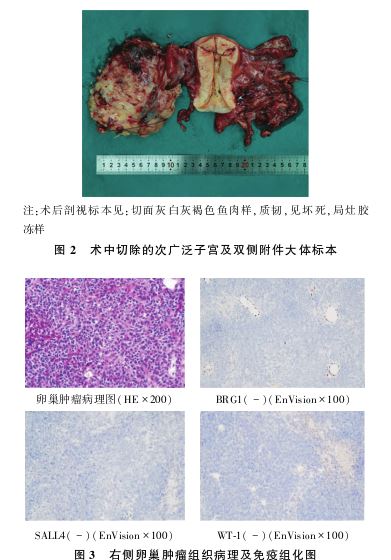
排除手术禁忌,于2023年12月7日行经腹次广泛子宫切除+双侧附件切除+大网膜切除+阑尾切除+盆腹腔病灶切除(肠管及肠系膜表面病灶切除+子宫直肠陷凹病灶切除)+双侧输尿管松解+盆腔粘连分离术。术中探查见:血性腹水 约200 ml,大网膜、膈顶、肝、胆囊、胃、脾、阑尾表面未见明显异常。右侧卵巢肿瘤大小约12 cm×12 cm×10 cm,实性,表面血管丰富,边界不清,与子宫及部分肠管包裹粘连,子宫直肠陷凹封闭;左侧卵巢囊肿约6 cm×5 cm×5 cm,包膜完整,与右侧卵巢肿瘤致密粘连,双侧输卵管外观未见明显异常;子宫膀胱腹膜返折见散在粟粒样病灶;腹主动脉旁及盆腔未及肿大淋巴结。进一步分离右侧卵巢肿瘤与周围脏器粘连,见烂鱼肉样病灶流出,乙状结肠系膜与直肠表面多处肿瘤病灶,子宫直肠陷凹布满肿瘤病灶。见图2。切除右侧卵巢肿瘤送快速冰冻病理检查
约200 ml,大网膜、膈顶、肝、胆囊、胃、脾、阑尾表面未见明显异常。右侧卵巢肿瘤大小约12 cm×12 cm×10 cm,实性,表面血管丰富,边界不清,与子宫及部分肠管包裹粘连,子宫直肠陷凹封闭;左侧卵巢囊肿约6 cm×5 cm×5 cm,包膜完整,与右侧卵巢肿瘤致密粘连,双侧输卵管外观未见明显异常;子宫膀胱腹膜返折见散在粟粒样病灶;腹主动脉旁及盆腔未及肿大淋巴结。进一步分离右侧卵巢肿瘤与周围脏器粘连,见烂鱼肉样病灶流出,乙状结肠系膜与直肠表面多处肿瘤病灶,子宫直肠陷凹布满肿瘤病灶。见图2。切除右侧卵巢肿瘤送快速冰冻病理检查 示:低分化癌,遂行上述手术。术后肉眼无可见病灶,达满意减瘤。术后病理检查示:双侧卵巢恶性肿瘤,可见肿瘤坏死及脉管内瘤栓。免疫组化结果示:CK-pan(-),CK-L(-),Ki-67(60%+),WT-1(-),P53(60%+),Pax-8(-), CD3(-),CD20(-),SALL4(-),CD30(-),Vimentin(+), SMA(散+),Desmin(-),ER(-),PR(-),Inhibin-α(-),Calretinin(散+),SF-1(+),FOXL2(-),INI-1(+),BRG1(-),CK8/18(-),Cg A(-),CD56(部分+),Syn(+/-),PTH(-),EMA(-),CD99(+),INSM1(-), E-cadherin(-),BCOR(-),结合HE切片,BRG1抗体免疫表达缺失,符合SWI/SNF相关基质相关、肌动蛋白依赖的染色质调节因子亚家族A成员4(SMARCA4)缺失性肿瘤,结合免疫标记肿瘤细胞上皮表达阴性[CK-pan(-)/CK-L(-)/CK8/18(-)],考虑SMARCA4缺失性未分化肉瘤
示:低分化癌,遂行上述手术。术后肉眼无可见病灶,达满意减瘤。术后病理检查示:双侧卵巢恶性肿瘤,可见肿瘤坏死及脉管内瘤栓。免疫组化结果示:CK-pan(-),CK-L(-),Ki-67(60%+),WT-1(-),P53(60%+),Pax-8(-), CD3(-),CD20(-),SALL4(-),CD30(-),Vimentin(+), SMA(散+),Desmin(-),ER(-),PR(-),Inhibin-α(-),Calretinin(散+),SF-1(+),FOXL2(-),INI-1(+),BRG1(-),CK8/18(-),Cg A(-),CD56(部分+),Syn(+/-),PTH(-),EMA(-),CD99(+),INSM1(-), E-cadherin(-),BCOR(-),结合HE切片,BRG1抗体免疫表达缺失,符合SWI/SNF相关基质相关、肌动蛋白依赖的染色质调节因子亚家族A成员4(SMARCA4)缺失性肿瘤,结合免疫标记肿瘤细胞上皮表达阴性[CK-pan(-)/CK-L(-)/CK8/18(-)],考虑SMARCA4缺失性未分化肉瘤 ,见图3。子宫颈、宫旁、子宫浆膜面、阑尾、乙状结肠系膜、直肠表面可见肿瘤累及,大网膜未见肿瘤累及,腹水未查见恶性肿瘤细胞。根据术后病理检查,诊断为双侧卵巢SMARCA4缺失性未分化肉瘤ⅢC期。
,见图3。子宫颈、宫旁、子宫浆膜面、阑尾、乙状结肠系膜、直肠表面可见肿瘤累及,大网膜未见肿瘤累及,腹水未查见恶性肿瘤细胞。根据术后病理检查,诊断为双侧卵巢SMARCA4缺失性未分化肉瘤ⅢC期。
考虑该病理类型罕见,建议患者进一步行高通量测序(NGS)分析。患者要求至外院就诊。2024年1月4日外院复查胸部+盆腹腔CT检查示:盆腔及腹主动脉右侧多发病灶,较大位于右侧盆底,大小约5.4 cm×2.3 cm,考虑转移;肝内见低密度结节影,较大一枚直径约1.7 cm,考虑转移。1月9日外院正电子发射计算机断层显像 (PET-CT)检查示:肝脏内见多枚低密度结节,肝脏包膜、双侧结肠旁沟和肠系膜多发结节状增厚,部分与毗邻肠管分界不清,盆腔腹膜多发结节状增厚,较大5.4 cm×2.7 cm,右侧股骨上段、左侧耻骨骨质密度不均匀减低。考虑肝脏、盆腹腔多发转移,部分肠道受侵可能,右侧股骨上段和左侧耻骨转移。1月17日外院予“依托泊苷
(PET-CT)检查示:肝脏内见多枚低密度结节,肝脏包膜、双侧结肠旁沟和肠系膜多发结节状增厚,部分与毗邻肠管分界不清,盆腔腹膜多发结节状增厚,较大5.4 cm×2.7 cm,右侧股骨上段、左侧耻骨骨质密度不均匀减低。考虑肝脏、盆腹腔多发转移,部分肠道受侵可能,右侧股骨上段和左侧耻骨转移。1月17日外院予“依托泊苷 120mg第1天(D1)~D3+顺铂
120mg第1天(D1)~D3+顺铂 35 mg D1~D3”静脉化疗,同时口服安罗替尼
35 mg D1~D3”静脉化疗,同时口服安罗替尼 12 mg每日1次。1月22日外院病理会诊:免疫组化:AE1/AE3(-),CK7(-),EMA(-),CAM5.2(-),SMARCA2(BRM)(-),SMARCA4 BRG1(-),SMARCB1 (INI-1)(+),ARID1A(+),Syn(-),WTI(-),P16(弥漫+),P53(+约70%),Calretinin(-),符合SMARCA4表达缺失的未分化肉瘤,与本院结果相同。2月9日外院复查胸部+盆腹腔CT检查示:盆腹腔种植转移,肝多发转移瘤,较前进展;腹主动脉旁淋巴结转移。2月10日外院改方案予“吉西他滨
12 mg每日1次。1月22日外院病理会诊:免疫组化:AE1/AE3(-),CK7(-),EMA(-),CAM5.2(-),SMARCA2(BRM)(-),SMARCA4 BRG1(-),SMARCB1 (INI-1)(+),ARID1A(+),Syn(-),WTI(-),P16(弥漫+),P53(+约70%),Calretinin(-),符合SMARCA4表达缺失的未分化肉瘤,与本院结果相同。2月9日外院复查胸部+盆腹腔CT检查示:盆腹腔种植转移,肝多发转移瘤,较前进展;腹主动脉旁淋巴结转移。2月10日外院改方案予“吉西他滨 900 mg D1,D8+多西他赛
900 mg D1,D8+多西他赛 75 mg D1+地舒单抗
75 mg D1+地舒单抗 ”静脉化疗。
”静脉化疗。
2024年3月因肿瘤复发并发肠梗阻 死亡。
死亡。
2 讨 论
SMARCA4(BRG1)是酵母交配型转换/蔗糖 不发酵复合物(switch/sucrose non-fermentable complex,SWI/SNF复合物)两个催化亚单位之一[1],参与基因转录调控、DNA损伤修复等重要细胞过程[2]。SMARCA4编码BRG1蛋白,SMARCA4缺失突变可导致该蛋白功能丧失,而BRG1蛋白作为恶性肿瘤中最常见的突变染色质重塑三磷酸腺苷
不发酵复合物(switch/sucrose non-fermentable complex,SWI/SNF复合物)两个催化亚单位之一[1],参与基因转录调控、DNA损伤修复等重要细胞过程[2]。SMARCA4编码BRG1蛋白,SMARCA4缺失突变可导致该蛋白功能丧失,而BRG1蛋白作为恶性肿瘤中最常见的突变染色质重塑三磷酸腺苷 (ATP)酶[2],其缺失驱动了某些恶性肿瘤的发生。SMARCA4缺失性肿瘤可发生于体内多个器官及部位,包括:中枢神经系统、头颈部、胸腔、消化道、女性生殖道、泌尿系统等,其中发生于女性生殖道包括:未分化和去分化子宫内膜癌
(ATP)酶[2],其缺失驱动了某些恶性肿瘤的发生。SMARCA4缺失性肿瘤可发生于体内多个器官及部位,包括:中枢神经系统、头颈部、胸腔、消化道、女性生殖道、泌尿系统等,其中发生于女性生殖道包括:未分化和去分化子宫内膜癌 、子宫SMARCA4缺失性未分化肿瘤、卵巢高钙血症
、子宫SMARCA4缺失性未分化肿瘤、卵巢高钙血症 小细胞癌(SCCO
小细胞癌(SCCO HT)等。
HT)等。
2.1 临床特征 卵巢SMARCA4缺失性未分化肉瘤在临床上十分罕见。疾病缺乏特异性的临床表现,该患者主要表现为双侧卵巢巨大囊实性肿块,伴有腹痛及反复发热。因肿瘤体积较大,且引起腹水的产生,常伴有压迫症状,例如腹胀、尿频等。盆腔MRI常表现为长T1长T2信号影,因肿瘤体积大,中央可伴坏死囊变及出血,实性成分弥散受限,ADC减低,增强扫描实性成分明显强化。超声表现为不均质低回声,内可见液性暗区,可探及丰富血流信号。肿瘤指标可见CA125上升,而其余HE4、AFP、CEA、CA724、CA199均在正常范围内。
2.2 诊断及鉴别诊断 疾病的确诊依赖于病理及免疫组化,病理特征包括:上皮样肿瘤细胞呈实性、片状生长方式,可见肿瘤坏死;细胞核增大,核膜不规则、成角,细胞核呈泡状核,核仁明显,核分裂像增多,并见病理性核分裂像(见图3A)。免疫组化可见:BRG1(-),CK8/18(-),SALL4(-),WT-1(-),CK-pan(-),CK-L(-)。主要需要与其他类型的卵巢肉瘤、卵巢原发或转移性小细胞性肿瘤相鉴别,包括卵巢平滑肌肉瘤、卵巢血管肉瘤、SCCOHT、粒层细胞瘤、卵巢肺型小细胞癌、无性细胞瘤和淋巴瘤 等。其中,与SCCOHT的鉴别最为困难。SCCOHT好发于年轻女性,主要表现为腹痛、单侧卵巢巨大包块,约2/3患者伴有血钙升高[1]。在病理诊断方面,肿瘤细胞WI1和SALL4常为阳性,且几乎所有病例SMARCA4表达均阴性,分子检测显示SMARCA4缺失性突变[1]。本例肿瘤上皮标记(CK-pan、CK-L、CK8/18)阴性、WT-I阴性、SALL4阴性、P53蛋白表达60%强弱
等。其中,与SCCOHT的鉴别最为困难。SCCOHT好发于年轻女性,主要表现为腹痛、单侧卵巢巨大包块,约2/3患者伴有血钙升高[1]。在病理诊断方面,肿瘤细胞WI1和SALL4常为阳性,且几乎所有病例SMARCA4表达均阴性,分子检测显示SMARCA4缺失性突变[1]。本例肿瘤上皮标记(CK-pan、CK-L、CK8/18)阴性、WT-I阴性、SALL4阴性、P53蛋白表达60%强弱 不等阳性,免疫标记不典型,尚不足以诊断为SCCOHT。卵巢SMARCA4缺失性未分化肉瘤作为卵巢肉瘤中的一种亚型,主要通过免疫组化标志物(如SMA、Desmin、CD31等)结合组织病理切片形态学特征以区别于其他类型的卵巢肉瘤[3]。卵巢肉瘤无特异性的临床表现,常由于肿瘤增大而表现出腹痛、腹胀或便秘
不等阳性,免疫标记不典型,尚不足以诊断为SCCOHT。卵巢SMARCA4缺失性未分化肉瘤作为卵巢肉瘤中的一种亚型,主要通过免疫组化标志物(如SMA、Desmin、CD31等)结合组织病理切片形态学特征以区别于其他类型的卵巢肉瘤[3]。卵巢肉瘤无特异性的临床表现,常由于肿瘤增大而表现出腹痛、腹胀或便秘 、排尿不畅、尿频、尿急等压迫症状。在免疫组化方面,卵巢血管肉瘤CD31、CD34常为强阳性,SMA、Actin呈部分阳性,而Desmin、EMA常为阴性[4]。卵巢平滑肌肉瘤Desmin、SMA及H-Caldesmon常呈强阳性,CD34可部分阳性,而S-100、细胞角蛋白和c-kit为阴性[5]。近年来,SMARCA4、BCOR等卵巢肉瘤相关基因的发现,也为卵巢肉瘤的鉴别诊断与分类提供了新的依据[6]。
、排尿不畅、尿频、尿急等压迫症状。在免疫组化方面,卵巢血管肉瘤CD31、CD34常为强阳性,SMA、Actin呈部分阳性,而Desmin、EMA常为阴性[4]。卵巢平滑肌肉瘤Desmin、SMA及H-Caldesmon常呈强阳性,CD34可部分阳性,而S-100、细胞角蛋白和c-kit为阴性[5]。近年来,SMARCA4、BCOR等卵巢肉瘤相关基因的发现,也为卵巢肉瘤的鉴别诊断与分类提供了新的依据[6]。
2.3 治疗及预后 由于疾病罕见,目前尚无统一的治疗方案。作为卵巢肉瘤的一种亚型,可参考其治疗方式,早期患者可行全面分期手术,晚期患者行肿瘤细胞减灭术。术后辅以化疗,但由于疾病罕见,尚无统一的化疗方案,多为经验性用药,如多
柔比星联合异环磷酰胺 、吉西他滨联合铂类等,放疗也可用于局部晚期或复发患者,但其疗效有待研究进一步证实。临床分期是影响预后最主要的因素[7]。此外,卵巢SMARCA4缺失性未分化肉瘤与SCCOHT均为高度恶性的卵巢肿瘤,且肿瘤的发生均与SMARCA4缺失相关,其临床诊治可予以借鉴。SCCOHT目前治疗手段多为根治性手术联合化疗、放疗,其手术方式多为以全子宫双侧附件切除为基础全面分期手术或肿瘤细胞减灭术。目前对于育龄期女性能否行保留生育功能的手术尚无定论。美国安德森癌症中心曾报道一项小样本回顾性研究[8],其中26例患者接受了保留生育功能的手术,但其结局无一成功妊娠,这与术后补充放化疗及无瘤生存期较短相关。保留生育功能并不改善患者预后,甚至增加复发风险,因此,建议行根治性手术,也许能为患者带来更多生存获益。因肿瘤的来源尚不明确,化疗方案多参考卵巢上皮性肿瘤、性索-间质肿瘤及生殖源性肿瘤。通常是基于顺铂和依托泊苷的联合方案,如BEP(博来霉素
、吉西他滨联合铂类等,放疗也可用于局部晚期或复发患者,但其疗效有待研究进一步证实。临床分期是影响预后最主要的因素[7]。此外,卵巢SMARCA4缺失性未分化肉瘤与SCCOHT均为高度恶性的卵巢肿瘤,且肿瘤的发生均与SMARCA4缺失相关,其临床诊治可予以借鉴。SCCOHT目前治疗手段多为根治性手术联合化疗、放疗,其手术方式多为以全子宫双侧附件切除为基础全面分期手术或肿瘤细胞减灭术。目前对于育龄期女性能否行保留生育功能的手术尚无定论。美国安德森癌症中心曾报道一项小样本回顾性研究[8],其中26例患者接受了保留生育功能的手术,但其结局无一成功妊娠,这与术后补充放化疗及无瘤生存期较短相关。保留生育功能并不改善患者预后,甚至增加复发风险,因此,建议行根治性手术,也许能为患者带来更多生存获益。因肿瘤的来源尚不明确,化疗方案多参考卵巢上皮性肿瘤、性索-间质肿瘤及生殖源性肿瘤。通常是基于顺铂和依托泊苷的联合方案,如BEP(博来霉素 、依托泊苷、顺铂)方案,VPCBAE(长春新碱
、依托泊苷、顺铂)方案,VPCBAE(长春新碱 、顺铂、环磷酰胺、博来霉素、多柔比星
、顺铂、环磷酰胺、博来霉素、多柔比星 、依托泊苷)方案,PAVEP(顺铂、多柔比星、依托泊苷、环磷酰胺)方案。Witkowski等[9]研究了148例Ⅱ~Ⅳ期SCCOHT患者的生存资料,发现手术联合多药化疗后接受大剂量化疗联合自体干细胞移植(HDC-aSCR)患者的5年生存率为71%,而接受手术+常规化疗组仅为25%,前者明显优于后者,表明HDC-aSCR可明显提高生存获益,该治疗模式或是最有效的治疗方法,但仍需更多大规模临床研究进一步证实。少数报道表明放疗也许能改善患者的预后[10]。在靶向及免疫治疗方面,研究发现[11],组蛋白去乙酰化(HDAC)抑制剂对SCCOHT细胞系表现出明显的抑制作用,并且与组蛋白甲基转移酶EZH2抑制剂联合使用其抑制效果更加显著,表明SCCOHT患者可能受益于单独使用HDAC抑制剂或与EZH2抑制剂联合使用。除此之外,受体酪氨酸激酶(RTK)抑制剂帕纳替尼在体外和体内试验中均表现出对SCCOHT细胞系的抑制作用,并延缓了肿瘤进展[12]。PD-L1、细胞周期蛋白依赖性激酶4/6(CDK4/6)等都被认为可作为SCCOHT潜在的治疗靶点[13,14],但仍有待进一步研究。诊断时的临床分期是影响预后最重要的因素:国际妇产科联盟(FIGO)Ⅰ期患者的5年生存率为55%,而Ⅱ期和Ⅲ期患者的5年生存率分别为40%和29%,Ⅳ期患者在诊断后13个月内均死亡[9]。
、依托泊苷)方案,PAVEP(顺铂、多柔比星、依托泊苷、环磷酰胺)方案。Witkowski等[9]研究了148例Ⅱ~Ⅳ期SCCOHT患者的生存资料,发现手术联合多药化疗后接受大剂量化疗联合自体干细胞移植(HDC-aSCR)患者的5年生存率为71%,而接受手术+常规化疗组仅为25%,前者明显优于后者,表明HDC-aSCR可明显提高生存获益,该治疗模式或是最有效的治疗方法,但仍需更多大规模临床研究进一步证实。少数报道表明放疗也许能改善患者的预后[10]。在靶向及免疫治疗方面,研究发现[11],组蛋白去乙酰化(HDAC)抑制剂对SCCOHT细胞系表现出明显的抑制作用,并且与组蛋白甲基转移酶EZH2抑制剂联合使用其抑制效果更加显著,表明SCCOHT患者可能受益于单独使用HDAC抑制剂或与EZH2抑制剂联合使用。除此之外,受体酪氨酸激酶(RTK)抑制剂帕纳替尼在体外和体内试验中均表现出对SCCOHT细胞系的抑制作用,并延缓了肿瘤进展[12]。PD-L1、细胞周期蛋白依赖性激酶4/6(CDK4/6)等都被认为可作为SCCOHT潜在的治疗靶点[13,14],但仍有待进一步研究。诊断时的临床分期是影响预后最重要的因素:国际妇产科联盟(FIGO)Ⅰ期患者的5年生存率为55%,而Ⅱ期和Ⅲ期患者的5年生存率分别为40%和29%,Ⅳ期患者在诊断后13个月内均死亡[9]。
本例患者为年轻女性,且已完成生育,术中探查病灶于盆腔广泛种植转移,遂无法进行保留生育功能的手术。行根治性手术后辅以化疗,无进展生存期不足1月,总生存期仅3个月,病情进展迅速。尽管本例患者在短期内死亡,但这并不完全意味着治疗方法无效,可能更多反映了疾病的侵袭性和晚期诊断的挑战。针对此类罕见疾病,未来在术后应尽早启动化疗,并结合类似病例的经验,制定个体化的用药方案。同时,建议完善免疫相关靶点检测及基因检测,探索可能获益的免疫治疗或靶向治疗药物,多药联合化疗或能给患者带来生存获益。
综上所述,卵巢SMARCA4缺失性未分化肉瘤是一种罕见的、恶性程度极高的肿瘤,目前尚无统一的治疗手段,可参照SCCOHT的诊治行经验性治疗。但二者病理免疫标记存在差异,因此其疗效有待更多病例验证。此外,此类疾病常伴有SMARCA4基因失活突变,并以常染色体 显性方式遗传[15],因此应对患者及其亲属进行基因检测,并根据结果进行相应遗传指导。
显性方式遗传[15],因此应对患者及其亲属进行基因检测,并根据结果进行相应遗传指导。
参考文献略。
来源:杨雨琴,蒋雨芯,姜旖,等.卵巢SMARCA4缺失性未分化肉瘤1例[J].实用妇产科杂志,2025,41(05):438-440.
