
法布雷病合并系统性红斑狼疮1例
作者:宋过,褚和瑜,刘晓丽,吴少军,南京医科大学鼓楼临床医学院心血管内科;南京大学医学院附属鼓楼医院心血管内科
患者,女,59岁,因“活动耐力下降10余年,加重伴下肢水肿 5d”于2023年6月16日入院,患者10余年前出现活动耐力下降,当地医院查心脏超声示心室肥厚,冠状动脉造影
5d”于2023年6月16日入院,患者10余年前出现活动耐力下降,当地医院查心脏超声示心室肥厚,冠状动脉造影 未见明显异常,予琥珀酸美托洛尔缓释片
未见明显异常,予琥珀酸美托洛尔缓释片 47.5mg,每天1次口服。5d前患者症状加重,稍活动即气喘,伴双下肢水肿,外院查NT⁃proBNP升高,服用利尿剂后未见明显好转,患者为求进一步诊治入院。既往系统性红斑狼疮
47.5mg,每天1次口服。5d前患者症状加重,稍活动即气喘,伴双下肢水肿,外院查NT⁃proBNP升高,服用利尿剂后未见明显好转,患者为求进一步诊治入院。既往系统性红斑狼疮 (SLE)和狼疮性肾炎
(SLE)和狼疮性肾炎 病史3年,规律使用激素和免疫抑制剂治疗。2003年行腹腔镜
病史3年,规律使用激素和免疫抑制剂治疗。2003年行腹腔镜 下子宫肌瘤
下子宫肌瘤 切除术。2个兄弟有心肌肥厚病史。
切除术。2个兄弟有心肌肥厚病史。
查体:T36.5℃,P70次/min,R20次/min,BP132/72mmHg。双肺呼吸音清,双肺未闻及明显干湿性啰音,心律齐,各瓣膜区未闻及明显病理性杂音,双下肢轻度水肿。实验室检查:B型钠尿肽437.0ng/L,高敏肌钙蛋白 0.054μg/L,肌红蛋白
0.054μg/L,肌红蛋白 41.11μg/L,肌酸激酶同工酶(质量法)11.24μg/L;血肌酐(SCr)66μmol/L,尿酸(UA)370μmol/L,尿蛋白(±),肾小球滤过率(eGFR)84.5ml·min-1·L-1,24h尿蛋白131mg;红细胞沉降率(ESR)34mm/h;抗核抗体胞质颗粒型1∶100,抗核抗体核颗粒型1∶1000,抗U1⁃RNP/Sm抗体(+),抗Sm抗体(±),类风湿因子
41.11μg/L,肌酸激酶同工酶(质量法)11.24μg/L;血肌酐(SCr)66μmol/L,尿酸(UA)370μmol/L,尿蛋白(±),肾小球滤过率(eGFR)84.5ml·min-1·L-1,24h尿蛋白131mg;红细胞沉降率(ESR)34mm/h;抗核抗体胞质颗粒型1∶100,抗核抗体核颗粒型1∶1000,抗U1⁃RNP/Sm抗体(+),抗Sm抗体(±),类风湿因子 34.6IU/ml,抗dsDNA抗体(印迹法)(±),抗dsDNA抗体(酶免法)197.101IU/ml。补体C30.73g/L,补体C40.08g/L,补体C1q12.9g/L。α⁃半乳糖苷酶A(α⁃GalA)1.74μmol·L-1·h-1(正常范围2.40~17.65μmol·L-1·h-1),血浆脱乙酰基Gb3(Lyso⁃Gb3)2.25μg/L(正常值<1.11μg/L)。抗磷脂抗体
34.6IU/ml,抗dsDNA抗体(印迹法)(±),抗dsDNA抗体(酶免法)197.101IU/ml。补体C30.73g/L,补体C40.08g/L,补体C1q12.9g/L。α⁃半乳糖苷酶A(α⁃GalA)1.74μmol·L-1·h-1(正常范围2.40~17.65μmol·L-1·h-1),血浆脱乙酰基Gb3(Lyso⁃Gb3)2.25μg/L(正常值<1.11μg/L)。抗磷脂抗体 四项、狼疮抗凝物质、免疫固定电泳(-)。心电图
四项、狼疮抗凝物质、免疫固定电泳(-)。心电图 :左室高电压,继发ST⁃T改变。24h动态心电图:窦性心动过缓,平均心率47次/min;271次房性早搏中17次成对出现;心室内传导阻滞。心脏超声:肥厚型心肌病
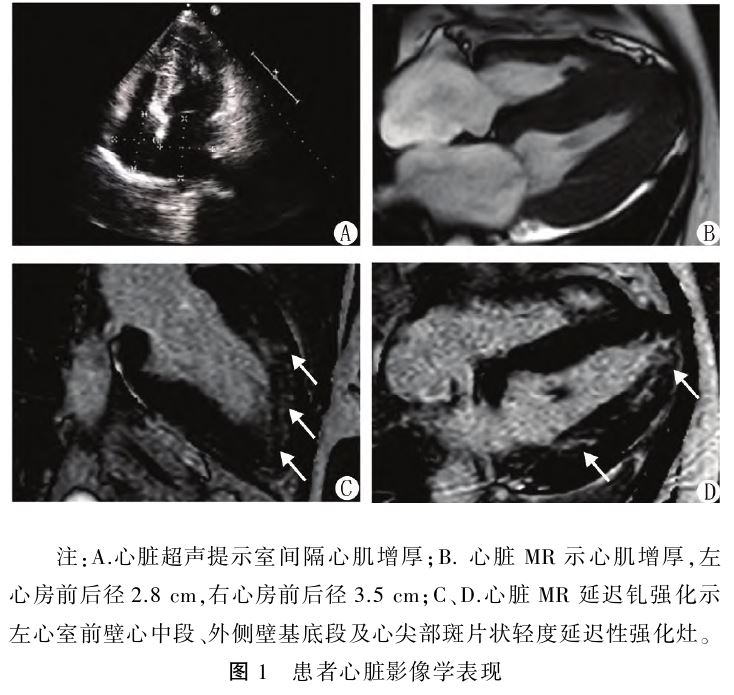
:左室高电压,继发ST⁃T改变。24h动态心电图:窦性心动过缓,平均心率47次/min;271次房性早搏中17次成对出现;心室内传导阻滞。心脏超声:肥厚型心肌病 (静息状态下未及明显梗阻),左心房增大,二尖瓣、三尖瓣轻—中度及主动脉瓣轻度反流,左室舒张功能减退Ⅱ级(图1A)。斑点追踪超声心动图
(静息状态下未及明显梗阻),左心房增大,二尖瓣、三尖瓣轻—中度及主动脉瓣轻度反流,左室舒张功能减退Ⅱ级(图1A)。斑点追踪超声心动图 :左室整体室壁应变值降低(左室二维整体纵向应变值-14%),室间隔和左室前壁基底段应变值降低明显,左室各节段同步性较差。心脏MR:左、右房增大,左室侧壁厚度约1.2cm,室间隔基底段厚度约1.7cm,左心室射血分数53%,延迟增强示左心室前壁心中段、外侧壁基底段及心尖部斑片状轻度延迟性强化灶(图1B、C、D)。基因检测结果显示,在X染色体
:左室整体室壁应变值降低(左室二维整体纵向应变值-14%),室间隔和左室前壁基底段应变值降低明显,左室各节段同步性较差。心脏MR:左、右房增大,左室侧壁厚度约1.2cm,室间隔基底段厚度约1.7cm,左心室射血分数53%,延迟增强示左心室前壁心中段、外侧壁基底段及心尖部斑片状轻度延迟性强化灶(图1B、C、D)。基因检测结果显示,在X染色体 GLA基因(NM_000169.3)检出半合子变异位点:c.770C>T(p.Ala257Val),变异评级为疑似致病。患者的儿子及孙女未检出GLA基因突变。
GLA基因(NM_000169.3)检出半合子变异位点:c.770C>T(p.Ala257Val),变异评级为疑似致病。患者的儿子及孙女未检出GLA基因突变。
结合患者的临床表现、实验室检查及基因检测,明确诊断为法布雷病(Fabrydisease,FD)合并SLE。治疗方案:(1)FD采用酶替代疗法(enzymereplacementtherapy,ERT),阿加糖酶α 12.8g,每2周1次;(2)SLE继续采用激素联合免疫抑制剂方案,泼尼松
12.8g,每2周1次;(2)SLE继续采用激素联合免疫抑制剂方案,泼尼松 5mg/d,环磷酰胺
5mg/d,环磷酰胺 0.4g,每3个月1次静脉滴注。经过1年治疗,患者左室心肌应变较前改善(左室二维整体纵向应变值-12.3%),24h尿蛋白略有波动,肾功能稳定。
0.4g,每3个月1次静脉滴注。经过1年治疗,患者左室心肌应变较前改善(左室二维整体纵向应变值-12.3%),24h尿蛋白略有波动,肾功能稳定。
讨 论
FD是一种X连锁遗传病,由于GLA基因突变,导致α⁃GalA的底物三己糖酰基鞘(Gb3)及其衍生物Lyso⁃Gb3在心脏、肾脏等组织的细胞溶酶体中堆积,从而导致多器官损害[1]。心脏是FD常见的受累器官,可表现为心肌肥厚、瓣膜病变和心律失常 等[2]。其中,约1/2的男性及1/3女性患者成年后出现左心室肥厚,超声斑点成像显示基底段纵向应变降低、心脏MRnativeT1值降低等对早期诊断具有重要提示[3]。GLA基因检测结合血浆Gb3和Lyso⁃Gb3检测是确诊的关键,有80%左右的患者可检测到明确的致病性/疑似致病性变异、VUS或良性变异[4]。SLE是一种自身免疫性疾病,其特征是产生致病性自身抗体和免疫复合物,可影响多个器官或系统,包括肾脏、脑和心血管系统等[5]。其中,SLE的心脏受累主要表现为无症状的心包炎[6]。
等[2]。其中,约1/2的男性及1/3女性患者成年后出现左心室肥厚,超声斑点成像显示基底段纵向应变降低、心脏MRnativeT1值降低等对早期诊断具有重要提示[3]。GLA基因检测结合血浆Gb3和Lyso⁃Gb3检测是确诊的关键,有80%左右的患者可检测到明确的致病性/疑似致病性变异、VUS或良性变异[4]。SLE是一种自身免疫性疾病,其特征是产生致病性自身抗体和免疫复合物,可影响多个器官或系统,包括肾脏、脑和心血管系统等[5]。其中,SLE的心脏受累主要表现为无症状的心包炎[6]。
FD与SLE共病极为罕见,目前仅Nandagudi等[7]报道了1例FD合并SLE和抗磷脂抗体综合征的患者,以及Chatre等[8]报道了1例患者在使用激素和羟氯喹 治疗SLE后发现合并有FD。SLE和FD在发病机制上存在复杂关联,这种关联可能与Gb3有关。沉积在细胞溶酶体中的Gb3可通过与Toll样受体结合,激活单核细胞和树突状细胞等关键免疫细胞,从而释放大量促炎因子,增强机体的免疫反应[9]。本例患病初期,未深入探究心肌肥厚病因;其次,SLE的多系统表现掩盖了FD的隐匿进展,直至心脏症状加重方行FD筛查,最终通过α⁃GalA活性降低、Lyso⁃Gb3升高及GLA基因突变确诊。文献报道FD患者的总体诊断延误时间在15年左右[10]。因此,对于不明原因心肌肥厚合并自身免疫性疾病患者,需警惕合并FD可能,重视遗传性疾病的筛查。
治疗SLE后发现合并有FD。SLE和FD在发病机制上存在复杂关联,这种关联可能与Gb3有关。沉积在细胞溶酶体中的Gb3可通过与Toll样受体结合,激活单核细胞和树突状细胞等关键免疫细胞,从而释放大量促炎因子,增强机体的免疫反应[9]。本例患病初期,未深入探究心肌肥厚病因;其次,SLE的多系统表现掩盖了FD的隐匿进展,直至心脏症状加重方行FD筛查,最终通过α⁃GalA活性降低、Lyso⁃Gb3升高及GLA基因突变确诊。文献报道FD患者的总体诊断延误时间在15年左右[10]。因此,对于不明原因心肌肥厚合并自身免疫性疾病患者,需警惕合并FD可能,重视遗传性疾病的筛查。
FD的治疗方法主要包括ERT、分子伴侣治疗以及基因治疗等。ERT通过补充外源性基因重组α⁃GalA来减少Gb3和Lyso⁃Gb3在脏器的积累,是目前首选的治疗方法[11]。分子伴侣治疗通过口服小分子药物来稳定α⁃GalA,增加其酶活性,因此又称酶增强治疗[12]。基因治疗、mRNA治疗和底物还原治疗等新技术的进展,未来有望为FD患者提供更多治疗选择[13]。在ERT的药物中,阿加糖酶α于2022年成功进入国家医保药品目录。因此,本例患者接受了阿加糖酶α治疗FD。同时,继续采用激素联合免疫抑制剂方案治疗SLE和狼疮性肾炎。
参考文献略。
来源:疑难病杂志2025年7月第24卷第7期
