
透析前后APTT大起大落?揭秘尿毒症毒素 “搅乱” 凝血的关键因素
作者:张福兴,清河县人民医院,郑州市中心医院
前言
在尿毒症 患者的凝血功能评估中,活化部分凝血活酶时间(APTT)延长是常见却充满挑战的实验室现象。它可能源于凝血因子缺乏、抗凝药物干扰,抑或是尿毒症特有的病理产物对凝血途径的复杂干预——后者往往因机制隐匿而极易被误判。
患者的凝血功能评估中,活化部分凝血活酶时间(APTT)延长是常见却充满挑战的实验室现象。它可能源于凝血因子缺乏、抗凝药物干扰,抑或是尿毒症特有的病理产物对凝血途径的复杂干预——后者往往因机制隐匿而极易被误判。
病例分析
患者任某,女,60岁,因尿毒症、心律失常 入院。6月28日,患者凝血筛查试验检测,活化部分凝血活酶时间(APTT)45.8秒;D-二聚体
入院。6月28日,患者凝血筛查试验检测,活化部分凝血活酶时间(APTT)45.8秒;D-二聚体 0.54FEU;K:7.6mmol/L;CREA:704umol/L;UREA:25.8mmol/L;GLU:10.49mmol/L;查看当日质控无异常,凝血标本无溶血、无凝块,反应曲线正常,血常规
0.54FEU;K:7.6mmol/L;CREA:704umol/L;UREA:25.8mmol/L;GLU:10.49mmol/L;查看当日质控无异常,凝血标本无溶血、无凝块,反应曲线正常,血常规 标本HCT:0.30。临床反馈患者无出血、无血栓症状,由血液透析
标本HCT:0.30。临床反馈患者无出血、无血栓症状,由血液透析 科转入ICU前使用低分子肝素
科转入ICU前使用低分子肝素 钙。
钙。
APTT纠正试验
根据《APTT 延长混合血浆纠正试验操作流程及结果解读中国专家共识》建议:APTT 不明原因超出正常对照值至少 5S,患者有相关症状、体征或临床医生需要进一步了解 APTT 延长的原因时,可启动 APTT 纠正试验。
采用科室冻存NPP与患者血浆1:1混合得到以下数据
结果:即刻及孵育后均不纠正。(RI临界值范围为10%~15%,低于10%提示因子缺乏,高于15%提示存在凝血抑制物,10%~15%为灰区;RI = [(混合APTT - 正常APTT) / 患者原APTT] × 100%)根据APTT纠正试验结果考虑患者标本存在狼疮抗凝物(LA)或因子抑制物,建议临床加做LA。
异常延长的APTT自发恢复
6月29日00:10患者血液滤过 后APTT显著回落至34.5s(参考范围21-36s);5:01 APTT有所反弹,可能与治疗间隔有关。
后APTT显著回落至34.5s(参考范围21-36s);5:01 APTT有所反弹,可能与治疗间隔有关。
发现患者APTT正常后查看当日质控在控,观察标本无肉眼可见凝集无溶血。考虑标本是否存在微凝集提前激活的情况,加做D-二聚体结果为0.6FEU。与昨日0.54FEU无明显差异。基本可排除微凝集干扰。
考虑患者血液滤过过程中使用抗凝剂为低分子肝素钙,是否低分子肝素钙中的钙离子会升高标本中钙离子浓度,造成采血管中抗凝剂不足的情况。为此对标本钙离子浓度进行了检测。
患者钙离子浓度1.95 mmol/L vs 正常对照2.17 mmol/L(参考范围2.1-2.6 mmol/L),计算可知总钙两者无显著差异,排除抗凝剂不足。
情况再现
正当我们疑惑任某短时间内APTT的变化时,又发现一例由血液透析室转至ICU的患者出现相同的情况。
孙某,女,72岁,尿毒症。6月28日患者凝血筛查试验检测,APTT:54.7s;6月29日APTT:33.4s;6月30日APTT:34.3s。同样的科室同样的病症同样的表现,这之间是否存在着某种联系呢?
任某狼疮抗凝物结果:
筛查比值1.14;确证比值1.36;标准化比值0.84,狼疮抗凝物阴性。确证比值与筛选比值倒置,(筛查试验试剂为低磷脂试剂,确证试验试剂为高磷脂试剂)试验增加了磷脂浓度反而时间延长了。提示可能存在磷脂浓度依赖性抑制物,高磷脂试剂中更多异常蛋白与磷脂结合,加剧了对凝血反应的阻断。
为进一步探明原因,向郑州中心医院张冠楠老师寻求指导。张老师指出需考虑能与磷脂非特异性结合的特殊蛋白存在,这种蛋白在磷脂浓度越高的情况下对实验的干扰越强。血液滤过治疗后两患者APTT均自发恢复正常可考虑毒素清除机制。
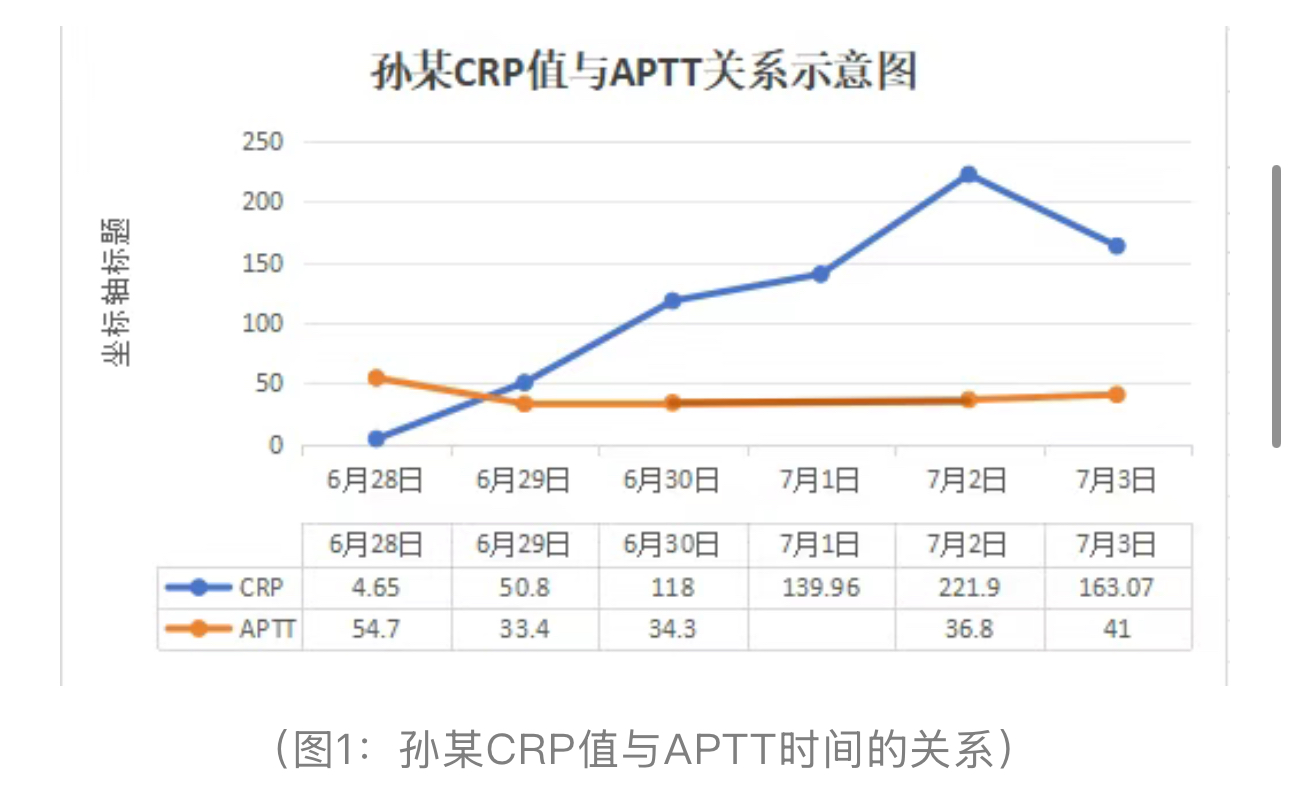
CRP作为炎症标志物与APTT无相关性,排除了炎症因子直接干扰凝血途径的可能性,反向支持非炎症性毒素介导的磷脂干扰假说(7月1日未检测APTT;患者任某CRP住院期间均在参考范围内故未与APTT对比)。
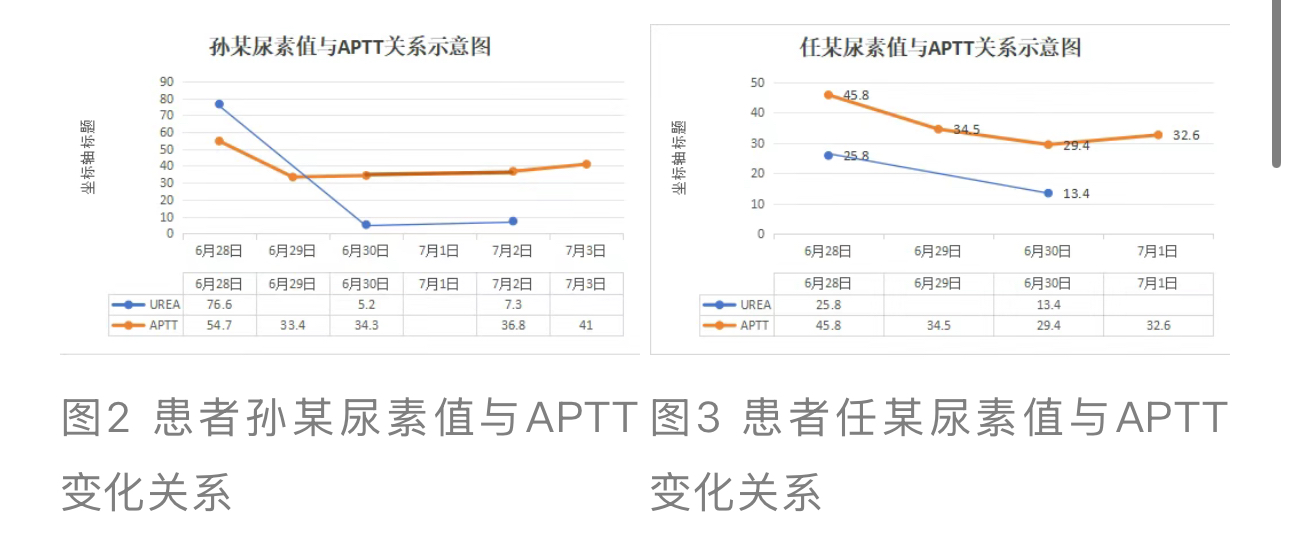
由图2、图3可知APTT时间与尿素 值之间存在某种正向关系,而这种关系可能与血液滤过后某些蛋白或其他物质被清除的情况有关。两患者均在血液滤过前APTT延长且不能被纠正,而血液滤过后APTT迅速恢复进一步证实了这一观点。
值之间存在某种正向关系,而这种关系可能与血液滤过后某些蛋白或其他物质被清除的情况有关。两患者均在血液滤过前APTT延长且不能被纠正,而血液滤过后APTT迅速恢复进一步证实了这一观点。
尿毒症患者APTT时间延长机制
1.尿毒症患者血浆中蓄积的硫酸吲哚酚(IS)和对甲酚 硫酸盐(PCS)等毒素可抑制凝血因子(如FIX、FXI)的活性,导致APTT延长。这些毒素还可能干扰内源性凝血途径的磷脂依赖性反应(如接触激活阶段)。
硫酸盐(PCS)等毒素可抑制凝血因子(如FIX、FXI)的活性,导致APTT延长。这些毒素还可能干扰内源性凝血途径的磷脂依赖性反应(如接触激活阶段)。
2.电荷相互作用:
❖异常蛋白的修饰:尿毒症环境中产生的氨甲酰化蛋白(由尿素衍生的氰酸盐修饰赖氨酸 残基形成)会暴露更多正电荷基团(如未被修饰的赖氨酸)。
残基形成)会暴露更多正电荷基团(如未被修饰的赖氨酸)。
❖磷脂的负电荷:细胞膜磷脂(如磷脂酰丝氨酸 )和循环中的脂蛋白表面通常带有负电荷。
)和循环中的脂蛋白表面通常带有负电荷。
❖静电吸引:正电荷的异常蛋白与负电荷的磷脂之间可通过静电作用非特异结合。
3.疏水相互作用:
❖蛋白聚集/错误折叠:β2-微球蛋白等积累蛋白易形成淀粉样纤维,其疏水区域暴露。
❖磷脂双分子层:磷脂的脂肪酸链形成疏水内环境。
疏水作用可驱动异常蛋白嵌入脂质膜或与脂蛋白结合。
4.氧化应激与脂质过氧化:尿毒症中高水平的氧化应激会导致磷脂氧化(如氧化型低密度脂蛋白ox-LDL)。氧化磷脂的极性头基结构改变,更易与炎症蛋白(如C反应蛋白)、补体成分或氨甲酰化蛋白结合。
5.晚期糖基化终末产物(AGES)的作用:AGES修饰的蛋白质可通过其交联结构直接与磷脂或细胞膜受体(如RAGE)结合,触发炎症反应。
总结
APTT延长的机制有很多,如试验前采血不顺利造成的微凝集;未混匀形成大的凝块,凝血因子大量消耗;采血比例不合适;凝血因子缺乏;LA阳性;因子抑制物存在;其他与磷脂非特异结合的异常蛋白(如氨甲酰化蛋白B2-微球蛋白、AGES修饰蛋白)。
本案例揭示:尿毒症患者APTT延长需警惕非LA型磷脂干扰,动态监测透析前后APTT变化是识别此类干扰的关键窗口。检验人员应结合纠正试验、毒素清除效应及钙离子检测,避免误判抗凝状态。
专家点评
于金涛 主任检验师
本案例研究以敏锐的实验室视角捕捉到尿毒症患者APTT延长的特殊现象,通过严谨的排查流程与动态监测,揭示了尿毒症毒素蛋白介导的“非狼疮抗凝物型磷脂干扰”机制。对优化尿毒症患者凝血管理策略具有重要实践意义。
来源:检验医学网
