
再生障碍性贫血钙网蛋白基因突变1例报告并文献复习
作者:耿雪银,李步霓,钱玲玲,谢晓艳等,大连医科大学扬州临床医学院血液科,扬州大学临床医学院 江苏省苏北人民医院血液科,南京医科大学附属淮安第一医院
再生障碍性贫血 (aplasticanemia,AA)是一种少见且危及生命的获得性骨髓造血衰竭综合征,以全血细胞减少和骨髓造血细胞减少为特征[1]。AA可出现克隆造血,与体细胞突变有关,最常见的5个 突 变基因为PIGA、BCOR、BCORLl、DNMT3A和ASXLl[2]。其中存在PIGA、BCOR/ BCORLl突变者对免疫抑制剂治疗反应良好,存在DNMT3A和ASXL1突变者预后不良[2]。钙网蛋白(calreticulin,CALR )基因突变是诊断骨髓增殖性肿瘤
(aplasticanemia,AA)是一种少见且危及生命的获得性骨髓造血衰竭综合征,以全血细胞减少和骨髓造血细胞减少为特征[1]。AA可出现克隆造血,与体细胞突变有关,最常见的5个 突 变基因为PIGA、BCOR、BCORLl、DNMT3A和ASXLl[2]。其中存在PIGA、BCOR/ BCORLl突变者对免疫抑制剂治疗反应良好,存在DNMT3A和ASXL1突变者预后不良[2]。钙网蛋白(calreticulin,CALR )基因突变是诊断骨髓增殖性肿瘤 (myeloproliferativeneoplasm,MPN)的分子标志物,15%~25%的原发性血小板增多
(myeloproliferativeneoplasm,MPN)的分子标志物,15%~25%的原发性血小板增多 症(essentialthrombocythemia,ET)和25%~36%的骨髓纤维化(myelofibrosis,MF)患者存在CALR 基因突变[3-4]。CALR基因突变在AA患者中罕有报道。本文报道1例重型再生障碍性贫血(severe aplasticanemia,SAA)患者CALR 基因突变(第5外显子c.613C>T突变)并复习相关文献。
症(essentialthrombocythemia,ET)和25%~36%的骨髓纤维化(myelofibrosis,MF)患者存在CALR 基因突变[3-4]。CALR基因突变在AA患者中罕有报道。本文报道1例重型再生障碍性贫血(severe aplasticanemia,SAA)患者CALR 基因突变(第5外显子c.613C>T突变)并复习相关文献。
1 临床资料
患者,男,44岁,因“双下肢瘀点瘀斑伴面色苍白2月余”于2022年2月23日入住我院。既往体健,未提供家族遗传性疾病史。入院时查体:中度贫血貌,浅表淋巴结未及肿大,双下肢皮肤黏膜散在瘀点、瘀斑,口腔内左侧颊黏膜可见血疱,胸骨无压痛,肝脾肋下未触及,双下肢无浮肿。血常规 示:红细胞1.55×1012/L(正常范围4.3×1012/L~5.8×1012/L)、血红蛋白水平60g/L (正常范围130~175g/L)、白细胞计数2.12× 109/L(正常范围3.50×109/L~9.50×109/L)、中性粒细胞0.40×109/L(正常范围1.80×109/L~ 6.60×109/L)、血小板计数18×109/L(正常范围125×109/L~350×109/L);网织红细胞百分比0.45%(正常范围0.82%~2.25%),网织红细胞绝对值9.8×109/L(正常范围36.3×109/L~ 195.7×109/L);CD4/CD8:3.05∶1[正常范围(1.0~2.0)∶1];TH1(IFN-γ)/TH2(IL-4):11.98∶ 1[正常范围(10.0~6.5)∶1];粒细胞FLAER/ CD15/CD45 缺 陷:0,单核细胞 FLAER/CD14/ CD45缺陷:0;粒细胞CD55:96.77%(正常范围97.64% ±2.13%),CD59:92.16% (正 常 范 围98.03%±1.72%),红细胞:CD55:99.69%(正常范围97.46%±2.13%),CD59:99.59%(正常范围98.03%±1.72%);血清铁35.82μmol/L(正常范围5.83~34.50μmol/L)、总 铁结合力 57.72 μmol/L(正常范围48.30~68.00μmol/L)、可溶性转铁蛋白受体1.33mg/L(正常范围2.20~ 5.00mg/L),铁蛋白547ng/mL(正常范围20~ 400ng/mL);血抗人球蛋白试验
示:红细胞1.55×1012/L(正常范围4.3×1012/L~5.8×1012/L)、血红蛋白水平60g/L (正常范围130~175g/L)、白细胞计数2.12× 109/L(正常范围3.50×109/L~9.50×109/L)、中性粒细胞0.40×109/L(正常范围1.80×109/L~ 6.60×109/L)、血小板计数18×109/L(正常范围125×109/L~350×109/L);网织红细胞百分比0.45%(正常范围0.82%~2.25%),网织红细胞绝对值9.8×109/L(正常范围36.3×109/L~ 195.7×109/L);CD4/CD8:3.05∶1[正常范围(1.0~2.0)∶1];TH1(IFN-γ)/TH2(IL-4):11.98∶ 1[正常范围(10.0~6.5)∶1];粒细胞FLAER/ CD15/CD45 缺 陷:0,单核细胞 FLAER/CD14/ CD45缺陷:0;粒细胞CD55:96.77%(正常范围97.64% ±2.13%),CD59:92.16% (正 常 范 围98.03%±1.72%),红细胞:CD55:99.69%(正常范围97.46%±2.13%),CD59:99.59%(正常范围98.03%±1.72%);血清铁35.82μmol/L(正常范围5.83~34.50μmol/L)、总 铁结合力 57.72 μmol/L(正常范围48.30~68.00μmol/L)、可溶性转铁蛋白受体1.33mg/L(正常范围2.20~ 5.00mg/L),铁蛋白547ng/mL(正常范围20~ 400ng/mL);血抗人球蛋白试验 (Coombs’)、酸化溶血试验
(Coombs’)、酸化溶血试验 均阴性;自身抗体阴性;血清蛋白电泳
均阴性;自身抗体阴性;血清蛋白电泳 、肝肾功能、甲状腺功能、免疫固定电泳无异常,肝炎
、肝肾功能、甲状腺功能、免疫固定电泳无异常,肝炎 病毒、EBV、CMV均阴性。腹部B超示肝囊肿
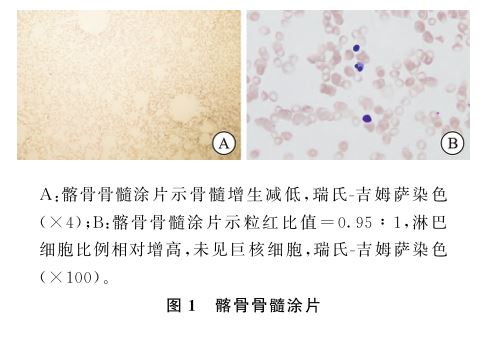
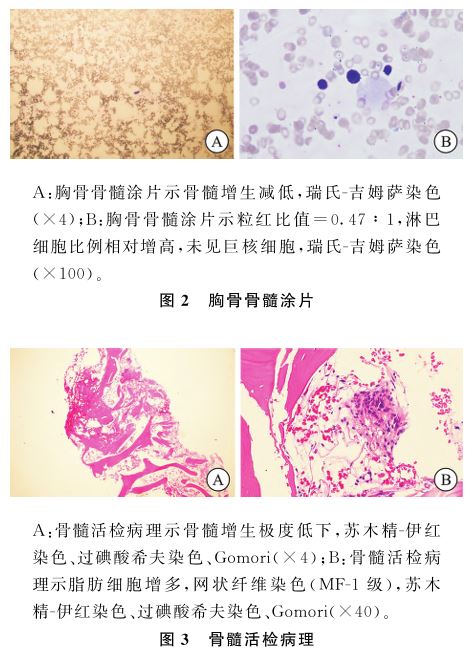
病毒、EBV、CMV均阴性。腹部B超示肝囊肿 ,脾脏大小正常。胸部CT:两肺纹理增多,纵隔、肺门未见明显肿大淋巴结影。胸腔内未见积液。髂骨(图1)和胸骨(图2)骨髓涂片
,脾脏大小正常。胸部CT:两肺纹理增多,纵隔、肺门未见明显肿大淋巴结影。胸腔内未见积液。髂骨(图1)和胸骨(图2)骨髓涂片 均显示:骨髓增生减低,粒细胞与红细胞比值
均显示:骨髓增生减低,粒细胞与红细胞比值 (粒红比值)=(0.47~0.95)∶1;淋巴细胞比例相对增高;未见巨核细胞;特殊组织化学染色示外铁+(正常范围+~+++),内铁Ⅰ型20%、Ⅱ型10%(正常30%~90%)。骨髓活检病理(图3)显示骨髓增生极度低下(<10%),脂肪细胞增生,网状纤维染色(MF-1级,灶性)。骨髓Coombs’阴性。骨髓流式分析示:粒细胞比例明显偏低,占14.2%,淋巴细胞比例相对偏高,占53.1%,抗原表达未见明显异常。染色体核型分析
(粒红比值)=(0.47~0.95)∶1;淋巴细胞比例相对增高;未见巨核细胞;特殊组织化学染色示外铁+(正常范围+~+++),内铁Ⅰ型20%、Ⅱ型10%(正常30%~90%)。骨髓活检病理(图3)显示骨髓增生极度低下(<10%),脂肪细胞增生,网状纤维染色(MF-1级,灶性)。骨髓Coombs’阴性。骨髓流式分析示:粒细胞比例明显偏低,占14.2%,淋巴细胞比例相对偏高,占53.1%,抗原表达未见明显异常。染色体核型分析 未见异常分裂相。基因检测显示CALR基因第5外显子中c.613C>T突变(NM-004343.3),这导致p.Pro205Ser变异(变异比例48.4%)。笔者未见这种突变在AA中的相关报道(表1)。根据《再生障碍性贫血诊断与治疗中国专家共识(2022年版)》[1],排除继发性全血细胞减少性疾病,最终诊断患者为SAA。患者在我院未同意强化免疫抑制治疗,给予十一酸睾酮
未见异常分裂相。基因检测显示CALR基因第5外显子中c.613C>T突变(NM-004343.3),这导致p.Pro205Ser变异(变异比例48.4%)。笔者未见这种突变在AA中的相关报道(表1)。根据《再生障碍性贫血诊断与治疗中国专家共识(2022年版)》[1],排除继发性全血细胞减少性疾病,最终诊断患者为SAA。患者在我院未同意强化免疫抑制治疗,给予十一酸睾酮 和环孢素
和环孢素 口服,并间断输注红细胞、血小板支持治疗。
口服,并间断输注红细胞、血小板支持治疗。
出院后在我院门诊随访4个月,血红蛋白水平维持在58~73g/L,白细胞计数维持在2.5×109/L~3.5×109/L,中性粒细胞维持在0.46×109/L~2.07×109/L,血小板计数维持在25×109/L~35×109/L。4个月后在淮安市第一人民医院就诊,期间因出现肾功能损害自行停用环孢素和十一酸睾酮1个月,血红蛋白水平维持在59~74g/L,白细胞计数维持在2.40×109/L~4.17×109/L,中性粒细胞维持在0.49×109/L~0.80×109/L,不输注血小板情况下血小板计数维持在9×109/L~22×109/L。于2023年10月11日在淮安市第一人民医院接受IST(兔ATG联合他克莫司 )治疗,IST治疗后3个月血细胞上升不明显,2023年1月5日他克莫司加量(监测血药浓度),同时加用海曲泊帕
)治疗,IST治疗后3个月血细胞上升不明显,2023年1月5日他克莫司加量(监测血药浓度),同时加用海曲泊帕 治疗后病情好转。目前患者已脱离输血
治疗后病情好转。目前患者已脱离输血 ,血红蛋白水平100g/L,白细胞计数2.17×109/L,中性粒细胞0.99×109/L,血小板计数30×109/L,网织红细胞百分比2.47%,网织红细胞绝对值66.4×109/L。随访至今,患者未出现阵发性睡眠性血红蛋白尿症
,血红蛋白水平100g/L,白细胞计数2.17×109/L,中性粒细胞0.99×109/L,血小板计数30×109/L,网织红细胞百分比2.47%,网织红细胞绝对值66.4×109/L。随访至今,患者未出现阵发性睡眠性血红蛋白尿症 (paroxysmalnocturnalhemoglobinuria,PNH)克隆,现仍在随访当中。
(paroxysmalnocturnalhemoglobinuria,PNH)克隆,现仍在随访当中。
2 讨论
CALR 基因由9个外显子组成,大小约5.8kb,定位于19号染色体。CALR基因编码一个46kDa的可溶性蛋白,由417个氨基酸 组成,是内质网主要的钙结合蛋白。除了内质网外,CALR还定位于细胞核和细胞表面,在不同的生理和病理条件下分别发挥转录调节和吞噬作用[5]。CALR基因参与各种细胞功能,直到2013年2个研究组在JAK2/MPL未突变的ET和原发性骨髓纤维化(primarymyelofibrosis,PMF)患者中发现CALR 基因突变,才将CALR突变与肿瘤发生联系起来[6]。到目前为止,已经发现60多种不同类型的CALR 突变,最常见的突变体是1型突变体(pL367fs∗46,52bp缺失)和2型突变体(pK385fs ∗47,5bp插入),1型突变体在 MF患者中更常见,2型突变与ET相关[3,5]。突变型CALR 促进MPN的发生,目前已纳入MPN的相关诊断标准中[7],与JAK2和MPL突变互斥,在JAK2/MPL未突变的MPN患者中,约67%的ET患者和88%的PMF患者出现CALR突变,这些突变通常是9号外显子的核苷酸微小缺失或插入而导致的移码突变[8-9]。目前的研究发现突变的CALR通过与血小板生成素受体(thrombopoietinreceptor,MPL)形成复合体,诱导与MPL结合的下游激酶JAK2的结构性激活,进而触发并激活下游JAK-STAT信号通路而致病[6]。
组成,是内质网主要的钙结合蛋白。除了内质网外,CALR还定位于细胞核和细胞表面,在不同的生理和病理条件下分别发挥转录调节和吞噬作用[5]。CALR基因参与各种细胞功能,直到2013年2个研究组在JAK2/MPL未突变的ET和原发性骨髓纤维化(primarymyelofibrosis,PMF)患者中发现CALR 基因突变,才将CALR突变与肿瘤发生联系起来[6]。到目前为止,已经发现60多种不同类型的CALR 突变,最常见的突变体是1型突变体(pL367fs∗46,52bp缺失)和2型突变体(pK385fs ∗47,5bp插入),1型突变体在 MF患者中更常见,2型突变与ET相关[3,5]。突变型CALR 促进MPN的发生,目前已纳入MPN的相关诊断标准中[7],与JAK2和MPL突变互斥,在JAK2/MPL未突变的MPN患者中,约67%的ET患者和88%的PMF患者出现CALR突变,这些突变通常是9号外显子的核苷酸微小缺失或插入而导致的移码突变[8-9]。目前的研究发现突变的CALR通过与血小板生成素受体(thrombopoietinreceptor,MPL)形成复合体,诱导与MPL结合的下游激酶JAK2的结构性激活,进而触发并激活下游JAK-STAT信号通路而致病[6]。
通过查阅文献,发现在PNH和骨髓增生异常性肿瘤(myelodysplasticneoplasms,MDS)中存在CALR基因突变,未查询到AA患者CALR基因突变的报道。PNH是一种以血管内溶血、血栓形成和骨髓衰竭为特征的疾病,与造血干细胞中PIGA基因的突变有关,导致糖基磷脂酰肌醇 (glycosylphosphatidylinositol,GPI)锚定蛋白的缺乏[10]。单独的PIGA 突变不足以实现PNH的克隆扩增,同时存在克隆性造血相关的突变时,如JAK2V617F和CALR,即使既往无 AA的病史,患者有时也会发生PNH[11]。Fraiman等[12]报道1例患者病初时表现为血小板增多,诊断为JAK2V617F阴性、CALR 阳性的ET。病程中出现贫血、乳酸脱氢酶升高和网织红细胞明显增多,骨髓活检显示纤维化,单核苷酸多态性阵列的高分辨率核型显示了Xp22.2的半合子缺失(一种与PNH发展相关的遗传畸变),流式细胞术发现GPI锚定蛋白(PNH 克隆)缺失,患者最终发展为PNH。Okamoto等[13]报道的病例在初诊时就检测出PIGA、ASXL1以及CALR基因突变,未发现JAK2/MPL基因突变,诊断患者为PNH和ET。
(glycosylphosphatidylinositol,GPI)锚定蛋白的缺乏[10]。单独的PIGA 突变不足以实现PNH的克隆扩增,同时存在克隆性造血相关的突变时,如JAK2V617F和CALR,即使既往无 AA的病史,患者有时也会发生PNH[11]。Fraiman等[12]报道1例患者病初时表现为血小板增多,诊断为JAK2V617F阴性、CALR 阳性的ET。病程中出现贫血、乳酸脱氢酶升高和网织红细胞明显增多,骨髓活检显示纤维化,单核苷酸多态性阵列的高分辨率核型显示了Xp22.2的半合子缺失(一种与PNH发展相关的遗传畸变),流式细胞术发现GPI锚定蛋白(PNH 克隆)缺失,患者最终发展为PNH。Okamoto等[13]报道的病例在初诊时就检测出PIGA、ASXL1以及CALR基因突变,未发现JAK2/MPL基因突变,诊断患者为PNH和ET。
这2例患者说明CALR基因突变在扩展PNH克隆中发挥了关键作用,可能是诱导MPN和致病性PNH发生的重要因素。MDS是起源于造血干细胞的异质性髓系克隆性疾病,以无效造血、难治性血细胞减少及向急性髓系白血病 (acutemyeloidleukemia,AML)转化为特征。MDS常见基因突变包括TET2、RUNX1、ASXL1、DNMT3A 、EZH2、SF3B1等[14]。CALR基因在 MDS患者中突变率较低(0.36%~ 8.30%),但在难治性贫血伴环状铁粒幼细胞和血小板增多(refractoryanemiawithringsideroblasts andmarkedthrombocytosis,RARS-T)中突变率较高,占27.3%(表1)。RARS-T是一种具有骨髓增生异常和骨髓增殖特征的髓系肿瘤,在2016年WHO分类中被认为是一个独特的病种,命名为骨髓增生异常性/骨髓增殖性肿瘤伴环形铁粒幼细胞和血小板增多(myelodysplastic/myeloproliferative neoplasmswithringsideroblastsandthrombocytosis,MDS/MPN-RS-T)[15]。
(acutemyeloidleukemia,AML)转化为特征。MDS常见基因突变包括TET2、RUNX1、ASXL1、DNMT3A 、EZH2、SF3B1等[14]。CALR基因在 MDS患者中突变率较低(0.36%~ 8.30%),但在难治性贫血伴环状铁粒幼细胞和血小板增多(refractoryanemiawithringsideroblasts andmarkedthrombocytosis,RARS-T)中突变率较高,占27.3%(表1)。RARS-T是一种具有骨髓增生异常和骨髓增殖特征的髓系肿瘤,在2016年WHO分类中被认为是一个独特的病种,命名为骨髓增生异常性/骨髓增殖性肿瘤伴环形铁粒幼细胞和血小板增多(myelodysplastic/myeloproliferative neoplasmswithringsideroblastsandthrombocytosis,MDS/MPN-RS-T)[15]。
MDS/MPN-RS-T被认为是一种多重打击模型,当伴有环形铁粒幼细胞的 MDS(myelodysplasticsyndromewithring sideroblasts,MDS-RS)获得 MPN相关的驱动突变时,后者继发打击SF3B1 突变,导致疾病的发生[16]。Yasuda等[17]报道的1例 MDS/MPN-RST患者,随着疾病进展,演变成 MF和AML时, JAK2和CALR 突变随着SF3B1突变克隆增强而减弱,进一步说明了MPN相关的驱动基因在MDS疾病进展中的促进作用。 表1显示存在CALR基因突变的PNH和MDS病例,多数伴有血小板增多,且同时存在其他类型的基因突变。本例患者全血细胞(包括网织红细胞)减少,中性粒细胞<0.5×109/L,血小板计数<20×109/L;髂骨和胸骨骨髓增生减低,非造血细胞增多,巨核细胞缺如;骨髓活检病理显示骨髓增生极度低下(<10%),脂肪细胞增多,网状纤维染色(MF-1级,灶性)。尽管存在CALR基因突变,但结合临床表现及实验室检查均不支持MPN。MF可表现骨髓增生低下,但MF外周血中可检测到泪滴样异常红细胞、幼稚粒细胞/幼稚红细胞,多伴有脾肿大,骨髓易干抽。该患者无上述表现,故不考虑MF,且排除了其他获得性、继发性骨髓衰竭性疾病,符合SAA诊断。IST治疗后血细胞上升、脱离输血更支持了SAA的诊断。根据已报道病例的疾病演变过程,MPN相关驱动突变如JAK2和CALR突变可能会逐渐减弱,而其他致病性基因如PIGA和SF3B1突变克隆可能逐渐增强。因此,本研究需继续密切随访患者病情变化,进一步追踪CALR突变对AA患者疾病及预后的影响。
综上,CALR基因突变在骨髓衰竭性疾病中的报道甚少,人们对该基因与骨髓衰竭性疾病关系的认识还有待进一步深入。本文报道了1例CALR基因新发变异,并通过文献复习较为全面地分析了CALR基因与PNH和MDS的关系,本研究不仅扩充了CALR基因突变谱,而且提高了临床医生对该基因在血液系统疾病中的认识。本研究亦存在一定的局限性:①CALR在AA中的具体作用以及作用机制亦尚不明确;②CALR基因突变与AA的发生发展以及预后的关系仍未可知。因此,需要更多病例且更长期、更密切的监测随访以及更深入的研究来解答。
利益冲突 所有作者均声明不存在利益冲突
参考文献略。
来源:耿雪银,李步霓,钱玲玲,等.再生障碍性贫血钙网蛋白基因突变1例报告并文献复习[J].临床血液学杂志,2025,38(5):407-411.
