
TSC基因变异家系行胚胎植入前单基因遗传病检测成功助孕2例
作者:陈芸汐,倪亚莉,晏 博,曹雅菲等,甘肃省妇幼保健院(甘肃省中心医院),甘肃省母胎医学与生育保护重点实验室,甘肃中医药大学第一临床医学院
1 病例报告
病例1,28岁,因胎儿心脏横纹肌瘤引产后2月,于2021年6月9日就诊于甘肃省妇幼保健院。2021年4月孕26周行3次超声检查均提示胎儿双心室内多个结节,疑为心脏横纹肌瘤,磁共振成像 (MRI)检查未见异常。遂终止妊娠
(MRI)检查未见异常。遂终止妊娠 ,引产组织和夫妻外周血行核心家系全外显子组测序(Trio-WES)检测发现与临床表型明确相关的致病性变异:胎儿携带TSC1c.2380C>T(p.Q794∗)杂合变异,变异来自男方,女方无变异,根据美国医学遗传学与基因组学学会(ACMG)评级,该变异被评定为致病,证据为:PVS1+PS4+PM2_Supporting,关联疾病为结节性硬化症
,引产组织和夫妻外周血行核心家系全外显子组测序(Trio-WES)检测发现与临床表型明确相关的致病性变异:胎儿携带TSC1c.2380C>T(p.Q794∗)杂合变异,变异来自男方,女方无变异,根据美国医学遗传学与基因组学学会(ACMG)评级,该变异被评定为致病,证据为:PVS1+PS4+PM2_Supporting,关联疾病为结节性硬化症 1型(OMIM:191100),为常染色体
1型(OMIM:191100),为常染色体 显性遗传(AD)。男方,30岁,父母已去世。夫妻结婚两年,性生活正常。现夫妻要求行胚胎植入前单基因遗传病检测(PGT-M)助孕。否认相关病史及家族传染病、特殊疾病史。月经史:初潮14岁,月经规律,末次月经2021年6月8日,G1P0。体格检查:男方自幼腹部、背部和左侧手臂散在牛奶咖啡斑,约铜钱大小,未见增大。女方全身及妇科检查
显性遗传(AD)。男方,30岁,父母已去世。夫妻结婚两年,性生活正常。现夫妻要求行胚胎植入前单基因遗传病检测(PGT-M)助孕。否认相关病史及家族传染病、特殊疾病史。月经史:初潮14岁,月经规律,末次月经2021年6月8日,G1P0。体格检查:男方自幼腹部、背部和左侧手臂散在牛奶咖啡斑,约铜钱大小,未见增大。女方全身及妇科检查 基本正常。
基本正常。
辅助检查:①女方:黄体期内分泌:卵泡刺激素(FSH)1.90U/L,黄体生成素(LH)2.40 U/L,雌二醇 (E2)447.86 pmol/L,孕酮
(E2)447.86 pmol/L,孕酮 (P)28.56 nmol/L,睾酮(T)0.50 nmol/L,催乳素(PRL)
(P)28.56 nmol/L,睾酮(T)0.50 nmol/L,催乳素(PRL) 33.4μg/L。卵巢储备功能:双侧窦卵泡数(AFC)11枚,抗苗勒管激素(AMH)2.65μg/L。甲状腺功能检查
33.4μg/L。卵巢储备功能:双侧窦卵泡数(AFC)11枚,抗苗勒管激素(AMH)2.65μg/L。甲状腺功能检查 正常,外周血染色体核型46,XX,余常规化验及生殖检查无异常。②男方:精液检查
正常,外周血染色体核型46,XX,余常规化验及生殖检查无异常。②男方:精液检查 :精子浓度49.09×106/ml,精子总数147.27×106个,前向运动(PR)27.0%,总活力32.0%;精子形态评估:正常形态百分率2.2%,精子DNA碎片指数(DFI)正常;生殖系统超声检查正常。外周血染色体核型46,XY,余检查无异常。门诊诊断:①女方:不良孕产史。②男方:弱精子症;畸形精子症;结节性硬化症1型(TSC1基因c.2380C>T杂合变异);骨折
:精子浓度49.09×106/ml,精子总数147.27×106个,前向运动(PR)27.0%,总活力32.0%;精子形态评估:正常形态百分率2.2%,精子DNA碎片指数(DFI)正常;生殖系统超声检查正常。外周血染色体核型46,XY,余检查无异常。门诊诊断:①女方:不良孕产史。②男方:弱精子症;畸形精子症;结节性硬化症1型(TSC1基因c.2380C>T杂合变异);骨折 手术史。
手术史。
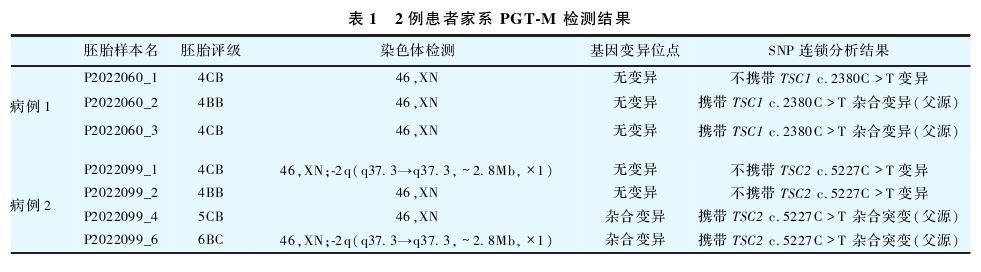
PGT-M助孕治疗:①家系预实验及单体型构建:2021年7月14日对家系成员(夫妻外周血和引产胎儿脐带血)变异位点验证,采用高通量测序、一代测序和多重连接探针扩增检测(MLPA)等方法行单基因病分子遗传检测,结果提示胎儿携带父源TSC1c.2380C>T杂合变异,女方无变异,见图1。同时,进行TSC1上下游2 Mb范围内的单核苷酸多态性(SNP)多重扩增和连锁分析,构建突变单体型(携带TSC1c.2380C>T)和正常单体型(不携带TSC1 c.2380C>T)。②促排卵及胚胎活检:2022年5月采用黄体期短效长方案行控制性超促排卵,6月取卵14枚,卵细胞质内单精子注射(ICSI)正常受精7枚,胚胎培养至第5天,获可活检囊胚3枚。使用MALBAC基因测序通用样本处理试剂盒说明Chrom SwiftTMKit(XK-028,Yikon Genomics)进行单细胞全基因组扩增(WGA)活检后,胚胎玻璃化冷冻保存。7月单基因病分子遗传检测报告提示:PGT-A检测提示3个囊胚均无染色体非整倍体或拷贝数异常;SNP单体型分析及Sanger测序示仅1号囊胚不携带TSC1c.2380C>T变异。见表1。经知情同意后,夫妻决定保留1号胚胎,并进行移植。
2022年8月28日选择1号囊胚(形态学评分4CB)进行冷冻胚胎移植(FET),见表1。移植后14 d和16 d外周血人绒毛膜促性腺激素(hCG)分别为1062 U/L和2803 U/L,成功临床妊娠。孕23周行羊膜腔穿刺术产前诊断,羊水细胞TSC1c.2380C>T位点检测以及染色体微阵列检查均未见异常。2023年5月(孕39周)顺产1例健康女婴,体质量3700 g,身长52cm。体格检查正常。出生后1年行心脏彩超检查未见异常。
病例2,26岁,因胎儿发育畸形引产后3月,于2022年2月就诊于甘肃省妇幼保健院。2021年孕26周超声检查提示胎儿左心室高回声,疑为心脏横纹肌瘤。羊水穿刺(唐氏综合征 快速分子诊断+染色体微缺失综合征)检查发现2号染色体q37.3区域存在2.7Mb致病性缺失(已排除母源污染),相关疾病为2q37缺失综合征,遂终止妊娠。2022年2月Trio-WES(夫妻双方及男方父母)检测示:①男方携带TSC2c.5227C>T(p.R1743W)杂合变异,女方及男方父母该位点无变异,根据ACMG指南,该变异评级为致病(PS2_VeryStrong+PS4+PS3_Moderate+PM1+PM2_Supporting+PP3),关联疾病为结节性硬化症2型(OMIM:613254),为AD;②女方2号染色体q37.3区域发生2.62Mb杂合缺失变异,该缺失区间涉及剂量敏感区域2q37.3终末区(包含HDAC4),关联疾病为2q37缺失综合征,根据ACMG评级该区间评级为致病。男方,28岁,夫妻结婚3年,性生活正常。现要求行PGT-M助孕。夫妻均有癫痫
快速分子诊断+染色体微缺失综合征)检查发现2号染色体q37.3区域存在2.7Mb致病性缺失(已排除母源污染),相关疾病为2q37缺失综合征,遂终止妊娠。2022年2月Trio-WES(夫妻双方及男方父母)检测示:①男方携带TSC2c.5227C>T(p.R1743W)杂合变异,女方及男方父母该位点无变异,根据ACMG指南,该变异评级为致病(PS2_VeryStrong+PS4+PS3_Moderate+PM1+PM2_Supporting+PP3),关联疾病为结节性硬化症2型(OMIM:613254),为AD;②女方2号染色体q37.3区域发生2.62Mb杂合缺失变异,该缺失区间涉及剂量敏感区域2q37.3终末区(包含HDAC4),关联疾病为2q37缺失综合征,根据ACMG评级该区间评级为致病。男方,28岁,夫妻结婚3年,性生活正常。现要求行PGT-M助孕。夫妻均有癫痫 病史,文化程度为小学,反应稍慢。女方近4年癫痫发作2次,言语稍慢。男方5~6岁有2次癫痫发作及银屑病
病史,文化程度为小学,反应稍慢。女方近4年癫痫发作2次,言语稍慢。男方5~6岁有2次癫痫发作及银屑病 病史。月经史:初潮13岁,月经规律。末次月经2022年1月28日,G1P0。体格检查:女方身高154 cm,体质量75 kg;体质量指数(BMI)31.62 kg/m2。面部鼻梁低平、V型鼻尖、上唇稍薄。男方全身散在色素脱失斑,主要分布于头皮、口腔、上肢和腰部,面部血管纤维瘤,余查体未见异常。
病史。月经史:初潮13岁,月经规律。末次月经2022年1月28日,G1P0。体格检查:女方身高154 cm,体质量75 kg;体质量指数(BMI)31.62 kg/m2。面部鼻梁低平、V型鼻尖、上唇稍薄。男方全身散在色素脱失斑,主要分布于头皮、口腔、上肢和腰部,面部血管纤维瘤,余查体未见异常。
辅助检查:女方FSH 7.8 U/L,LH 10.4 U/L,E2178.3pmol/L,P 0.92 nmol/L,T 1.08 nmol/L,PRL 17.5μg/L。卵巢储备功能:AFC 12个,AMH 5.91μg/L。甲状腺功能正常,外周血染色体核型46,XX。子宫内膜病理检查 提示增生反应的子宫内膜,结合免疫组化符合慢性非特异性子宫内膜炎。男方精液检查提示严重少弱畸精子症,生殖系统超声检查正常。外周血染色体核型46,XY,Y染色体Azfa、b、c区未见缺失。头颅MRI检查提示双侧侧脑室周围、室管膜下及额顶叶皮层下多发异常信号,疑为结节性硬化并左侧半卵圆中心及顶叶的软化灶。心脏彩超检查正常,余检查无异常。
提示增生反应的子宫内膜,结合免疫组化符合慢性非特异性子宫内膜炎。男方精液检查提示严重少弱畸精子症,生殖系统超声检查正常。外周血染色体核型46,XY,Y染色体Azfa、b、c区未见缺失。头颅MRI检查提示双侧侧脑室周围、室管膜下及额顶叶皮层下多发异常信号,疑为结节性硬化并左侧半卵圆中心及顶叶的软化灶。心脏彩超检查正常,余检查无异常。
门诊诊断:女方:不良孕产史;2q37缺失综合征;子宫内膜炎。男方:少弱畸精子症;结节性硬化症2型(TSC2c.5227C>T杂合变异);银屑病。
对女方给予甲硝唑 、多西环素
、多西环素 治疗子宫内膜炎14 d。PGT-M助孕治疗同病例1。家系预实验及单体型构建:2022年7月19日,夫妻外周血和羊水细胞检测示胎儿携带父源TSC2c.5227C>T杂合变异,女方无异常,见图2。成功构建亲本单倍型。促排卵及胚胎活检:10月采用黄体期短效长方案诱导排卵,获卵16枚,ICSI后正常受精10枚,于第5天获得可活检囊胚6枚。2022年11月18日,PGT-A检测结果提示1、2、4和6号囊胚为整倍体,1和6号囊胚2号染色体q37.3区域存在约2.80Mb缺失。基因变异及SNP单倍型分析示1和2号囊胚不携带父源TSC2c.5227C>T变异。见表1。知情同意后,夫妻决定保留不携带TSC2c.5227C>T变异且不携带2号染色体微缺失的2号囊胚。2022年12月选择2号囊胚(形态学评分4BB)移植,见表1,移植后14 d和16 d外周血h CG分别为2499 U/L和5569 U/L,成功妊娠。羊水穿刺与胚胎PGT-M一致,未见异常。于2023年9月(孕37+4周)剖宫产1例健康女婴,体质量3100 g,身长50 cm。电话随访婴儿发育正常。
治疗子宫内膜炎14 d。PGT-M助孕治疗同病例1。家系预实验及单体型构建:2022年7月19日,夫妻外周血和羊水细胞检测示胎儿携带父源TSC2c.5227C>T杂合变异,女方无异常,见图2。成功构建亲本单倍型。促排卵及胚胎活检:10月采用黄体期短效长方案诱导排卵,获卵16枚,ICSI后正常受精10枚,于第5天获得可活检囊胚6枚。2022年11月18日,PGT-A检测结果提示1、2、4和6号囊胚为整倍体,1和6号囊胚2号染色体q37.3区域存在约2.80Mb缺失。基因变异及SNP单倍型分析示1和2号囊胚不携带父源TSC2c.5227C>T变异。见表1。知情同意后,夫妻决定保留不携带TSC2c.5227C>T变异且不携带2号染色体微缺失的2号囊胚。2022年12月选择2号囊胚(形态学评分4BB)移植,见表1,移植后14 d和16 d外周血h CG分别为2499 U/L和5569 U/L,成功妊娠。羊水穿刺与胚胎PGT-M一致,未见异常。于2023年9月(孕37+4周)剖宫产1例健康女婴,体质量3100 g,身长50 cm。电话随访婴儿发育正常。
2 讨 论
结节性硬化症(tuberous sclerosis complex,TSC),又称Bournerille病,是一种由TSC1或TSC2变异引起的常染色体显性遗传性神经皮肤综合征 ,出生发生率约为1/10000~1/6000[1]。TSC2定位于染色体16p13.3,编码马铃著蛋白(tuberin蛋白),该蛋白与由TSC1(位于染色体9q34.13)编码的错钩瘤蛋白蛋白结合,形成TSC1-TSC2异二聚体复合物[2]。复合物中任一成员的变异都会破坏m TOR信号通路的正常调控,导致细胞增殖与生长失控,进而引发多系统疾病与肿瘤,尤其是在大脑、皮肤、心脏和肺部[3]。TSC的特征是多器官出现良性错构瘤[4,5]。其中,心脏横纹肌瘤在非TSC个体中发生率<1%[6],可在妊娠期发生[3]。因此,心脏横纹肌瘤作为子宫内检测TSC的标志物,可作为TSC的早期诊断标志[7]。此外,TSC错构瘤呈现年龄依赖性,如心脏横纹肌瘤常在胎龄32周前发病,表现为稳定或自发消退[6,8]。在本文中,观察到2例胎儿心脏横纹肌瘤,但其父亲(男方)的心脏彩超检查均未见异常。该现象可能与TSC错构瘤的年龄依赖性相关。因此,孕期超声检查对TSC的早期诊断具有重要临床价值。
,出生发生率约为1/10000~1/6000[1]。TSC2定位于染色体16p13.3,编码马铃著蛋白(tuberin蛋白),该蛋白与由TSC1(位于染色体9q34.13)编码的错钩瘤蛋白蛋白结合,形成TSC1-TSC2异二聚体复合物[2]。复合物中任一成员的变异都会破坏m TOR信号通路的正常调控,导致细胞增殖与生长失控,进而引发多系统疾病与肿瘤,尤其是在大脑、皮肤、心脏和肺部[3]。TSC的特征是多器官出现良性错构瘤[4,5]。其中,心脏横纹肌瘤在非TSC个体中发生率<1%[6],可在妊娠期发生[3]。因此,心脏横纹肌瘤作为子宫内检测TSC的标志物,可作为TSC的早期诊断标志[7]。此外,TSC错构瘤呈现年龄依赖性,如心脏横纹肌瘤常在胎龄32周前发病,表现为稳定或自发消退[6,8]。在本文中,观察到2例胎儿心脏横纹肌瘤,但其父亲(男方)的心脏彩超检查均未见异常。该现象可能与TSC错构瘤的年龄依赖性相关。因此,孕期超声检查对TSC的早期诊断具有重要临床价值。
TSC可累及多系统器官,临床表型异质性强,常见症状包括癫痫、智力障碍、皮肤色素脱失斑和脑内多发结节[9,10]。癫痫是TSC最常见的症状之一,约80%的患者在出生后第1年内发病[11]。TSC2变异和TSC1变异所致的癫痫表型在临床上存在差异,TSC2变异患者更早发作,且癫痫发生率更高[8,12]。此外,TSC2变异较TSC1变异更为常见[6],且伴随更为严重的临床表型,尤其在神经系统症状上[6,8,13]。在一项涉及52例TSC患儿的研究中[8],TSC2变异组的智力障碍发生率(88.6%)显著高于TSC1组(47%)。本病例中,男方分别为TSC1和TSC2变异携带者,均表现出TSC皮肤表型特征,其中TSC2变异患者(例2男方)还出现癫痫发作,且头颅MRI检查也符合TSC诊断标准。该变异位点c.5227C>T经父母验证,为自发变异,符合TSC2变异多见于散发病例的报道[8]。此外,病例1男方仅表现出皮肤异常,未见癫痫发作,仍需定期随访,关注TSC潜在临床症状。
2q37缺失综合征(del2q37,OMIM:600430),亦称Albright遗传性骨营养不良 综合征(AHO-like综合征)或短指(趾)智力障碍综合征(BDMR),是一种罕见的常染色体显性遗传病,具有临床异质性。其主要特征包括轻度至中度的发育迟缓
综合征(AHO-like综合征)或短指(趾)智力障碍综合征(BDMR),是一种罕见的常染色体显性遗传病,具有临床异质性。其主要特征包括轻度至中度的发育迟缓 或智力障碍、特征性面容、E型短指(趾)畸形、癫痫、身材矮小、肥胖、婴儿期肌张力
或智力障碍、特征性面容、E型短指(趾)畸形、癫痫、身材矮小、肥胖、婴儿期肌张力 低下以及伴有自闭症谱系障碍的行为异常[14~16]。该病于1995年首次被报道,目前全球约有115例确诊病例,大部分为新发病例,部分病例可遗传自表型正常的父母[14,15]。目前,组蛋白去乙酰化酶4(HDAC4)已被确定为导致BDMR综合征的关键遗传机制[15]。本文例2女方2q37.3缺失包括HDAC4,但未出现E型短指畸形。有研究报道[15],E型短指(趾)畸形是一种可变的临床体征,约50%的患者出现该症状。本文例2患者表现出特征性面部特征(鼻梁低平、V型鼻尖、薄上唇)、肥胖、癫痫发作、身高矮小和轻度言语交流迟缓等症状,符合2q37缺失综合征的临床特征。结合TrioWES分析,确诊为2q37缺失综合征。此综合征随着年龄增长,社交和语言能力可能会显著改善[15]。本例患者在语言沟通方面仅表现出轻度语言迟缓,这使得在年长时更难以诊断。因此,早期诊断对及时为患者提供疾病监测、遗传咨询及干预至关重要。
低下以及伴有自闭症谱系障碍的行为异常[14~16]。该病于1995年首次被报道,目前全球约有115例确诊病例,大部分为新发病例,部分病例可遗传自表型正常的父母[14,15]。目前,组蛋白去乙酰化酶4(HDAC4)已被确定为导致BDMR综合征的关键遗传机制[15]。本文例2女方2q37.3缺失包括HDAC4,但未出现E型短指畸形。有研究报道[15],E型短指(趾)畸形是一种可变的临床体征,约50%的患者出现该症状。本文例2患者表现出特征性面部特征(鼻梁低平、V型鼻尖、薄上唇)、肥胖、癫痫发作、身高矮小和轻度言语交流迟缓等症状,符合2q37缺失综合征的临床特征。结合TrioWES分析,确诊为2q37缺失综合征。此综合征随着年龄增长,社交和语言能力可能会显著改善[15]。本例患者在语言沟通方面仅表现出轻度语言迟缓,这使得在年长时更难以诊断。因此,早期诊断对及时为患者提供疾病监测、遗传咨询及干预至关重要。
本文病例2夫妻均有癫痫表现,但其病因截然不同(男方为TSC单基因变异,女方为2q37缺失综合征),提示同一家系中可能并存多类遗传病风险。这一复杂性进一步凸显了PGT-M技术在综合阻断单基因病与基因组病中的必要性。PGT-M技术可同时获取胚胎的染色体非整倍体、全基因组拷贝数变异(CNV)及致病变异的信息[17]。本文病例通过该技术均获得可移植胚胎。例1家系男方患有常染色体显性(AD)单基因遗传病,通过PGT-M后获得1枚整倍体且不携带父源变异(TSC1c.2380C>T)的正常囊胚(1号胚胎)。例2家系同时存在单基因疾病(TSC2)和基因组病(2q37微缺失综合征),经PGT-M同时有效阻断两种不同类型的遗传病,获得2枚不携带父源变异(TSC2c.5227C>T)的正常囊胚。同时,病例2家系1号和6号囊胚的2号染色体q37.3区域缺失与其母亲(例2女方)相应区域的缺失一致。经过遗传咨询,移植了不携带父母源变异的2号囊胚,最终2例家庭均成功妊娠并获得健康子代。显然,PGT-M技术具有避免治疗性终止妊娠显著的优势[18],是阻断遗传性疾病发生的重要辅助生殖技术 [20]。
[20]。
TSC基因变异具有表型异质性,本研究中TSC患者(男方)因表型轻微导致孕前漏诊,而胎儿心脏横纹肌瘤的超声检查异常成为遗传风险的关键提示。这一发现强调,对孕期异常表型的胎儿需进行遗传咨询与遗传检测,从而为PGT-M的及时干预提供依据。PGT-M是预防和减少出生缺陷的有效措施,其临床流程涵盖遗传咨询、辅助生殖治疗、胚胎活检、基因检测、胚胎移植、产前诊断验证和新生儿随访[19]。通过PGT-M技术,有效阻断了TSC1c.2380C>T和TSC2c.5227C>T致病变异所致的TSC及2q37缺失综合征在家系中的垂直传递,为携带类似单基因病及基因组病的家庭提供了重要生育决策依据。
参考文献略。
来源:陈芸汐,倪亚莉,晏博,等.TSC基因变异家系行胚胎植入前单基因遗传病检测成功助孕2例[J].实用妇产科杂志,2025,41(06):526-528.
