
多学科联合诊疗1例血栓性血小板减少性紫癜
作者:向国强,宋正芳,向航,吴耀辉等,恩施土家族苗族自治州中心医院血液,华中科技大学同济医学院附属协和医院
1 病例资料
患者,女,46岁,因“头痛 、呕血,发现血小板减少3d”于2023年3月20日入院。患者3月11日无明显诱因出现头痛,呈持续性钝痛,伴头晕、乏力,3月14日出现呕血,伴牙龈出血,在当地医院就诊,查血小板计数(PLT)5×109/L,总胆红素53.9μmol/L,直接胆红素16.5μmol/L,间接胆红素
、呕血,发现血小板减少3d”于2023年3月20日入院。患者3月11日无明显诱因出现头痛,呈持续性钝痛,伴头晕、乏力,3月14日出现呕血,伴牙龈出血,在当地医院就诊,查血小板计数(PLT)5×109/L,总胆红素53.9μmol/L,直接胆红素16.5μmol/L,间接胆红素 37.4μmol/L,给予止血对症治疗无好转,于3月20日入住华中科技大学同济医学院附属协和医院急诊科。血常规
37.4μmol/L,给予止血对症治疗无好转,于3月20日入住华中科技大学同济医学院附属协和医院急诊科。血常规 :白细胞计数(WBC)6.89×109/L,红细(RBC)2.03×1012/L,血红蛋白
:白细胞计数(WBC)6.89×109/L,红细(RBC)2.03×1012/L,血红蛋白 (Hb)64g/L,PLT7×109/L,给予输注红细胞纠正贫血、人免疫球蛋白
(Hb)64g/L,PLT7×109/L,给予输注红细胞纠正贫血、人免疫球蛋白 (5g)治疗后转入华中科技大学同济医学院附属协和医院血液内科。
(5g)治疗后转入华中科技大学同济医学院附属协和医院血液内科。
既往史:胆囊切除术、阑尾切除术。
入院体检:神志清楚,贫血貌,皮肤无出血点及瘀斑,巩膜黄染,乳房压痛,肺部听诊未闻及干湿性啰音。双下肢无水肿 。病理征阴性。
。病理征阴性。
实验室检查:血常规:WBC9.89×109/L,RBC2.03×1012/L,Hb64g/L,PLT7×109/L,网织红细胞0.38×109/L;生化:总胆红素58.4μmol/L,直接胆红素15.7μmol/L,谷丙转氨酶42U/L,谷草转氨酶84U/L,乳酸脱氢酶(LDH)1737U/L,肌酐28μmol/L,尿素氮 9.31mmol/L,肾小球滤过率89.63mL/(min/1.73m2),钾2.94mmol/L,C反应蛋白43 mg/L;弥散性血管内凝血
9.31mmol/L,肾小球滤过率89.63mL/(min/1.73m2),钾2.94mmol/L,C反应蛋白43 mg/L;弥散性血管内凝血 (DIC):D-二聚体
(DIC):D-二聚体 0.80mg/L,凝血酶原时间14.3s,纤维蛋白原1.57g/L,动脉血气分析
0.80mg/L,凝血酶原时间14.3s,纤维蛋白原1.57g/L,动脉血气分析 :p H7.33,血氧分压:110mmHg(1 mm Hg=0.133kPa),二氧化碳分压:49mmHg,ct Hb:5.4g/d L,s O2:99.7%,碳酸氢根离子:38.1 mmmol/L,乳酸:2.0 mmmol/L。自免全套:抗核抗体滴度核斑点型1∶100,抗核抗体滴度核仁型1∶100,抗SS-A抗体>8.0AI,免疫球蛋白G17.9g/L。外周血涂片
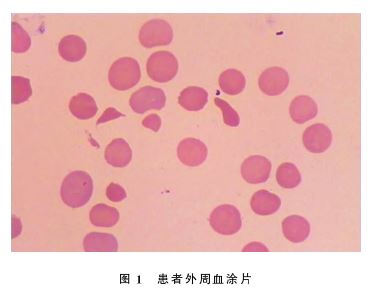
:p H7.33,血氧分压:110mmHg(1 mm Hg=0.133kPa),二氧化碳分压:49mmHg,ct Hb:5.4g/d L,s O2:99.7%,碳酸氢根离子:38.1 mmmol/L,乳酸:2.0 mmmol/L。自免全套:抗核抗体滴度核斑点型1∶100,抗核抗体滴度核仁型1∶100,抗SS-A抗体>8.0AI,免疫球蛋白G17.9g/L。外周血涂片 :可见棘形、梭形及破碎红细胞(破碎红细胞3%)(图1)。
:可见棘形、梭形及破碎红细胞(破碎红细胞3%)(图1)。
影像学检查:颅脑+肺部+腹部CT平扫 :脑内未见明显异常密度影;各脑室不大,中线结构居中;左肺多发磨玻璃影及实变影,右肺下叶多发条片影,心腔内密度减低。胃肠道未见明显梗阻扩张及积气积液征象。
:脑内未见明显异常密度影;各脑室不大,中线结构居中;左肺多发磨玻璃影及实变影,右肺下叶多发条片影,心腔内密度减低。胃肠道未见明显梗阻扩张及积气积液征象。
2 诊疗经过
患者起病后于2023年3月14日在当地医院行对症治疗,病情无好转,转入华中科技大学同济医学院附属协和医院急诊科,给予输血 、人免疫球蛋白治疗于3月20日入住血液内科,当日晚出现大汗伴抽搐,意识模糊、大小便失禁。急诊颅脑CT提示:脑内未见明显异常密度影;各脑室不大,中线结构居中。因重度贫血、血小板减少伴意识障碍
、人免疫球蛋白治疗于3月20日入住血液内科,当日晚出现大汗伴抽搐,意识模糊、大小便失禁。急诊颅脑CT提示:脑内未见明显异常密度影;各脑室不大,中线结构居中。因重度贫血、血小板减少伴意识障碍 于21日转入血液重症病房进一步诊治。3月22日患者出现昏迷,伴癫痫
于21日转入血液重症病房进一步诊治。3月22日患者出现昏迷,伴癫痫 发作,同时出现发热
发作,同时出现发热 、严重二氧化碳潴留,给予积极抗感染、呼吸机辅助呼吸等支持治疗。患者疾病进展迅速,组织相关科室进行疾病相关的多学科联合诊疗(MDT)讨论。
、严重二氧化碳潴留,给予积极抗感染、呼吸机辅助呼吸等支持治疗。患者疾病进展迅速,组织相关科室进行疾病相关的多学科联合诊疗(MDT)讨论。
3 MDT讨论结果
3.1 血液内科
患者病史及特点:①中年女性,起病急;②血小板明显减少;③有黄疸 、LDH升高、外周血可见破碎红细胞等微血管病性溶血性贫血
、LDH升高、外周血可见破碎红细胞等微血管病性溶血性贫血 ;④进行性加重的神经精神症状;⑤发热。患者合并重症感染、自身免疫性疾病相关指标异常,需高度怀疑血栓性血小板减少性紫癜
;④进行性加重的神经精神症状;⑤发热。患者合并重症感染、自身免疫性疾病相关指标异常,需高度怀疑血栓性血小板减少性紫癜 (TTP),应尽快完善ADAMTS13活性检测,排除溶血尿毒综合征(HUS)、DIC、HELLP综合征、Evans综合征、子痫、抗磷脂抗体
(TTP),应尽快完善ADAMTS13活性检测,排除溶血尿毒综合征(HUS)、DIC、HELLP综合征、Evans综合征、子痫、抗磷脂抗体 综合征等疾病,尽早行血浆置换
综合征等疾病,尽早行血浆置换 (PEX)一线治疗。
(PEX)一线治疗。
3.2 神经内科
患者入院前1周有头痛、呕血病史,血小板重度减少,病程中出现进行性加重的神经精神症状,需考虑:①颅内出血 可能;②颅内感染;③微血管病变;④脑炎。患者急诊颅脑CT未见明显异常,不排除颅内出血影像学假阴性可能,可在6~12h后复查或行颅脑MRI检查
可能;②颅内感染;③微血管病变;④脑炎。患者急诊颅脑CT未见明显异常,不排除颅内出血影像学假阴性可能,可在6~12h后复查或行颅脑MRI检查 ;若排除颅内出血,需行腰椎穿刺、脑电图
;若排除颅内出血,需行腰椎穿刺、脑电图 等检查,但患者血小板极低,存在穿刺禁忌;微血管病变引起的神经精神症状复杂多变,病变主要累及皮质下白质、基底节、丘脑等区域(小血管丰富区域),可导致多灶性、可逆性神经功能缺损,以TTP、HUS等疾病为代表;还需考虑感染性或自身免疫性脑炎
等检查,但患者血小板极低,存在穿刺禁忌;微血管病变引起的神经精神症状复杂多变,病变主要累及皮质下白质、基底节、丘脑等区域(小血管丰富区域),可导致多灶性、可逆性神经功能缺损,以TTP、HUS等疾病为代表;还需考虑感染性或自身免疫性脑炎 ,如HIV、梅毒
,如HIV、梅毒 、抗NMDA受体脑炎等。针对发作性抽搐,可加用左乙拉西坦
、抗NMDA受体脑炎等。针对发作性抽搐,可加用左乙拉西坦 或丙戊酸钠
或丙戊酸钠 控制症状。该患者仍需通过进一步检查明确出现神经精神症状的病因。
控制症状。该患者仍需通过进一步检查明确出现神经精神症状的病因。
3.3 呼吸内科
患者病情进展迅速,尤以神经精神症状明显,动脉血气提示二氧化碳潴留、高碳酸血症,不伴有低氧血症,目前不支持肺性脑病。肺性脑病是由于慢性呼吸衰竭 ,尤其是Ⅱ型呼吸衰竭,即Pa CO2升高伴低氧血症导致的高碳酸血症和缺氧,引发的神经精神障碍
,尤其是Ⅱ型呼吸衰竭,即Pa CO2升高伴低氧血症导致的高碳酸血症和缺氧,引发的神经精神障碍 综合征。肺性脑病症状多与血气异常平行,实验室检查肺性脑病PLT通常正常,无胆红素升高。因此,肺性脑病无法解释该患者神经精神症状,同时患者病情进展迅速,高碳酸血症、血小板减少、免疫学异常等,需进一步完善检查明确是否合并有脓毒血症、DIC、风湿免疫性疾病以及血液系统疾病。
综合征。肺性脑病症状多与血气异常平行,实验室检查肺性脑病PLT通常正常,无胆红素升高。因此,肺性脑病无法解释该患者神经精神症状,同时患者病情进展迅速,高碳酸血症、血小板减少、免疫学异常等,需进一步完善检查明确是否合并有脓毒血症、DIC、风湿免疫性疾病以及血液系统疾病。
3.4 风湿免疫科
患者为中年女性,起病急,实验室检查发现免疫学异常,提示合并风湿免疫性疾病可能,伴多系统病变,且神经精神症状重,需警惕狼疮性脑病、抗磷脂抗体综合征等疾病类型,仍需进一步完善肌炎抗体谱、抗磷脂抗体、狼疮抗凝物、抗中性粒细胞胞浆抗体(ANCA)等明确疾病类型。该患者合并肺部感染、呼吸衰竭,是否加用激素免疫抑制治疗需根据病情、最终疾病诊断以及有无其他活动性感染等因素综合决定,建议加用人免疫球蛋白冲击治疗。
3.5 治疗情况
经MDT讨论后,补充检查ADAMTS13活性检测为0,ADAMTS13抑制物滴度1.0BU。肌炎抗体谱、抗磷脂抗体、狼疮抗凝物、ANCA均为阴性。肝炎 检测阴性。自身免疫性脑炎相关检测阴性。结合患者病史、典型临床表现以及实验室检查,可明确诊断为TTP,立即行PEX清除自身抗体,同时在积极抗感染支持下予以激素免疫抑制治疗,期间出现消化道出血
检测阴性。自身免疫性脑炎相关检测阴性。结合患者病史、典型临床表现以及实验室检查,可明确诊断为TTP,立即行PEX清除自身抗体,同时在积极抗感染支持下予以激素免疫抑制治疗,期间出现消化道出血 、皮肤软组织感染、CRE(阴沟肠杆菌),给予加强抑酸护胃、调整抗感染方案,辅以呼吸机辅助呼吸、纠正酸中毒、改善贫血、抗癫痫等对症支持治疗,患者PLT逐渐升高,LDH水平降低,ADAMTS13酶活性恢复,神经精神症状消失,意识恢复,继续激素维持治疗并逐渐减停,PLT未再下降,病情好转后于2023年4月28日出院。院外患者每天口服醋酸泼尼松
、皮肤软组织感染、CRE(阴沟肠杆菌),给予加强抑酸护胃、调整抗感染方案,辅以呼吸机辅助呼吸、纠正酸中毒、改善贫血、抗癫痫等对症支持治疗,患者PLT逐渐升高,LDH水平降低,ADAMTS13酶活性恢复,神经精神症状消失,意识恢复,继续激素维持治疗并逐渐减停,PLT未再下降,病情好转后于2023年4月28日出院。院外患者每天口服醋酸泼尼松 30mg,每周监测血小板未下降,予以醋酸泼尼松每周减1片,1个月后复查ADAMTS13活性检测96%,停用激素治疗,至今疾病未复发。
30mg,每周监测血小板未下降,予以醋酸泼尼松每周减1片,1个月后复查ADAMTS13活性检测96%,停用激素治疗,至今疾病未复发。
4 讨论
本例MDT是1例TTP患者,临床以头痛为首发症状,检查发现贫血、血小板减少、胆红素升高,ADAMTS13活性检测为0,抑制物阳性,外周血涂片显示破碎红细胞>1%,有典型“三联征”临床表现,MDT讨论排除了HUS、DIC及神经系统疾病,TTP诊断明确,患者经PEX联合糖皮质激素 治疗,积极抗感染、纠正酸中毒、呼吸机辅助呼吸等及时有效的治疗,最终好转出院。
治疗,积极抗感染、纠正酸中毒、呼吸机辅助呼吸等及时有效的治疗,最终好转出院。
TTP是一种少见、严重的血栓性微血管病,主要临床特征包括微血管病性溶血性贫血、血小板减少、神经精神症状、发热和肾脏受累[1],即TTP典型“五联征”,但同时符合“五联征”的患者少见,有文献报道仅20%~40%的TTP患者出现经典“五联征”,多为病程晚期,多数表现为微血管病性溶血性贫血、血小板减少和神经精神症状为主的“三联征”[2]。TTP发病与ADAMTS13活性降低密切相关,ADAMTS13活性缺乏会引起超大血管性血友病 因子多聚体聚集,导致血小板不断黏附和聚集,使血小板异常堆积、微血栓形成,引起相应器官功能障碍[3-4]。根据ADAMTS13缺乏机制不同,TTP分为遗传性TTP(c TTP)和免疫性TTP(i TTP)。c TTP系ADAMTS13基因突变导致血浆ADAMTS13活性缺乏,常在感染、炎症或妊娠
因子多聚体聚集,导致血小板不断黏附和聚集,使血小板异常堆积、微血栓形成,引起相应器官功能障碍[3-4]。根据ADAMTS13缺乏机制不同,TTP分为遗传性TTP(c TTP)和免疫性TTP(i TTP)。c TTP系ADAMTS13基因突变导致血浆ADAMTS13活性缺乏,常在感染、炎症或妊娠 等促发因素下发病。i TTP多无明确原因(即特发性),也可能继发于感染、药物、肿瘤、自身免疫性疾病、造血干细胞移植
等促发因素下发病。i TTP多无明确原因(即特发性),也可能继发于感染、药物、肿瘤、自身免疫性疾病、造血干细胞移植 等。i TTP是最常见的临床类型,占TTP总例数的95%[4-5]。本例患者自身免疫性抗体阳性,不排除合并自身免疫性疾病可能。自身免疫性疾病可能会产生ADAMTS13抑制性抗体进而继发[6]。国内外报道最常继发于系统性红斑狼疮
等。i TTP是最常见的临床类型,占TTP总例数的95%[4-5]。本例患者自身免疫性抗体阳性,不排除合并自身免疫性疾病可能。自身免疫性疾病可能会产生ADAMTS13抑制性抗体进而继发[6]。国内外报道最常继发于系统性红斑狼疮 及结缔组织病,由于TTP发病率低,继发于自身免疫性疾病少见,目前确切发病率不详。国外研究显示,有9%~10%的TTP患者合并自身免疫性疾病[7-8]。
及结缔组织病,由于TTP发病率低,继发于自身免疫性疾病少见,目前确切发病率不详。国外研究显示,有9%~10%的TTP患者合并自身免疫性疾病[7-8]。
TTP起病急骤,累及多个系统和器官,病情凶险,易漏诊。以神经症状为首发症状者更为隐匿,主要表现为头痛、乏力、偏瘫、癫痫、意识障碍、记忆减退、言语及人格改变等。早期影像表现正常,有些患者可能后期才会有脑水肿或脑白质改变[9]。本例患者以头痛为首发症状,伴有贫血、出血表现,转入我院后病情迅速进展,以神经精神症状最为突出,有文献报道89%的患者起病时出现神经精神症状[10]。TTP早期诊断困难,或易被误诊为ITP、DIC以及其他神经系统疾病如病毒性脑炎 、脑血管病等,导致延误最佳治疗时机。若得不到及时诊治,早期死亡率高达90%[11]。尽早判断,及时应用PEX,预后明显改善,死亡率可从90%降低至10%[4]。目前PEX仍是TTP治疗的一线选择。通过体外血液循环去除ADAMTS13抗体,补充新鲜冰冻血浆为患者提供充足的ADAMTS13,减缓微血管血栓的形成。一旦诊断或拟诊断为TTP,可进行PEX(>2000mL),1~2次/d,直至患者症状缓解及血小板正常后再延长间隔时间[2]。获得性TTP具有自身免疫病特征,糖皮质激素是较为常用的治疗手段,能够减轻炎症反应,保护器官功能,抑制自身抗体产生,建议在PEX治疗的同时联合使用糖皮质激素治疗。针对i TTP急性发作期,在PEX基础上加用利妥昔单抗
、脑血管病等,导致延误最佳治疗时机。若得不到及时诊治,早期死亡率高达90%[11]。尽早判断,及时应用PEX,预后明显改善,死亡率可从90%降低至10%[4]。目前PEX仍是TTP治疗的一线选择。通过体外血液循环去除ADAMTS13抗体,补充新鲜冰冻血浆为患者提供充足的ADAMTS13,减缓微血管血栓的形成。一旦诊断或拟诊断为TTP,可进行PEX(>2000mL),1~2次/d,直至患者症状缓解及血小板正常后再延长间隔时间[2]。获得性TTP具有自身免疫病特征,糖皮质激素是较为常用的治疗手段,能够减轻炎症反应,保护器官功能,抑制自身抗体产生,建议在PEX治疗的同时联合使用糖皮质激素治疗。针对i TTP急性发作期,在PEX基础上加用利妥昔单抗 ,可降低ADAMTS13抑制物或Ig G抗体滴度,有效恢复血浆ADAMTS13活性,尽快缓解,减少复发[12]。研究表明,PEX联合利妥昔单抗治疗,尽早足够的PEX次数,不仅是影响患者治疗效果的重要因素,还是提高患者治疗有效率的重要手段[10]。该患者经PEX(1次/d)联合使用糖皮质激素治疗,PLT在治疗第12天开始逐渐恢复,第14天恢复正常(图2)。LDH水平在PEX治疗第5天呈逐渐下降趋势(图3),病情好转,痊愈出院。
,可降低ADAMTS13抑制物或Ig G抗体滴度,有效恢复血浆ADAMTS13活性,尽快缓解,减少复发[12]。研究表明,PEX联合利妥昔单抗治疗,尽早足够的PEX次数,不仅是影响患者治疗效果的重要因素,还是提高患者治疗有效率的重要手段[10]。该患者经PEX(1次/d)联合使用糖皮质激素治疗,PLT在治疗第12天开始逐渐恢复,第14天恢复正常(图2)。LDH水平在PEX治疗第5天呈逐渐下降趋势(图3),病情好转,痊愈出院。
总体而言,本例患者通过MDT合作,快速地对疾病做出了诊断与鉴别,及时行PEX联合糖皮质激素治疗,成功完成了对该患者的救治,改善了患者预后。TTP是罕见的血栓性微血管病,病程短,早期病死率高,早期识别和尽早治疗能显著降低病死率。对于具备典型的临床表现、ADAMTS13活性<10%,此类患者诊断不难,但多数患者临床表现存在明显个体差异,部分患者临床表现不具特征性,还需综合分析,排除HUS、DIC、HELLP综合征、Evans综合征、子痫、抗磷脂抗体综合征等,受实验室检测条件以及专业人员限制,疾病无法得到快速诊断及治疗。针对无法迅速检测酶活性的医疗机构,推荐使用灵敏度及特异度高的PLASMIC评分系统[13]进行危险度评估,评分为6~7分即可诊断并开始启动TTP治疗。PEX是治疗TTP的首选,可联合使用糖皮质激素以及利妥昔单抗提升治疗有效率,该患者因合并严重肺部感染,考虑免疫抑制反应,为降低感染加重风险,没有使用利妥昔单抗,在积极抗感染的基础上联合糖皮质激素治疗,最终使患者转危为安,病情好转出院。患者以神经精神症状为首发表现,血小板明显减少,伴有出血表现,原则上不建议血小板输注,可能会增加微血栓形成和器官损伤,导致病情加重,临床医师应提高对该病的警惕和认识。MDT合作可以更好地为患者提供快速精准的诊断、实施及时有效的治疗。
利益冲突 所有作者均声明不存在利益冲突
参考文献略。
来源:向国强,宋正芳,向航,等.多学科联合诊疗1例血栓性血小板减少性紫癜[J].临床血液学杂志,2025,38(7):529-532.
