
毛姆基质样高级别子宫内膜癌2例临床特点及病理分析
作者:张圆,马瑛等,电子科技大学医学院,电子科技大学医学院附属绵阳医院生殖医学中心
1病例简介
病例1,患者,女,67岁,因“绝经 后阴道流血6d”于2022年6月21日收入院。6d前患者间断性阴道流血,量少,偶伴腹痛。妇科检查
后阴道流血6d”于2022年6月21日收入院。6d前患者间断性阴道流血,量少,偶伴腹痛。妇科检查 :子宫增大如孕2月,质硬,欠活动,无压痛;妇科B超:子宫增大,内膜厚0.6cm;女性肿瘤标记物:未见异常;子宫内膜活检
:子宫增大如孕2月,质硬,欠活动,无压痛;妇科B超:子宫增大,内膜厚0.6cm;女性肿瘤标记物:未见异常;子宫内膜活检 :子宫内膜样癌(FIGO 3级)。盆腔MR:子宫内膜癌
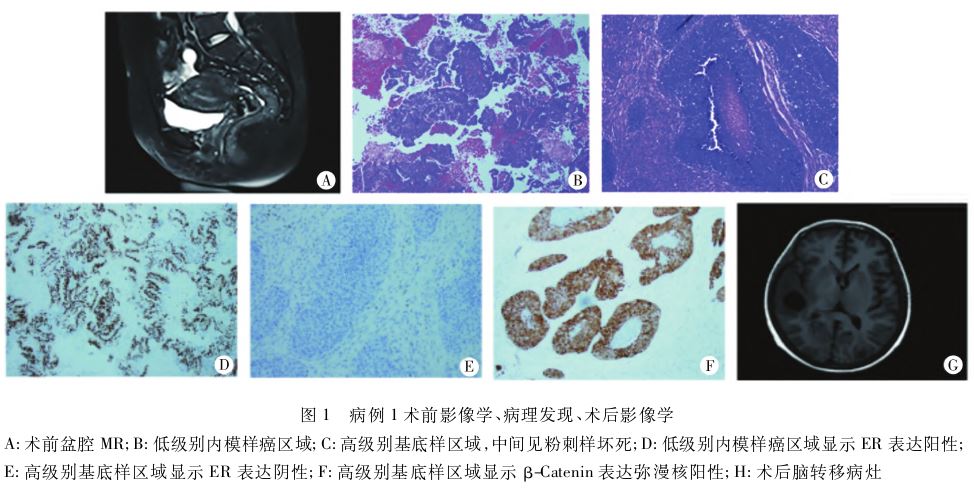
:子宫内膜样癌(FIGO 3级)。盆腔MR:子宫内膜癌 ,累及基层<1/2(FIGOⅠa期)(图1A)。完善各项检查后,行开腹全子宫切除术+双附件切除术+盆腔淋巴结切除术+腹主动脉淋巴结切除术+大网膜切除术。术中探查见:盆腹腔少量血性腹水
,累及基层<1/2(FIGOⅠa期)(图1A)。完善各项检查后,行开腹全子宫切除术+双附件切除术+盆腔淋巴结切除术+腹主动脉淋巴结切除术+大网膜切除术。术中探查见:盆腹腔少量血性腹水 ,子宫增大,表面光滑;双附件外观未见异常,盆腹腔淋巴结未见明显肿大,大网膜边缘可见一直径约1cm质硬结节。剖视子宫见宫腔形态规则,子宫内膜光滑,未见明显赘生物。术后病检初步诊断:子宫内膜样腺癌(FIGO 3级),建议上级医院病理切片会诊进一步明确。病理切片会诊病检回示:肿瘤肌层浸润深度约75%,脉管内有癌栓。肿瘤组织由高级别基底样实性区和低级别腺样区组成,实性区肿瘤细胞呈巢状,存在广泛的粉刺样坏死。双侧宫旁组织、宫颈、双附件未见癌转移,大网膜可见癌转移。免疫组化:高级别基底样区β-catenin弥漫(+),ER、PR、PAX8(-),CDX2(+),MMR完整[MLH1、MSH2、MSH6、PMS2(+)],CK5/6(灶+),CK7(+),p16(散在+),p40(-),p53野生型;低级别腺样区β-catenin(灶+),ER、PR、PAX8(+),CDX2(-),MMR、p16、p53的表达与高级别区相似;PD-L1、FOLR、HER2(-),POLE(-);二代测序:CTNNB1基因第3号外显子突变,突变位点为c.110C>T。根据形态学和免疫组化结果,经妇科病理专家Wenxin Zheng教授咨询,最终诊断:毛姆基质样高级别子宫内膜癌(Ⅳ期)(图1B~F)。患者术后接受6周期白蛋白紫杉醇
,子宫增大,表面光滑;双附件外观未见异常,盆腹腔淋巴结未见明显肿大,大网膜边缘可见一直径约1cm质硬结节。剖视子宫见宫腔形态规则,子宫内膜光滑,未见明显赘生物。术后病检初步诊断:子宫内膜样腺癌(FIGO 3级),建议上级医院病理切片会诊进一步明确。病理切片会诊病检回示:肿瘤肌层浸润深度约75%,脉管内有癌栓。肿瘤组织由高级别基底样实性区和低级别腺样区组成,实性区肿瘤细胞呈巢状,存在广泛的粉刺样坏死。双侧宫旁组织、宫颈、双附件未见癌转移,大网膜可见癌转移。免疫组化:高级别基底样区β-catenin弥漫(+),ER、PR、PAX8(-),CDX2(+),MMR完整[MLH1、MSH2、MSH6、PMS2(+)],CK5/6(灶+),CK7(+),p16(散在+),p40(-),p53野生型;低级别腺样区β-catenin(灶+),ER、PR、PAX8(+),CDX2(-),MMR、p16、p53的表达与高级别区相似;PD-L1、FOLR、HER2(-),POLE(-);二代测序:CTNNB1基因第3号外显子突变,突变位点为c.110C>T。根据形态学和免疫组化结果,经妇科病理专家Wenxin Zheng教授咨询,最终诊断:毛姆基质样高级别子宫内膜癌(Ⅳ期)(图1B~F)。患者术后接受6周期白蛋白紫杉醇 +顺铂
+顺铂 辅助化疗并定期复查,随访9个月时,因继发脑转移病情危重死亡(图1G)。
辅助化疗并定期复查,随访9个月时,因继发脑转移病情危重死亡(图1G)。
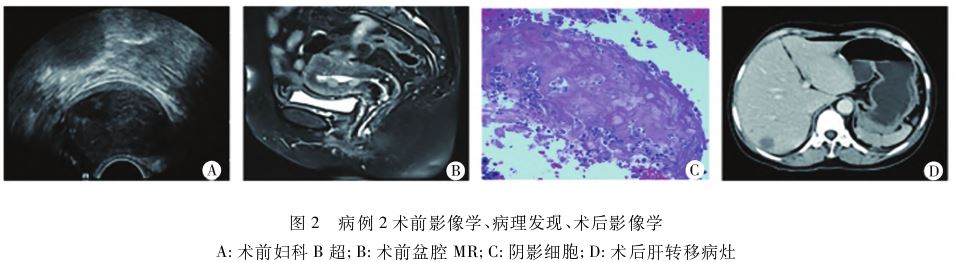
病例2,患者,女,72岁,因“绝经后阴道流血3+月”于2023年2月5日收入院。患者已绝经12年,3+月前出现阴道流血,量似既往月经量,持续8d后出血自行停止,之后反复出现阴道点滴出血。妇科检查:子宫稍增大,欠活动,压痛(+),余未扪及异常;妇科B超:宫腔内见4cm×3cm囊实性混合回声团(图2A);血清CA125:632.64U/m L,CA199:116.23U/m L;子宫内膜活检:子宫内膜样癌(FIGO 3级)。盆腔MR:考虑子宫内膜癌,累及肌层>1/2(FIGOⅠb期)(图2B)。完善检查后行开腹全子宫切除术+双附件切除术+盆腔淋巴结切除术+腹主动脉淋巴结切除术。术中探查见:盆腹腔少量积液,子宫稍饱满,左侧宫角略向外凸,双附件外观未见明显异常,盆腹腔淋巴结未见明显肿大。剖视子宫:宫腔形态规则,宫腔延伸至宫颈管内可见大小4cm×3cm烂鱼肉样槽脆组织。术后病检初步诊断:子宫内膜样癌(FIGO 2级)伴鳞化,建议上级医院病理切片会诊进一步明确。上级医院病理会诊,建议其他专家会诊。经Wenxin Zheng教授咨询,该病例除表达阴影细胞外,
余病理表现与上例病例相同,也为毛姆基质样高级别子宫内膜癌。具体病理发现:肿瘤肌层浸润深度约70%。肿瘤组织由高级别基底样实性区和低级别腺样区组成,实性区肿瘤细胞呈巢状,巢中央可见阴影细胞(细胞轮廓清晰,核仁不明显,有丝分裂活性丰富)(图2C)。双侧宫角、颈体交界、双侧宫旁组织:均查见癌累及。免疫组化:高级别基底样区β-catenin弥漫(+),ER、PR(-),PAX8(灶+),CDX2(+),MMR完整[MLH1、MSH2、MSH6、PMS2(+)],CK5/6(灶+),CK7(+),p16(散在+),p40(-),p53野生型;低级别腺样区β-catenin(灶+),ER、PR、PAX8(+),CDX2(-),MMR、p16、p53的表达与高级别区相似;PD-L1、FOLR(-)、HER2(1+,低表达),POLE(-);二代测序:CTNNB1基因第3号外显子突变,突变位点为c.121A>G。根据形态学和免疫组化结果,最终诊断:毛姆基质样高级别子宫内膜癌(Ⅲb期)。患者明确诊断后接受4个周期化疗同步放疗,随访10个月时,虽存活但出现腹膜后和肝远处转移(图2D)。
2讨论
毛姆基质样高级别子宫内膜癌(pilomatrixlike highgradeendometrial carcinoma,PiMHEC)是一种新被认识的子宫内膜样癌亚型,因其在形态学和免疫表型上与皮肤毛基质癌相似而得名,由Weisman等[1] 于2022年首次报道。其特征为高级别基底样成分和低级别子宫内膜样成分共存,前者以地图样肿瘤细胞坏死和阴影细胞为特点。目前,PiMHEC的临床研究多为个案报道,截至2024年,全球范围内仅发表5篇关于子宫PiMHEC的文章,累计病例数16例,均来自国外[1-5], 国内尚未见相关报道。另有6例卵巢PiMHEC病例,其中2例由我国学者报道[6],4例为国外报道[7] 。但由于病例稀少,其流行病学特征和临床特点有待更多大样本研究加以阐明。
2.1临床特点PiMHEC临床侵袭性强,预后不佳。Weisman首次报道的5例患者中,3例就诊时已有肝、肺、淋巴结等远处转移,仅1例疾病局限于子宫,但该患者不久便出现肺和肝转移;5例患者在诊断后7~24个月死亡,平均生存时间为13.4个月[1-2] 。此后Weisman又发现8例PiMHEC,其中6例就诊时已有区域淋巴结或肝、肺等远处转移;8例中有5例在诊断后3~11个月死亡,平均生存时间为8.9个月[2] 。
Keane等[4] 报道1例29岁PiMHEC患者,该患者就诊时即有肺转移,随访6个月时出现脑转移。本文2例患者分期晚(Ⅲ~Ⅳ期),例1患者于术后9个月死于脑转移,例2患者随访10个月出现肝等远处转移,进一步印证了该肿瘤的高转移率、快速进展和不良预后特征。
2.2病理特征PiMHEC由高级别实性区与低级别腺样区构成。高级别实性区肿瘤细胞呈基底样或鳞状上皮样,细胞异型性显著,可见粉刺样细胞坏死及阴影细胞;低级别腺样区为子宫内膜样成分。阴影细胞常巢状分布于肿瘤组织中,细胞边界不如正常细胞清晰。其通过细胞分化方式坏死、凋亡,但在一定时间内仍保持活性。2015年,Zamecnik等[8] 首 次在子宫内膜样癌中报道细胞分化现象。Nakamura等[9] 研究发现,伴有鳞状分化的子宫内膜样癌中,阴影细胞来源于桑葚样鳞状上皮,这一发现建立了基底细胞与鳞状上皮的联系。需特别指出的是,阴影细胞的表达呈异质性,可能局灶性表达甚至完全确实,这一特点增加了病理诊断的难度,易导致误诊。本文例1患者虽无阴影细胞表达,最终仍确诊为PiMHEC。
2.3免疫组化特征PiMHEC的高级别区域中,β-catenin弥漫(+),CDX2(灶+/弥漫+),ER、PR(-)。此外,CK7(灶+/弥漫+)、p53野生型、p16(散在+)、神经内分泌肿瘤标记物如突触素、嗜铬粒蛋白等(灶+)等也是其免疫组化特征。低级别
区域β-catenin(灶+),ER、PR、PAX8(+),CDX2(-),p16、p53的表达与高级别区相似。早期研究认为所有PiMHEC病例均无MMR缺陷[1],但后续研究又发现了MMR缺陷病例[2] 。
这些独特的免疫组化特征使PiMHEC易与其他妇科肿瘤 等混淆,增加了诊断难度。本文2例患者免疫组化结果均符合上述特征,为临床诊断提供了重要参考。
等混淆,增加了诊断难度。本文2例患者免疫组化结果均符合上述特征,为临床诊断提供了重要参考。
2.4分子遗传学特征PiMHEC存在CTNNB1基因第3号外显子突变。CTNNB1编码β-catenin,在Wnt信号转导通路中起关键作用[10],当CTNNB1基因发生突变时可能致使βcatenin蛋白异常聚集,激活下游靶基因,促进细胞增殖、抑制凋亡,进而驱动肿瘤发生,还可能使肿瘤细胞呈现毛发 基质细胞分化特征。除PiMHEC外,CTNNB1基因突变还见于非典型子宫息肉样腺肌瘤[4] 、卵巢PiMHEC[6-7] 、乳腺癌
基质细胞分化特征。除PiMHEC外,CTNNB1基因突变还见于非典型子宫息肉样腺肌瘤[4] 、卵巢PiMHEC[6-7] 、乳腺癌 [11] 等。
[11] 等。
PiMHEC还可能出现PTEN、ARID1A、PIK3CA等基因的突变,凸显了其分子复杂性,表明有必要进一步研究其发病机制。本文2例患者均存在CTNNB1基因第3号外显子突变(c.134C>T;c.121A>G),病例1还存在PTEN基因的突变,病例2存在ARID1A基因的突变,这一发现为深入探索PiMHEC的发病机制提供了新的分子证据。
2.5鉴别诊断PiMHEC与其他高级别恶性肿瘤的组织学和免疫表型存在重叠,且目前对其认识有限,诊断颇具挑战性,易误诊,需与以下疾病鉴别:(1)伴有鳞状分化的高级别子宫内膜样癌。两者都有实性高级别成分,均可出现β-catenin异常表达及CTNNB1基因突变[12] 。但PiMHEC的ER(-),可见阴影细胞和地图样肿瘤细胞坏死;鳞状分化的高级别子宫内膜样癌ER(+),肿瘤坏死较少,无阴影细胞。(2)鳞状细胞癌 。原发于子宫的鳞状细胞癌极为罕见[13], p63、p40通常弥漫阳性,若为宫颈鳞状细胞癌累及,则p16弥漫表达;而PiMHEC中p63、p40阴性或少部分阳性,p16斑片状阳性。当PiMHEC中低级别子宫内膜样癌成分极少时,易误诊为鳞状细胞癌。(3)去分化子宫内膜癌。该疾病镜下也有低级别与高级别成分共存,ER表达与PiMHEC相似,但去分化子宫内膜癌的高级别成分由未分化癌细胞组成,β-catenin(-),无阴影细胞。本文2例初诊误诊病例充分反映了PiMHEC诊断的复杂性,强调需综合组织形态、免疫表型及分子特征进行鉴别诊断。
。原发于子宫的鳞状细胞癌极为罕见[13], p63、p40通常弥漫阳性,若为宫颈鳞状细胞癌累及,则p16弥漫表达;而PiMHEC中p63、p40阴性或少部分阳性,p16斑片状阳性。当PiMHEC中低级别子宫内膜样癌成分极少时,易误诊为鳞状细胞癌。(3)去分化子宫内膜癌。该疾病镜下也有低级别与高级别成分共存,ER表达与PiMHEC相似,但去分化子宫内膜癌的高级别成分由未分化癌细胞组成,β-catenin(-),无阴影细胞。本文2例初诊误诊病例充分反映了PiMHEC诊断的复杂性,强调需综合组织形态、免疫表型及分子特征进行鉴别诊断。
2.6治疗目前尚未建立统一的治疗标准,既往报道多采用手术联合放化疗。手术治疗原则:早期行全面分期手术,晚期则行肿瘤细胞减灭术。鉴于其侵袭性强,术后常辅助放化疗。Weisman等[2] 报道1例术后接受放化疗联合免疫治疗的患者在治疗初期即死亡;Ajmal等[5] 报道1例新辅助化疗后手术并接受免疫的患者获得18个月无病生存,这体现了治疗反应存在个体差异。本文2例患者PD-L1、FOLR1表达均阴性,HER2为阴性/低表达,提示现有免疫治疗或靶向治疗在PiMHEC治疗中的的适用性可能有限,迫切需要探索新的治疗策略。
综上所述,PiMHEC是罕见且侵袭性强的恶性肿瘤,具有高级别与低级别成分共存、阴影细胞存在、弥漫性β-cate-nin表达及CTNNB1基因第3号外显子突变等特征。该病易误诊、预后差,正确认识和诊断对临床诊疗十分关键。
参考文献略。
来源:现代妇产科进展2025年6月第34卷第6期
