
TBL1XR1/RARB融合基因阳性急性早幼粒细胞白血病1例
作者:王瑶,黄珍,黄婷婷,谷书戈等,王菊香温州医科大学附属第二医院育英儿童医院
儿童急性早幼粒细胞白血病 (acute promyelocytic leukemia,APL)是急性髓细胞白血病(acute myeloid leukemia,AML)的一种独特亚型,以骨髓中异常增生的早幼粒细胞为主要特征,占儿童AML的5%~10%,因砷剂及维甲酸的联合治疗,APL治愈率可达90%以上[1]。其中PML/RARA融合基因阳性的APL为其经典型,随着转录组测序技术(RNA-sequencing/RNA-seq)在临床上的不断应用,PML/RARA融合基因阴性的APL(也称变异型APL)也逐渐被发现。笔者报告1例TBL1XR1/RARB融合基因阳性的变异型APL。
(acute promyelocytic leukemia,APL)是急性髓细胞白血病(acute myeloid leukemia,AML)的一种独特亚型,以骨髓中异常增生的早幼粒细胞为主要特征,占儿童AML的5%~10%,因砷剂及维甲酸的联合治疗,APL治愈率可达90%以上[1]。其中PML/RARA融合基因阳性的APL为其经典型,随着转录组测序技术(RNA-sequencing/RNA-seq)在临床上的不断应用,PML/RARA融合基因阴性的APL(也称变异型APL)也逐渐被发现。笔者报告1例TBL1XR1/RARB融合基因阳性的变异型APL。
1病例资料
患儿,女,初诊年龄1岁10个月,因“发热 3 d,神软半天,惊厥
3 d,神软半天,惊厥 1次”于2022年12月27日首次入院。查体:神志尚清,精神软,面色、口唇苍白,中度贫血
1次”于2022年12月27日首次入院。查体:神志尚清,精神软,面色、口唇苍白,中度贫血 貌,全身皮肤未见明显出血点及皮疹
貌,全身皮肤未见明显出血点及皮疹 ,巩膜无明显黄染,眼睑轻度浮肿,双侧瞳孔3 mm,等大等圆,对光反射存,呼吸平稳,浅表淋巴结未及肿大,咽充血,双侧扁桃体I°肿大,未见脓点,两肺呼吸音粗,未闻及明显干湿啰音,心律齐,心音中,心前区未闻及明显杂音,腹平软,肝脾肋下未及,四肢肌力V级,肌张力正常,颈软,Kernig征(-),Brudzinski征(-),两侧Babinski征(-),膝腱反射(++),毛细血管再充盈时间(capillary refill time,CRT)3 s。 实验室检查,血常规
,巩膜无明显黄染,眼睑轻度浮肿,双侧瞳孔3 mm,等大等圆,对光反射存,呼吸平稳,浅表淋巴结未及肿大,咽充血,双侧扁桃体I°肿大,未见脓点,两肺呼吸音粗,未闻及明显干湿啰音,心律齐,心音中,心前区未闻及明显杂音,腹平软,肝脾肋下未及,四肢肌力V级,肌张力正常,颈软,Kernig征(-),Brudzinski征(-),两侧Babinski征(-),膝腱反射(++),毛细血管再充盈时间(capillary refill time,CRT)3 s。 实验室检查,血常规 :白细胞17.64×109/L,粒细胞比例15%,淋巴细胞比例24%,单核细胞比例3%,血红蛋白
:白细胞17.64×109/L,粒细胞比例15%,淋巴细胞比例24%,单核细胞比例3%,血红蛋白 73 g/L,平均红细胞体积84.5 fL,红细胞平均血红蛋白含量27.5 pg,平均红细胞血红蛋白浓度326 g/L,幼稚细胞53%,似异常早幼粒细胞,血小板46×109/L。凝血功能:凝血酶原时间14 s、活化部分凝血酶原时间43.3 s、纤维蛋白原1.87 g/L, D-二聚体
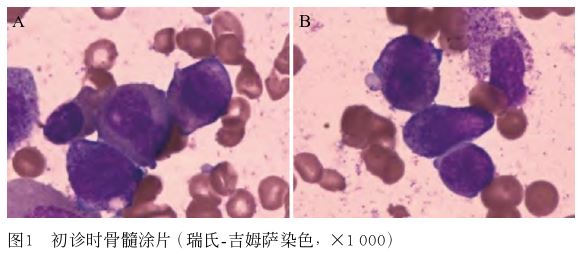
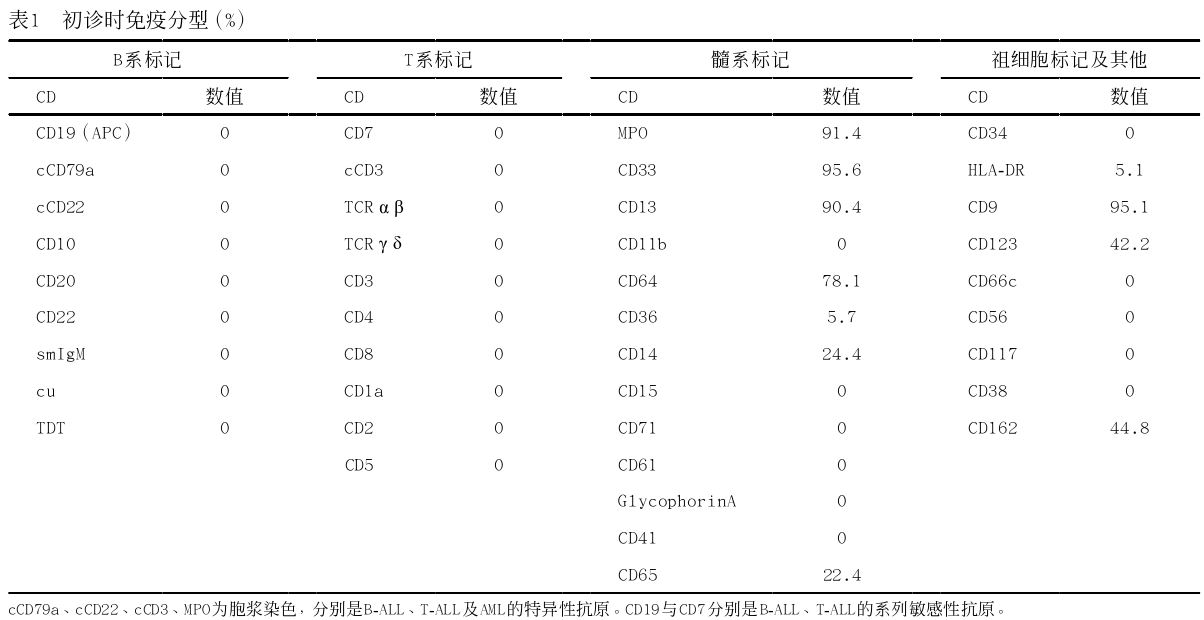
73 g/L,平均红细胞体积84.5 fL,红细胞平均血红蛋白含量27.5 pg,平均红细胞血红蛋白浓度326 g/L,幼稚细胞53%,似异常早幼粒细胞,血小板46×109/L。凝血功能:凝血酶原时间14 s、活化部分凝血酶原时间43.3 s、纤维蛋白原1.87 g/L, D-二聚体 >20 μg/mL。入院后行骨髓穿刺术,骨髓常规:APL,倾向于M3b(图1)。骨髓免疫分型:骨髓中63.6%异常髓系细胞,符合APL。MPO 91.4%、CD33 95.6%、CD13 90.4%、CD11b 0、CD64 78.1%、CD36 5.7%、CD14 24.4%、CD65 22.4%,不表达CD15、CD71、CD61、CD41、GlycophorinA(表1)。染色体
>20 μg/mL。入院后行骨髓穿刺术,骨髓常规:APL,倾向于M3b(图1)。骨髓免疫分型:骨髓中63.6%异常髓系细胞,符合APL。MPO 91.4%、CD33 95.6%、CD13 90.4%、CD11b 0、CD64 78.1%、CD36 5.7%、CD14 24.4%、CD65 22.4%,不表达CD15、CD71、CD61、CD41、GlycophorinA(表1)。染色体 :46,XX,N[10],PML/RARa阴性,RARA重排阴性,RNA-seq:TBL1XR1/RARB阳性。病初考虑为APL,按照《CCCG-APL-2017急性早幼粒细胞白血病治疗研究方案》立即(2022年12月28日)给予全反式维甲酸[ATRA,25~30 mg/(m2·d)分2次口服,实际用量 10 mg,每日1次口服]治疗,治疗第7天(2023年1月3日)融合基因结果回报PML/RARA阴性,故在治疗第8天(2023年1月4日)再次行骨髓穿刺评估:骨髓常规:髓象增生活跃,异常早幼粒细胞占12.5%。同一天加用了亚砷酸
:46,XX,N[10],PML/RARa阴性,RARA重排阴性,RNA-seq:TBL1XR1/RARB阳性。病初考虑为APL,按照《CCCG-APL-2017急性早幼粒细胞白血病治疗研究方案》立即(2022年12月28日)给予全反式维甲酸[ATRA,25~30 mg/(m2·d)分2次口服,实际用量 10 mg,每日1次口服]治疗,治疗第7天(2023年1月3日)融合基因结果回报PML/RARA阴性,故在治疗第8天(2023年1月4日)再次行骨髓穿刺评估:骨髓常规:髓象增生活跃,异常早幼粒细胞占12.5%。同一天加用了亚砷酸 氯化钠
氯化钠 针[0.2 mg/(kg·d) 静滴,实际用量2.2 mg,每日1次静滴]治疗。化疗第21天(2023年1月19日)评估:骨髓常规:髓象增生明显活跃,异常早幼粒细胞占30.5%,异常早幼粒细胞较前2周前升高,微小残留病变(minimalresiduallesions,MRD)示髓系细胞约占有核细胞的90.25%,比例明显增高,考虑存在发育异常;其中CD11b较初诊时明显升高(初诊时CD116阳性细胞为0,治疗后阳性细胞上升为15.6%,表1)。考虑到患儿为PML/RARA阴性的APL,同时维甲酸+砷剂治疗效果欠佳,在维甲酸诱导分化的第26天(2023年1月23日)化疗方案更改为《国家儿童医学中心(上海)儿童急性髓细胞白血病01方案(NCMCs-AML01)》。
针[0.2 mg/(kg·d) 静滴,实际用量2.2 mg,每日1次静滴]治疗。化疗第21天(2023年1月19日)评估:骨髓常规:髓象增生明显活跃,异常早幼粒细胞占30.5%,异常早幼粒细胞较前2周前升高,微小残留病变(minimalresiduallesions,MRD)示髓系细胞约占有核细胞的90.25%,比例明显增高,考虑存在发育异常;其中CD11b较初诊时明显升高(初诊时CD116阳性细胞为0,治疗后阳性细胞上升为15.6%,表1)。考虑到患儿为PML/RARA阴性的APL,同时维甲酸+砷剂治疗效果欠佳,在维甲酸诱导分化的第26天(2023年1月23日)化疗方案更改为《国家儿童医学中心(上海)儿童急性髓细胞白血病01方案(NCMCs-AML01)》。
诱导治疗选择DA方案诱导化疗(DA方案:柔红霉素 50 mg/m2静滴d1、d3、d5;阿糖胞苷
50 mg/m2静滴d1、d3、d5;阿糖胞苷 100 mg/m2 q12 h 静滴d1~7;实际砷剂治疗了16 d,后因感染推迟了DA化疗)。DA化疗结束后(2023年2月17日)复查骨髓常规示骨髓增生减低(取材混血)、MRD阴性、TBL1XR1/RARB融合基因转阴,2023年2月21日开始巩固治疗,方案选择了米托蒽醌
100 mg/m2 q12 h 静滴d1~7;实际砷剂治疗了16 d,后因感染推迟了DA化疗)。DA化疗结束后(2023年2月17日)复查骨髓常规示骨髓增生减低(取材混血)、MRD阴性、TBL1XR1/RARB融合基因转阴,2023年2月21日开始巩固治疗,方案选择了米托蒽醌 脂质体+大剂量阿糖胞苷+维甲酸方案化疗(米托蒽醌脂质体 8 mg/m2 d1+大剂量阿糖胞苷3 g/m2/次 q12 h静滴d1~3 +维甲酸45 mg/m2 d1~14 po三联鞘注d1),巩固治疗共4次。在第1次巩固治疗治疗结束、骨髓抑制恢复后,复查骨髓常规示完全缓解、MRD转阴、TBL1XR1/RARB融合基因转阴。结合维甲酸治疗7 d后的骨髓常规及21 d维甲酸+14 d亚砷酸治疗后的MRD结果显示出诱导分化效果,可以判断维甲酸对该病例有一定的治疗效果。维持治疗期间按照CCCG-APL-2017低危组维持方案化疗:复方黄黛片
脂质体+大剂量阿糖胞苷+维甲酸方案化疗(米托蒽醌脂质体 8 mg/m2 d1+大剂量阿糖胞苷3 g/m2/次 q12 h静滴d1~3 +维甲酸45 mg/m2 d1~14 po三联鞘注d1),巩固治疗共4次。在第1次巩固治疗治疗结束、骨髓抑制恢复后,复查骨髓常规示完全缓解、MRD转阴、TBL1XR1/RARB融合基因转阴。结合维甲酸治疗7 d后的骨髓常规及21 d维甲酸+14 d亚砷酸治疗后的MRD结果显示出诱导分化效果,可以判断维甲酸对该病例有一定的治疗效果。维持治疗期间按照CCCG-APL-2017低危组维持方案化疗:复方黄黛片 3周→ATRA 6周→复方黄黛片3周→ATRA 6周→复方黄黛片3周[复方黄黛片60 mg/(kg·d)每日3次口服;ATRA 45 mg/(m2·d)分2~3次口服)],2024年2月28日停药(维持治疗8个月,总疗程14个月)。监测骨髓常规、MRD及TBL1XR1/RARB融合基因持续转阴。
3周→ATRA 6周→复方黄黛片3周→ATRA 6周→复方黄黛片3周[复方黄黛片60 mg/(kg·d)每日3次口服;ATRA 45 mg/(m2·d)分2~3次口服)],2024年2月28日停药(维持治疗8个月,总疗程14个月)。监测骨髓常规、MRD及TBL1XR1/RARB融合基因持续转阴。
2讨论
PML/RARA阴性APL又称变异型APL,目前报道的变异型APL融合基因包括:ZBTB16/RARA、NPM/RARA、NuMA/RARA、STAT5b/RARA、PRKAR1A/RARA、FIP1L1/RARA、BCOR/RARA、OBFC2A/RARA、TBLR1/RARA、GTF2I/RARA、IRF2BP2/RARA、FNDC3B/RARA、STAT3/RARA、NUP98/RARG、PML/RARG、CPSF6/RARG、RARG/CPSF6、NPM1/RARG/NPM1、TBL1XR1/RARB等[2]。 其中与本病例相同的TBL1XR1/RARB融合基因于2018年由OSUMI等[3]首次提出。TBL1XR1(转导β系1β-连锁受体1)位于3q26,编码WD-40蛋白,具有LiSH结构域。该基因的转录影响了其产物与一些组蛋白、核受体抑制因子(nuclear receptor corepressor,N-COR)和维甲酸甲状腺受体抑制因子(silencing mediator of retinoid and thyroid hormone receptors,SMRT)相互作用,降低了它们的抑制功能[4]。维甲酸受体(retinoic and acidreceptors,RAR)分为2个亚组(RAR-RXR),每个亚组又分3个亚型:RARA、RARB、RARG和RXRA、RXRB、RXRG。RARB位于3p24,具有类似于RARA的功能。RARB与RXR形成异源二聚体,与维甲酸反应元件(retinoic acid response elements,RAREs)结合,并在静息细胞中招募辅抑制因子和组蛋白去乙酰化酶靶向基因。RAREs/RXR异源二聚体被维甲酸的生理浓度激活,在胚胎形态发生、细胞生长和发育过程中介导细胞信号传导分化[3]。TBL1XR1/RARB所产生致癌蛋白的作用与PML/RARA相似,并降低了维甲酸途径的转录活性。
TBL1XR1/RARB阳性的APL通常与预后不良和对ATRA耐药性相关[3],同时表现出对ATRA剂量及时间上的依赖[3]。临床上,不典型APL大多表现为ATRA耐药或部分反应,但在实验室中,人工模拟的X::RARG、X::RARA融合基因均对ATRA反应敏感。有新的研究[5]提出,不典型APL患者中以三段式融合基因形式存在,即X::RAR::X/Y,RAR::X/Y部分导致RAR蛋白的配体结合结构域截短,这在分子机制上解释了这部分患者ATRA治疗效果不佳。目前能检索到TBL1XR1/RARB阳性的APL共10例[3,6-10],所有病例都显示出对ATRA有部分反应,但结局不完全一致,有2例出现复发[6-7],其中1例出现2次复发[7],4例完全缓解[7-10]。本病例也对维甲酸有部分反应,目前停药半年余保持完全缓解状态。
图1 初诊时骨髓涂片 (瑞氏-吉姆萨染色,×1 000)
(瑞氏-吉姆萨染色,×1 000)
目前变异型APL的治疗没有统一方案,多数按照AML方案化疗(含有蒽环类药物+阿糖胞苷)同时联合ATRA及砷剂,预后结果不尽相同,故还需更多的临床及科研工作者继续探索。
参考文献略。
来源:王瑶,黄珍,黄婷婷,等.TBL1XR1/RARB融合基因阳性急性早幼粒细胞白血病1例[J].温州医科大学学报,2025,55(8):670-672.
