
羊水栓塞并心内血栓形成抢救成功2例
作者:黄水慧,唐雅兵 ,湖南省妇幼保健院产科
,湖南省妇幼保健院产科
1 病例报告
病例1,29岁,因停经31+1周,外院超声检查发现胎盘占位1+月,于2019年2月22日就诊于湖南省妇幼保健院。月经规律,末次月经2018年7月23日,预产期2019年4月30日。停经30+d测尿妊娠试验 酶免法阳性,2018年9月13日B超检查示:宫内早孕,胚芽长13 mm。孕期外院定期产检,无妊娠期高血压
酶免法阳性,2018年9月13日B超检查示:宫内早孕,胚芽长13 mm。孕期外院定期产检,无妊娠期高血压 、糖尿病
、糖尿病 等。2019年1月12日外院行B超检查示:妊娠24周,胎盘实质内混合性占位,考虑胎盘绒毛膜血管瘤
等。2019年1月12日外院行B超检查示:妊娠24周,胎盘实质内混合性占位,考虑胎盘绒毛膜血管瘤 。患者无腹痛腹胀、阴道流血等不适,嘱定期B超监测。1月31日复查B超检查示:宫内中孕,胎盘上缘胎儿面混合型占位(118 mm×118 mm)。2月22日就诊于本院门诊,四维超声检查示:宫内妊娠30+1周,胎儿大脑中动脉最大血流速度(PSV)63.7 cm/s,PSV>1.5 MoM。胎儿心胸比增大(横径比约0.67、面积比约0.50、周长比约0.71),肝脏、脾脏增大,羊水指数(AFI)29.7 cm;胎盘子面(脐带与胎盘连接处右侧)探及14.1 cm×10.3 cm×13.7 cm大小占位,疑绒毛膜血管瘤部分出血坏死。G1P0,既往史、个人史、家族史无特殊。
。患者无腹痛腹胀、阴道流血等不适,嘱定期B超监测。1月31日复查B超检查示:宫内中孕,胎盘上缘胎儿面混合型占位(118 mm×118 mm)。2月22日就诊于本院门诊,四维超声检查示:宫内妊娠30+1周,胎儿大脑中动脉最大血流速度(PSV)63.7 cm/s,PSV>1.5 MoM。胎儿心胸比增大(横径比约0.67、面积比约0.50、周长比约0.71),肝脏、脾脏增大,羊水指数(AFI)29.7 cm;胎盘子面(脐带与胎盘连接处右侧)探及14.1 cm×10.3 cm×13.7 cm大小占位,疑绒毛膜血管瘤部分出血坏死。G1P0,既往史、个人史、家族史无特殊。
入院查体:生命体征平稳,心肺未见异常。专科情况:腹隆,宫高38 cm,腹围110 cm,先露头,左枕后位(LOP),半入盆,未扪及宫缩,胎心140次/min。入院诊断:①胎盘绒毛膜血管瘤;②胎儿重度贫血 ;③胎儿心力衰竭
;③胎儿心力衰竭 ?④羊水过多
?④羊水过多 ;⑤G1P0,宫内妊娠,31+1周LOP,单活胎。
;⑤G1P0,宫内妊娠,31+1周LOP,单活胎。
入院后予地塞米松 促胎肺成熟1疗程,硫酸镁
促胎肺成熟1疗程,硫酸镁 脑保护,监测胎心胎动
脑保护,监测胎心胎动 。2月25日复查B超示:妊娠31+4周,左枕前位(LOA),胎儿腹围偏大,胎盘子面占位较前无变化。肝脏、脾脏增大同前,心胸比例大(横径比约0.67,面积比约0.48,周长比约0.68),全心大。PSV增高至65.3 cm/s,PSV>1.5 MOM。行多学科会诊,考虑胎盘绒毛膜血管瘤(部分坏死)、胎儿重度贫血、胎儿心力衰竭,选择当日于蛛网膜下腔阻滞麻醉下行剖宫产术。手术于19:16开始,19:21胎儿娩出,婴儿面色苍白,外观无畸形,新生儿Apgar评分1 min、5 min、10 min为8分、10分、10分。羊水约3000 ml,胎儿娩出后宫腔少量活动性出血。19:26胎盘无剥离征象,行人工剥离胎盘,剥离过程中患者突然呛咳、躁动不安、迅速出现皮肤紫绀、意识丧失伴四肢抽搐,疑似羊水栓塞
。2月25日复查B超示:妊娠31+4周,左枕前位(LOA),胎儿腹围偏大,胎盘子面占位较前无变化。肝脏、脾脏增大同前,心胸比例大(横径比约0.67,面积比约0.48,周长比约0.68),全心大。PSV增高至65.3 cm/s,PSV>1.5 MOM。行多学科会诊,考虑胎盘绒毛膜血管瘤(部分坏死)、胎儿重度贫血、胎儿心力衰竭,选择当日于蛛网膜下腔阻滞麻醉下行剖宫产术。手术于19:16开始,19:21胎儿娩出,婴儿面色苍白,外观无畸形,新生儿Apgar评分1 min、5 min、10 min为8分、10分、10分。羊水约3000 ml,胎儿娩出后宫腔少量活动性出血。19:26胎盘无剥离征象,行人工剥离胎盘,剥离过程中患者突然呛咳、躁动不安、迅速出现皮肤紫绀、意识丧失伴四肢抽搐,疑似羊水栓塞 (AFE),立即呼救并启动多学科诊疗团队(MTD)。患者心率进行性下降,静脉推注阿托品
(AFE),立即呼救并启动多学科诊疗团队(MTD)。患者心率进行性下降,静脉推注阿托品 0.5 mg,心率仍持续下降,最低30次/min,血氧饱和度(SO2)未测出,触摸颈动脉无搏动,疑似心脏骤停
0.5 mg,心率仍持续下降,最低30次/min,血氧饱和度(SO2)未测出,触摸颈动脉无搏动,疑似心脏骤停 、电机械分离。19:27立即胸外心脏按压,面罩加压给氧,同时静脉滴注肾上腺素1 mg、阿托品0.5 mg、地塞米松20 mg,两组心肺复苏术循环后出现自主心率150次/min,血压(BP)73/40 mm Hg。19:35罂粟碱
、电机械分离。19:27立即胸外心脏按压,面罩加压给氧,同时静脉滴注肾上腺素1 mg、阿托品0.5 mg、地塞米松20 mg,两组心肺复苏术循环后出现自主心率150次/min,血压(BP)73/40 mm Hg。19:35罂粟碱 缓慢静脉推注(30 mg)+持续静脉滴注(60 mg)。19:50气管插管正压给氧,改全身麻醉。19:51去甲肾上腺素
缓慢静脉推注(30 mg)+持续静脉滴注(60 mg)。19:50气管插管正压给氧,改全身麻醉。19:51去甲肾上腺素 泵入维持血压,急查血气分析:酸碱度(pH)7.12,血氧分压(PO2)59 mm Hg,血二氧化碳分压(PCO2)52 mm Hg,乳酸(LAC)8.1 mmol/L,剩余碱指标(BE)-13.3 mmol/L。20:01凝血常规
泵入维持血压,急查血气分析:酸碱度(pH)7.12,血氧分压(PO2)59 mm Hg,血二氧化碳分压(PCO2)52 mm Hg,乳酸(LAC)8.1 mmol/L,剩余碱指标(BE)-13.3 mmol/L。20:01凝血常规 检查示:纤维蛋白原(Fib)0.66 g/L,凝血酶原时间(PT)19.9 s,凝血酶原激活时间(APTT)55.6 s;弥漫性血管内凝血(DIC)全套:D-二聚体
检查示:纤维蛋白原(Fib)0.66 g/L,凝血酶原时间(PT)19.9 s,凝血酶原激活时间(APTT)55.6 s;弥漫性血管内凝血(DIC)全套:D-二聚体 9.5 mg/L;血常规:血红蛋白
9.5 mg/L;血常规:血红蛋白 (Hb)80.00 g/L,血小板计数(PLT)43.00×109/L;肝功能:白蛋白23.50 g/L,肾功能、电解质、B型脑利钠肽(BNP)无异常。自主心率恢复后完整剥离胎盘胎膜,予可吸收线连续缝合切口子宫肌层,术中子宫质软,收缩差,予药物促宫缩治疗后子宫收缩仍差,行改良子宫背带缝合术,子宫切口及腹壁切口有渗血,出血不凝,子宫收缩差、质软,子宫后壁行多个U字缝合,0.9%氯化钠
(Hb)80.00 g/L,血小板计数(PLT)43.00×109/L;肝功能:白蛋白23.50 g/L,肾功能、电解质、B型脑利钠肽(BNP)无异常。自主心率恢复后完整剥离胎盘胎膜,予可吸收线连续缝合切口子宫肌层,术中子宫质软,收缩差,予药物促宫缩治疗后子宫收缩仍差,行改良子宫背带缝合术,子宫切口及腹壁切口有渗血,出血不凝,子宫收缩差、质软,子宫后壁行多个U字缝合,0.9%氯化钠 液清洗子宫,仍渗血,行双侧子宫动脉上行支结扎,观察子宫为紫蓝色,针眼及浆膜下渗血,不凝,阴道少量活动性流血。20:04氢化可的松
液清洗子宫,仍渗血,行双侧子宫动脉上行支结扎,观察子宫为紫蓝色,针眼及浆膜下渗血,不凝,阴道少量活动性流血。20:04氢化可的松 100mg静脉滴注,凝血酶原复合物800 U泵注。20:05 BP126/80 mm Hg,心率127次/min,SO2100%,积极联系输血
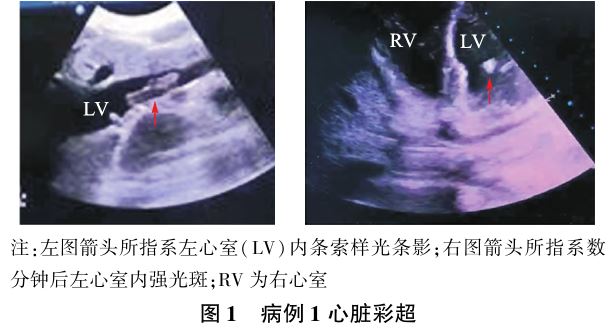
100mg静脉滴注,凝血酶原复合物800 U泵注。20:05 BP126/80 mm Hg,心率127次/min,SO2100%,积极联系输血 科备血。20:12心脏彩超检查示:右心增大,肺动脉压45 mm Hg,左室射血分数48%;左心室可见条索样光影,随心搏摆动,光条影变小,约2~3 min后消失,仅留左心室内强光斑,见图1。考虑射血分数下降,予米力农
科备血。20:12心脏彩超检查示:右心增大,肺动脉压45 mm Hg,左室射血分数48%;左心室可见条索样光影,随心搏摆动,光条影变小,约2~3 min后消失,仅留左心室内强光斑,见图1。考虑射血分数下降,予米力农 5 ml静脉推注(5~10 min完成)后,以1.2~3 mg/h静脉泵入5 ml强心治疗。结合临床、血气分析及生化结果,考虑AFE并发DIC,已进入DIC纤溶亢进期,病情凶险,经征得家属同意后于20:30行子宫切除术,术中无尿。20:40 20%甘露醇
5 ml静脉推注(5~10 min完成)后,以1.2~3 mg/h静脉泵入5 ml强心治疗。结合临床、血气分析及生化结果,考虑AFE并发DIC,已进入DIC纤溶亢进期,病情凶险,经征得家属同意后于20:30行子宫切除术,术中无尿。20:40 20%甘露醇 125 ml静脉滴注,考虑酸中毒,20:585%碳酸氢钠
125 ml静脉滴注,考虑酸中毒,20:585%碳酸氢钠 125 ml静脉滴注,仍无尿,21:40呋塞米
125 ml静脉滴注,仍无尿,21:40呋塞米 40 mg静脉推注后导出尿液200 ml,手术于23:00结束。术中累计失血3200 ml,共输液6360 ml(新鲜冰冻血浆1250 ml,冷沉淀25 U,红细胞9 U),尿量
40 mg静脉推注后导出尿液200 ml,手术于23:00结束。术中累计失血3200 ml,共输液6360 ml(新鲜冰冻血浆1250 ml,冷沉淀25 U,红细胞9 U),尿量 1186 ml。术后转重症监护室(ICU)加强监测,予对症支持及维护脏器功能治疗,术后24 h改每12 h皮下注射低分子肝素
1186 ml。术后转重症监护室(ICU)加强监测,予对症支持及维护脏器功能治疗,术后24 h改每12 h皮下注射低分子肝素 5000 U抗凝。复查肺部CT血管造影
5000 U抗凝。复查肺部CT血管造影 及双下肢血管彩超
及双下肢血管彩超 无异常,经抗凝、抗感染等治疗后,术后12 d出院。出院诊断:①AFE;②心脏骤停;③肺动脉高压
无异常,经抗凝、抗感染等治疗后,术后12 d出院。出院诊断:①AFE;②心脏骤停;③肺动脉高压 ;④休克
;④休克 ;⑤酸中毒;⑥DIC;⑦产后出血
;⑤酸中毒;⑥DIC;⑦产后出血 ;⑧中度贫血;⑥胎盘绒毛膜血管瘤并出血;⑩胎儿重度贫血; I1胎儿心力衰竭; I2G1P1,宫内妊娠31+4周LOP单活婴; I3羊水过多; I4早产
;⑧中度贫血;⑥胎盘绒毛膜血管瘤并出血;⑩胎儿重度贫血; I1胎儿心力衰竭; I2G1P1,宫内妊娠31+4周LOP单活婴; I3羊水过多; I4早产 ; I5子宫全切术后。出院1周电话随访及产后1月门诊复查均未诉不适。妇科查体示阴道残端愈合良好,妇科超声检查
; I5子宫全切术后。出院1周电话随访及产后1月门诊复查均未诉不适。妇科查体示阴道残端愈合良好,妇科超声检查 示符合术后改变,实验检查(血常规、肝肾功能、凝血功能、D-二聚体)及阴道微生态检测均未见异常。
示符合术后改变,实验检查(血常规、肝肾功能、凝血功能、D-二聚体)及阴道微生态检测均未见异常。
病例2,35岁,因停经38+2周,不规则下腹胀4 h,于2024年7月8日就诊于湖南省妇幼保健院。月经规律,末次月经2023年10月13日,预产期2024年7月20日。停经30+d测尿妊娠试验酶免法阳性,2023年12月3日B超检查示宫内妊娠6+周,见长约4 mm的胚芽组织及卵黄囊声像,见原始心管搏动。孕期本院定期产检,无不适。4 h前出现不规则下腹胀,无阴道流血及流液,于本院急诊科就诊,以足月妊娠,先兆临产收入院。G3P1,2022年足月顺产1胎,2023年行早孕人流,既往史、个人史、家族史无特殊。
入院查体:生命体征平稳,心肺未见异常。专科情况:腹部膨隆,宫高31 cm,腹围105 cm,胎儿预估体质量约3500 g,头先露,胎方位 LOA,已入盆,扪及不规则宫缩,胎心136次/min。阴道指检:子宫颈管消退80%,居后,质地中,宫口未开,先露头,S-2,未见羊水流出,未扪及条索状物和异常搏动。入院诊断:G3P1,宫内妊娠,38+2周LOA单活胎。
LOA,已入盆,扪及不规则宫缩,胎心136次/min。阴道指检:子宫颈管消退80%,居后,质地中,宫口未开,先露头,S-2,未见羊水流出,未扪及条索状物和异常搏动。入院诊断:G3P1,宫内妊娠,38+2周LOA单活胎。
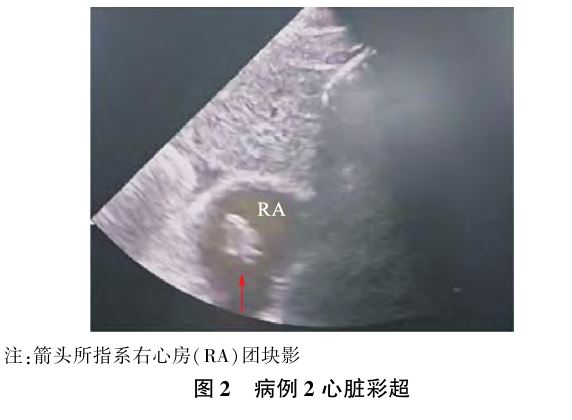
入院后完善相关检查未见异常,于病房待产,监测胎心胎动,观察腹痛及阴道流血流液等情况,7月9日23:24胎膜自破,破膜后孕妇感烦躁、头晕、轻微手抖、大汗淋漓,对答正常,查嘴唇及甲床无发绀 ,腹部膨隆、质软,床旁扪及不规则宫缩,胎心120次/min,血糖5.4 mmol/L,立即予高流量吸氧、心电监护、开通静脉通道。23:25 SO296%,心率64次/min,R 20次/min,孕妇烦躁不配合,血压未测出,后逐渐出现嘴唇发绀。23:27诉胸闷、头晕,症状较前加重(SO290%)。23:30SO288%,心率65次/min,23:34 BP 131/111 mm Hg,胎心率86~91次/min。考虑AFE,立即启动AFE紧急预案。23:34地塞米松磷酸钠注射液10 mg静脉推注抗过敏,行紧急剖宫产,启动全院大会诊。23:40入手术室后予持续高流量吸氧,BP 85/60 mm Hg,心率110次/min,R 18次/min,吸入纯氧情况下SO286%~88%,查血气分析正常,血常规检查示:PLT69.0×109;凝血常规检查示:Fib 1.9 g/L,PT 45.7 s,APTT55.6 s。23:53胎儿娩出,新生儿Apgar评分1 min、5 min、10 min为5分、7分、8分。23:54床旁心脏彩超检查示:右心房及右心室增大,右心房见团块状光影,约5 min后消失,肺动脉压39 mm Hg,见图2。术中子宫切口及腹壁切口有渗血,出血不凝,子宫收缩欠佳,急查血常规:Hb 98.00 g/L,PLT 86.00×109;凝血功能:Fib 0.93 g/L,PT 67.2 s,APTT 60.0 s,肝功能:白蛋白24.70g/L,肾功能、电解质、BNP正常。考虑DIC,予Fib、人凝血酶原复合物
,腹部膨隆、质软,床旁扪及不规则宫缩,胎心120次/min,血糖5.4 mmol/L,立即予高流量吸氧、心电监护、开通静脉通道。23:25 SO296%,心率64次/min,R 20次/min,孕妇烦躁不配合,血压未测出,后逐渐出现嘴唇发绀。23:27诉胸闷、头晕,症状较前加重(SO290%)。23:30SO288%,心率65次/min,23:34 BP 131/111 mm Hg,胎心率86~91次/min。考虑AFE,立即启动AFE紧急预案。23:34地塞米松磷酸钠注射液10 mg静脉推注抗过敏,行紧急剖宫产,启动全院大会诊。23:40入手术室后予持续高流量吸氧,BP 85/60 mm Hg,心率110次/min,R 18次/min,吸入纯氧情况下SO286%~88%,查血气分析正常,血常规检查示:PLT69.0×109;凝血常规检查示:Fib 1.9 g/L,PT 45.7 s,APTT55.6 s。23:53胎儿娩出,新生儿Apgar评分1 min、5 min、10 min为5分、7分、8分。23:54床旁心脏彩超检查示:右心房及右心室增大,右心房见团块状光影,约5 min后消失,肺动脉压39 mm Hg,见图2。术中子宫切口及腹壁切口有渗血,出血不凝,子宫收缩欠佳,急查血常规:Hb 98.00 g/L,PLT 86.00×109;凝血功能:Fib 0.93 g/L,PT 67.2 s,APTT 60.0 s,肝功能:白蛋白24.70g/L,肾功能、电解质、BNP正常。考虑DIC,予Fib、人凝血酶原复合物 、新鲜冰冻血浆、冷沉淀静脉滴注,纠正凝血功能,浓缩红细胞静脉滴注纠正贫血,行子宫颈提拉缝合及双侧子宫动脉上行支结扎,止血后关腹。术中失血1500 ml,输液3319.5 ml(浓缩红细胞3.5 U,新鲜冰冻血浆450 ml,冷沉淀19.5 U,凝血酶原复合物1800 U,Fib 4.5 g)。术后行肺部CT检查
、新鲜冰冻血浆、冷沉淀静脉滴注,纠正凝血功能,浓缩红细胞静脉滴注纠正贫血,行子宫颈提拉缝合及双侧子宫动脉上行支结扎,止血后关腹。术中失血1500 ml,输液3319.5 ml(浓缩红细胞3.5 U,新鲜冰冻血浆450 ml,冷沉淀19.5 U,凝血酶原复合物1800 U,Fib 4.5 g)。术后行肺部CT检查 未见异常,予以抗感染、纠正凝血功能等对症处理后于术后3 d出院。出院诊断:①AFE;②DIC;③产后出血;④胎儿窘迫;⑤胎膜早破
未见异常,予以抗感染、纠正凝血功能等对症处理后于术后3 d出院。出院诊断:①AFE;②DIC;③产后出血;④胎儿窘迫;⑤胎膜早破 ;⑥G3P2,宫内妊娠,38+3周LOA单活婴;⑦中度贫血。出院1周电话随访及产后42 d门诊复查显示:患者无不适主诉,妇科检查
;⑥G3P2,宫内妊娠,38+3周LOA单活婴;⑦中度贫血。出院1周电话随访及产后42 d门诊复查显示:患者无不适主诉,妇科检查 未见异常。实验室检查(血常规、凝血功能及阴道微生态)均正常,超声检查提示子宫正常,子宫及腹壁切口愈合佳。
未见异常。实验室检查(血常规、凝血功能及阴道微生态)均正常,超声检查提示子宫正常,子宫及腹壁切口愈合佳。
2 讨 论
AFE是产科特有的危急综合征,由羊水进入母体循环引发呼吸循环衰竭、凝血功能障碍等多器官功能异常,可发生于分娩 前、分娩时、分娩后。其全球发病率为1/80000~1/8000,实际发病率因诊断差异存在不确定性[1,2]。Busardo等[3]Meta分析结果表明,AFE占孕产妇死因的12.8%±6.5%,其病死率为24.8%±10.96%。
前、分娩时、分娩后。其全球发病率为1/80000~1/8000,实际发病率因诊断差异存在不确定性[1,2]。Busardo等[3]Meta分析结果表明,AFE占孕产妇死因的12.8%±6.5%,其病死率为24.8%±10.96%。
2.1 AFE的诊断 AFE的诊断主要基于临床表现和发病时间的快速综合评估,强调全面细致的排他性诊断[4]。根据《AFE临床诊断与处理专家共识(2018)》[5],符合以下标准即可确诊:①突发低血压或心脏骤停;②急性低氧血症伴呼吸困难 和(或)紫绀;③无法解释的凝血功能障碍(实验室证据或严重出血);④症状发生于围分娩期(多发生于胎盘娩出30 min内);⑤排除其他病因。本文2例病例均符合上述标准,确诊为AFE。
和(或)紫绀;③无法解释的凝血功能障碍(实验室证据或严重出血);④症状发生于围分娩期(多发生于胎盘娩出30 min内);⑤排除其他病因。本文2例病例均符合上述标准,确诊为AFE。
2.2 AFE患者的心脏彩超 AFE时羊水成分入母体循环引发肺血管痉挛 ,致肺动脉高压及右心后负荷骤增,进而发展为急性右心衰竭。右心功能恶化导致左心回血量减少,引发左心衰与休克。在AFE的临床评估中,心脏超声检查发挥着重要作用。它可快速识别肺动脉高压与右心功能障碍,为临床诊断提供客观依据,并可指导改善右心功能的抢救治疗,预防左心衰竭和休克的进一步恶化。美国母胎医学学会(SMFM)指南及中国共识均推荐AFE早期使用心脏超声。AFE典型超声表现包括右心室扩张伴室壁运动减退、右房增大及三尖瓣反流,肺动脉高压致室间隔左移形成"D型左室",引起左室阻塞及收缩功能障碍[6,7],部分可见右心或下腔静脉血栓[6]。Maack等[8]报道AFE患者复苏后经食道超声发现右心及下腔静脉团块状栓子形成,Barakat等[9]报道AFE经胸床旁心脏彩超见下腔静脉血栓。本院收治的2例AFE患者的超声检查也呈现了典型的右心扩大、肺动脉高压等改变,同时还发现了心内血栓形成,这些发现与国内外文献报道高度一致。而心脏超声作为无创检查手段,在AFE早期诊断、评估及治疗中具有重要临床价值。
,致肺动脉高压及右心后负荷骤增,进而发展为急性右心衰竭。右心功能恶化导致左心回血量减少,引发左心衰与休克。在AFE的临床评估中,心脏超声检查发挥着重要作用。它可快速识别肺动脉高压与右心功能障碍,为临床诊断提供客观依据,并可指导改善右心功能的抢救治疗,预防左心衰竭和休克的进一步恶化。美国母胎医学学会(SMFM)指南及中国共识均推荐AFE早期使用心脏超声。AFE典型超声表现包括右心室扩张伴室壁运动减退、右房增大及三尖瓣反流,肺动脉高压致室间隔左移形成"D型左室",引起左室阻塞及收缩功能障碍[6,7],部分可见右心或下腔静脉血栓[6]。Maack等[8]报道AFE患者复苏后经食道超声发现右心及下腔静脉团块状栓子形成,Barakat等[9]报道AFE经胸床旁心脏彩超见下腔静脉血栓。本院收治的2例AFE患者的超声检查也呈现了典型的右心扩大、肺动脉高压等改变,同时还发现了心内血栓形成,这些发现与国内外文献报道高度一致。而心脏超声作为无创检查手段,在AFE早期诊断、评估及治疗中具有重要临床价值。
2.3 AFE凝血功能改变 AFE患者常以急性心衰为首发症状,随后凝血联级反应和纤溶系统激活导致DIC[10,11],约80%的患者可观察到凝血和纤溶亢进的病理激活叠加[12]。羊水中的组织因子通过结合母体Ⅶ因子强化外源性凝血途径[13],同时激活血小板聚集和补体系统,引发凝血因子消耗、低纤维蛋白原血症及血小板减少[11]。而羊水诱导形成的血栓质地脆弱且易溶解[14]。本院2例AFE心脏超声见心腔内活动性团块影,病例1缺乏右向左分流通道,左心系统团块短时溶解符合血栓特征,病例2右心房团块数分钟消失且无肺栓塞 证据,提示微血栓形成-溶解的动态过程。该凝血紊乱表现为早期高凝与后期纤溶亢进叠加,致纤溶期血栓突发溶解,尽管纤溶亢进可能溶解微血栓,但仍有栓子脱落引发重要脏器栓塞的潜在危险。因此,临床团队应建立包含抗凝、溶栓、急诊取栓及体外膜肺氧合(ECMO)支持的多维度应急预案,以应对可能发生的各种危急情况。
证据,提示微血栓形成-溶解的动态过程。该凝血紊乱表现为早期高凝与后期纤溶亢进叠加,致纤溶期血栓突发溶解,尽管纤溶亢进可能溶解微血栓,但仍有栓子脱落引发重要脏器栓塞的潜在危险。因此,临床团队应建立包含抗凝、溶栓、急诊取栓及体外膜肺氧合(ECMO)支持的多维度应急预案,以应对可能发生的各种危急情况。
2.4 AFE的治疗 一旦疑似AFE应立即启动MTD(产科、麻醉科、重症医学科、心血管科等),快速实施基础与高级生命支持措施,包括抗过敏治疗、呼吸循环支持、容量复苏及凝血管理[15]。核心救治策略涵盖:高质量心肺复苏;呼吸支持及抗过敏治疗;循环调控;精准凝血管理与全面监测[7]。
2.4.1 高质量心肺复苏 AFE合并心脏停搏时,救治须及时规范,立即启动高质量心肺复苏及高级生命支持,孕妇需同步左移子宫15°~30°以缓解下腔静脉压迫,改善循环。若持续复苏4 min未恢复自主循环且孕周≥23周,应启动围死亡期剖宫产。分娩方式依据子宫颈条件:宫口全开可行器械助产,子宫颈未成熟者需在心脏骤停5 min内完成剖宫产,既解除子宫压迫又争取胎儿存活机会。
2.4.2 呼吸支持与过敏控制 保持气道通畅,实施阶梯呼吸支持(面罩吸氧→插管→机械通气 ),维持氧饱和度>90%。使用前列环素、一氧化氮
),维持氧饱和度>90%。使用前列环素、一氧化氮 、西地那非
、西地那非 、罂粟碱等肺血管扩张剂缓解肺动脉高压,改善通气/血流比值,预防多器官缺氧性损伤。
、罂粟碱等肺血管扩张剂缓解肺动脉高压,改善通气/血流比值,预防多器官缺氧性损伤。
同时予糖皮质激素 抗过敏。
抗过敏。
2.4.3 循环调控 对于血流动力学不稳定伴低血压患者,可在中心静脉压监测下实施限制性晶体液复苏(预防心衰及肺水肿 ),联合去甲肾上腺素和血管加压素维持血压,优先选用多巴酚丁胺
),联合去甲肾上腺素和血管加压素维持血压,优先选用多巴酚丁胺 或磷酸二酯酶抑制剂(兼具强心与扩张肺动脉作用)[5]。初始复苏目标:收缩压
或磷酸二酯酶抑制剂(兼具强心与扩张肺动脉作用)[5]。初始复苏目标:收缩压 >90 mm Hg、PaO2>60 mm Hg、尿量>0.5 ml/kg/h。顽固性休克可考虑ECMO、心肺转流术或主动脉内球囊反搏等有创支持[5]。
>90 mm Hg、PaO2>60 mm Hg、尿量>0.5 ml/kg/h。顽固性休克可考虑ECMO、心肺转流术或主动脉内球囊反搏等有创支持[5]。
2.4.4 精准凝血管理 AFE继发产后出血及DIC时,凝血功能障碍具有持续性和进展性特征,建议采取以下序贯管理:①立即启动凝血功能评估(凝血常规、D-二聚体、血栓弹力图 等),开展成分输血;②通过动态实验室监测(每1~2 h)进行凝血指标趋势分析,实施目标导向治疗,包括补充凝血因子(Fib、凝血酶原复合物)及氨甲环酸
等),开展成分输血;②通过动态实验室监测(每1~2 h)进行凝血指标趋势分析,实施目标导向治疗,包括补充凝血因子(Fib、凝血酶原复合物)及氨甲环酸 等抗纤溶治疗;③活动性大出血时,推荐采用1∶1∶1比例输注红细胞悬液、新鲜冰冻血浆及血小板,维持Fib>2.0 g/L、PLT>50×109/L的关键阈值[13]。
等抗纤溶治疗;③活动性大出血时,推荐采用1∶1∶1比例输注红细胞悬液、新鲜冰冻血浆及血小板,维持Fib>2.0 g/L、PLT>50×109/L的关键阈值[13]。
2.4.5 全面监测 需立即实施标准监测(包括心电图 、脉搏
、脉搏 血氧及无创血压监测),并建立有创动脉压联合中心静脉压的多模态监测系统。通过动态监测生命体征、血气分析及血流动力学参数变化,及时调整治疗方案。
血氧及无创血压监测),并建立有创动脉压联合中心静脉压的多模态监测系统。通过动态监测生命体征、血气分析及血流动力学参数变化,及时调整治疗方案。
总之,AFE有低发病率、高病死率特点,其凝血异常机制及关键时间窗尚未明确,早期可能出现下腔静脉及心腔血栓,条件允许时尽早行床旁超声评估心肺循环。救治需多学科协作,加强多器官功能维护。
参考文献略。
来源:实用妇产科杂志2025年8月第41卷第8期
