
前列腺导管腺癌1例
前列腺导管腺癌(ductal adenoearcinoma ofthe prostate。DAP)是前列腺癌 形态学L独特的亚型。单纯导管腺癌约占全部前列腺恶性肿瘤不足1%,而经常与典型腺泡腺癌混合存在则约占5%,。目前对DAP的来源、诊断及其临床价值仍存在争论。我们最近收治l例DAP患者,现报告如下.并结合文献复习就其诊断及治疗进行讨论。
形态学L独特的亚型。单纯导管腺癌约占全部前列腺恶性肿瘤不足1%,而经常与典型腺泡腺癌混合存在则约占5%,。目前对DAP的来源、诊断及其临床价值仍存在争论。我们最近收治l例DAP患者,现报告如下.并结合文献复习就其诊断及治疗进行讨论。
1、病例报告
患者,73岁。因“反复无痛性初始血尿 2年”为主诉人院。2年前发现血尿拟按“前列腺增生”治疗,症状反复。人院前4个月于外院行膀胱镜
2年”为主诉人院。2年前发现血尿拟按“前列腺增生”治疗,症状反复。人院前4个月于外院行膀胱镜 检查发现尿道肿物,经尿道电切后病理检查
检查发现尿道肿物,经尿道电切后病理检查 示尿道低分化腺癌伴乳头状管状结构。术后行右髂内动脉灌注化疗(吉西他滨
示尿道低分化腺癌伴乳头状管状结构。术后行右髂内动脉灌注化疗(吉西他滨 +顺铂
+顺铂 )。入院前2个月复查提示尿道肿物复发,遂转诊第二军医大学长海医院。直肠指诊发现右侧叶靠近尖部有一直径0.5 cm结节,质硬。界限清。膀胱镜检查见尿道括约肌和精阜之间有一1.5 cm×1.5 cm乳头状新生物,基底较宽。CT示前列腺右侧叶有低密度影,直径约1.5 cm,增强后见边缘环形强化,精囊大小形态正常,盆腔未见明显增大淋巴结影。前列腺波谱成像分析示前列腺大部分代谢物含量呈高枸橼酸低胆碱状态,前列腺尖部圆形T2W异常信号区波谱信号混杂。波形畸变,各代谢物峰难以区分。血PSA为0.897 ng/ml。行经尿道肿物电切术。术中见肿瘤向前列腺深部延伸。无法完全切除,止血后留置尿管。术后标本病理检查,送检“尿道肿物”见肿瘤组织呈乳头及腺样排列,肿瘤细胞呈卵圆及短梭形,胞质稀少,核大异型,并见少量前列腺组织。结合免疫组织化学检测考虑为尿道乳头状腺癌,不排除DAP的可能。患者进一步行前列腺根治性切除术。
)。入院前2个月复查提示尿道肿物复发,遂转诊第二军医大学长海医院。直肠指诊发现右侧叶靠近尖部有一直径0.5 cm结节,质硬。界限清。膀胱镜检查见尿道括约肌和精阜之间有一1.5 cm×1.5 cm乳头状新生物,基底较宽。CT示前列腺右侧叶有低密度影,直径约1.5 cm,增强后见边缘环形强化,精囊大小形态正常,盆腔未见明显增大淋巴结影。前列腺波谱成像分析示前列腺大部分代谢物含量呈高枸橼酸低胆碱状态,前列腺尖部圆形T2W异常信号区波谱信号混杂。波形畸变,各代谢物峰难以区分。血PSA为0.897 ng/ml。行经尿道肿物电切术。术中见肿瘤向前列腺深部延伸。无法完全切除,止血后留置尿管。术后标本病理检查,送检“尿道肿物”见肿瘤组织呈乳头及腺样排列,肿瘤细胞呈卵圆及短梭形,胞质稀少,核大异型,并见少量前列腺组织。结合免疫组织化学检测考虑为尿道乳头状腺癌,不排除DAP的可能。患者进一步行前列腺根治性切除术。
病理检查见前列腺尿道部肿瘤细胞呈柱状、高柱状,核深染。异型显著,排列成较大的腺管状、分支乳头状、筛状、腔内乳头状,部分腔内可见前列腺石。呈浸润性生长;间质纤维组织增生反应明显。瘤旁前列腺增生.部分呈高级别上皮内瘤改变。双侧精囊腺以及左、右闭孔淋巴结未见肿瘤转移或浸润。切缘未见癌。诊断为DAP,部分前列腺上皮内瘤(图1)。
免疫组织化学检测:PSA(一),PSAP(一),P63(一),Ki一67(++),P504s(少灶+),CAM5.2(+),HCK(一)。
术后患者恢复良好。无其他辅助治疗,6周后拔除尿管自行排尿,无尿失禁。随访1年未见局部复发及远处转移,血PSA均小于0.003 ng/ml。
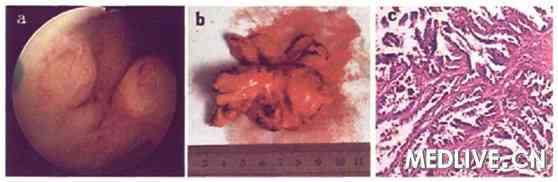
图1 a:经尿道肿物电切术中见肿瘤呈乳头状突入尿道;b:前列腺根治性切除标本可见右侧叶靠近尖部有一直径约2cm肿物;c:术后病理HE染色见肿瘤细胞呈分支乳头状、腺管状,类似尿道乳头状腺癌
2、讨论
自从1967年Me|icow最初描述了前列腺子宫内膜样腺癌以来,人们对DAP的认识逐渐在改变。DAP起病隐匿,发病年龄和腺泡腺癌相当,常以下尿路症状、血尿、血精等为首发症状。DAP主要发生于前列腺外周带和尿道周围,直肠指诊有时可以发现前列腺异常结节,而发生于尿道周围的DAP在膀胱镜下可见尿道乳头状肿物。临床上更多是在前列腺穿刺、经尿道电切标本或根治切除的前列腺中发现该病。穿刺、电切标本局限性及有时形态、结构不典型导致DAP误诊、漏诊率高。需与转移性前列腺腺癌、尿道癌、绒毛状腺瘤、前列腺尿道息肉、息肉样尿道炎、乳头状尿道炎、高级别前列腺上皮内瘤等相鉴别。本例开始即误诊为尿道腺癌。结合免疫组织化学是提高诊断的有效方法:大多数DAP的前列腺特异抗原(PSA)和前列腺特异酸性磷酸酶 (PSAP)染色呈强阳性;77%~100%DAPa一甲酰基辅酶A
(PSAP)染色呈强阳性;77%~100%DAPa一甲酰基辅酶A 消旋酶(AM—ACR)染色阳性,这对小标本且细胞异常不明显的DAP诊断很有价值;Ki-67在DAP(33%)的表达比腺癌(8%)高哺;此外,34pEl2、p63、AR、bcl一2和CDX2等都有助于DAP的鉴别诊断。随着对DAP的重视。其来源、诊治及预后也存在争议。
消旋酶(AM—ACR)染色阳性,这对小标本且细胞异常不明显的DAP诊断很有价值;Ki-67在DAP(33%)的表达比腺癌(8%)高哺;此外,34pEl2、p63、AR、bcl一2和CDX2等都有助于DAP的鉴别诊断。随着对DAP的重视。其来源、诊治及预后也存在争议。
2.1组织来源
最初认为DAP起源于男性胚胎期副中肾管阿残留前列腺椭圆囊,类似女性子宫内膜样腺癌,主要基于其形态结构类似,及椭圆囊位于精阜尖部,而DAP常发生在前列腺尿道周围。随后的研究对此提出异议:①胚胎学研究认为副中肾管上皮在胚胎进程中离开椭圆囊。而前列腺椭圆囊和精阜处的上皮来源于泌尿生殖窦;②从超微结构上看,椭圆囊上皮更接近前列腺上皮,而且椭圆囊上皮和大多数DAP对PSA、PSAP染色阳性;③部分DAP雄激素受体阳性,而雌激素 受体阴性。更有意义的是,临床上发现有些DAP对雄激素拮抗治疗有效;④Sanati等首次在分子水平验证DAP和腺癌高度同源,用基因表达差异分析(含约3 800个探针)前列腺腺癌和DAP(包括大块组织和激光微分离细胞群),仅10~30个基因表达有差别。然而,并非所有DAP的PSA、PSAP均阳性,如本例,这也给最初诊断带来难度。因此,有学者认为可能存在前列腺和副中肾管两种起源但目前大多数支持DAP来源于前列腺。
受体阴性。更有意义的是,临床上发现有些DAP对雄激素拮抗治疗有效;④Sanati等首次在分子水平验证DAP和腺癌高度同源,用基因表达差异分析(含约3 800个探针)前列腺腺癌和DAP(包括大块组织和激光微分离细胞群),仅10~30个基因表达有差别。然而,并非所有DAP的PSA、PSAP均阳性,如本例,这也给最初诊断带来难度。因此,有学者认为可能存在前列腺和副中肾管两种起源但目前大多数支持DAP来源于前列腺。
2.2前列腺癌独立亚型
单纯DAP少见,约占前列腺癌不到1%,而更多的是和典型腺泡腺癌混合出现。有学者认为DAP是腺泡腺癌浸润外周带导管所致。不是独特的哑型。然而,研究表明DAP的发生率比我们预计的多得多,而且是前列腺癌一种单独亚型:①与腺泡腺癌立方状上皮不同。DAP有着典型的细胞学形态和结构,高柱状假复层上皮,具有丰富的两染性胞质,细胞核比较大,有明显的核仁,常见到有丝分裂像。细胞叮以排列成乳头状、筛孔状、浸润型腺泡状及实体癌巢状,有时伴有粉刺状坏死,并且可同时存在几种不同结构混合。浸润型常伴有间质纤维化,这在腺癌中比较少见。②DAP发生于外周带和尿道周围区,这可能与大多标本来源于经直肠穿刺或经尿道电切有关。Samaratunga等研究r一组连续行前列腺根治性切除标本268例,34例(12.7%)含有DAP,比以往统计多(5%),所有DAP均位于外周带,46%同时发生于移行带,而腺泡腺癌较少发生于移行带。③DAP发生区域淋巴结和临近器官转移如阴茎、睾丸。远处通常转移到实性脏器如肺、肝、脑和骨。转移灶细胞形态、结构可以是类似原发病灶单纯导管腺癌,这也是单独哑型的有力证据。④虽然腺癌和DAP在基因表达上差异很小,在转录水平E有10~30个基因表达相差5~27倍。如催乳素受体(prolactin receptor)、CD24和类钙粘蛋白23(cadherin—like 23)等,这可能决定着两者不同哑型和生物学行为"1。⑤Tu等。进一步认为单纯DAP和混合型DAP是两个独市亚型,两者的生物学行为不一样。大多数单纯DAP(87%)Gleason评分为8~10,但术后生存时间比混合型长,因此,Gleason评分也不一定适用于DAP。
2.3生物学行为和治疗选择
与经典腺泡腺癌不同。DAP有独特的牛物学行为,有必要将I)AP单独从前列腺癌中鉴别出来。有些学者认为DAP恶性度低。进展缓慢,预后比腺癌好;现多数将DAP视为恶性度高的肿瘤,大多发现时已处于晚期阶段,5年存活率仅为15%~50%。穿刺诊断为DAP与腺癌相比,进展时间明显短;前列腺根治性切除诊断为DAP的5年进展率为50%,相当介于腺泡腺癌的Gleason 7(34%)和Gleason 8~9(65%)之间。Tu等研究了108例导管腺癌患者,单纯DAP中位生存时间(13.8年)比混合型(8.9年)长;然而。根治术后局部复发快(2.8年比4.9年),远处转移慢(3.9年比2.0年),因此认为单纯DAP是个进展缓慢,但局部容易复发的肿瘤,建议对I)AP行前列腺根治切除术,以提高疗效。混合型DAP更多见。Samara—tunga等曲。发现27例(73%)DAP有肿瘤突破前列腺包膜(pT3)。相比腺癌只有32.9%,而这与含DAP成分多少无关。并且logistics回归分析提示肿瘤中DAP出现是前列腺癌pT3预测的独立因素。肿瘤大小、单纯、混合型DAP与生存率关系不大。
DAP的治疗手术包括经尿道前列腺电切术、前列腺根治切除术、放疗、内分泌治疗等。目前认为DAP进展快,侵袭性强,局部复发率高,推荐首选前列腺根治性切除术。本例局部切除后2个月即出现局部复发,经行前列腺根治切除后。随访1年。PSA、盆腔CT、膀胱镜未发现复发迹象。DAP大多数为pT3,与其起病隐匿、临床发现较晚、穿刺标本局限不易鉴别等也有关系。一组DAP患者接受前列腺根治术,术后发现93%包膜浸润,47%切缘阳性,40%精囊浸润,27%盆腔淋巴结转移叫舶。建议新辅助治疗以降低其临床分期、术缘阳性率、减少局部复发为原则。既然DAP相当于Gleason7以上,术后是否需要常规辅助治疗,包括内分泌治疗、放疗、化疗等,放疗和内分泌治疗的确切疗效如何,PSA能否作为随访复发的指标。挽救性辅助治疗在DAP复发中的作用等方面仍有待临床大宗病例研究。
