
【罕见病例】慢性腹泻,消瘦,胸腺瘤一例
作者:中国医学科学院北京协和医院消化科 艾三喜 吴东 李景南 朱峰
病历摘要
患者男,60岁。因腹泻 2年、加重2周于2012年12月入院。患者于2年前起无诱因出现腹泻,排水样便5〜6次/d,每次约200~300ml,无未消化食物,与进食无关。无腹痛、发热
2年、加重2周于2012年12月入院。患者于2年前起无诱因出现腹泻,排水样便5〜6次/d,每次约200~300ml,无未消化食物,与进食无关。无腹痛、发热 、里急后重。外院查粪便常规及隐血试验均阴性,结肠镜示全结直肠未见明显异常。经洛哌丁胺
、里急后重。外院查粪便常规及隐血试验均阴性,结肠镜示全结直肠未见明显异常。经洛哌丁胺 、抗生素和补液治疗无效,腹泻进行性加重。1个月前腹泻次数增至10~20次/d(每日>3000mL),伴少尿及血压下降。患者进食无减少,但进行性消瘦
、抗生素和补液治疗无效,腹泻进行性加重。1个月前腹泻次数增至10~20次/d(每日>3000mL),伴少尿及血压下降。患者进食无减少,但进行性消瘦 ,2年内体质量下降35kg。5年前发现前纵隔占位(图1),外院手术切除后确诊为胸腺瘤
,2年内体质量下降35kg。5年前发现前纵隔占位(图1),外院手术切除后确诊为胸腺瘤 。4年前因上腹痛在当地医院行胃镜检查
。4年前因上腹痛在当地医院行胃镜检查 示胃角小溃疡,活组织病理检查
示胃角小溃疡,活组织病理检查 为非特异性慢性炎,采用抑酸治疗后腹痛好转。入院体格检查:体温36.5℃,脉搏
为非特异性慢性炎,采用抑酸治疗后腹痛好转。入院体格检查:体温36.5℃,脉搏 87次/min,呼吸16次/min,血压81/59 mmHg(1mmHg=0.133kPa)。患者身高175cm,体质量36kg。神志清楚,一般情况差,恶病质。浅表淋巴结未及肿大。心肺无殊。舟状腹,腹软,无压痛、反跳痛,肝脾肋下未及,肠鸣音
87次/min,呼吸16次/min,血压81/59 mmHg(1mmHg=0.133kPa)。患者身高175cm,体质量36kg。神志清楚,一般情况差,恶病质。浅表淋巴结未及肿大。心肺无殊。舟状腹,腹软,无压痛、反跳痛,肝脾肋下未及,肠鸣音 活跃。双下肢无水肿
活跃。双下肢无水肿
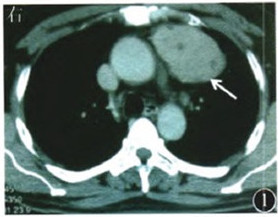
图1 计算机断层扫描示前纵隔占位(见箭头)
第一次临床讨论
本例患者为中老年男性,病程长达2年,属慢性腹泻。急性腹泻多为自限性病程,而慢性腹泻则需要细致鉴别以排除严重器质性疾病。从病理生理学机制来看,慢性腹泻可分为分泌性、渗透性、渗出性和动力性。本例患者排大量水样便,无未消化食物,且与进食因素无关,可排除渗透性及动力性腹泻;无发热、腹痛和里急后重,粪便中无白细胞,也不支持渗出性腹泻。故提示分泌性腹泻可能性较大。
分泌性腹泻病因较多,包括滥用泻剂、肠道感染(如抗生素相关性腹泻)、肿瘤(包括淋巴瘤、神经内分泌肿瘤、巨大绒毛状腺瘤等)、系统性结缔组织病、显微镜下结肠炎等。本例患者无滥用泻剂或长期应用抗生素病史,故医源性因素无证据。病程长达2年,无腹痛及里急后重等表现,故普通细菌感染可能性小。无发热,淋巴结和肝脾无肿大,故不支持淋巴瘤。至于神经内分泌肿瘤,患者既往仅有胃部小溃疡,对抑酸治疗反应良好,故促胃液素瘤可能性小。无阵发性心悸 、皮肤潮红等表现,故也不支持类癌。血管活性肠肽 (vasoactive intestinal peptide,VIP)瘤需进一步排除。患者近期病情加重,出现水电解质紊乱和严重消耗,在完善检查的同时应补足血容量并加强营养支持。
、皮肤潮红等表现,故也不支持类癌。血管活性肠肽 (vasoactive intestinal peptide,VIP)瘤需进一步排除。患者近期病情加重,出现水电解质紊乱和严重消耗,在完善检查的同时应补足血容量并加强营养支持。
入院后完善检查,血WBC 8.3×109/L,中性粒细胞0.64,Hb 191g/L,PLT 230×109/L。粪便常规及隐血试验正常。粪便微生物学检查(包括志贺菌及沙门菌培养、粪便难辨梭菌培养及毒素测定、寄生虫检测)均阴性。尿常规 :比重>1.030,余阴性。血 Alb 29g/L,余肝功能正常。肌酐 331μmol/L,尿素氮
:比重>1.030,余阴性。血 Alb 29g/L,余肝功能正常。肌酐 331μmol/L,尿素氮 20.5mmol/L,K+ 2.2mmol/L,Na+ 127mmol/L,Cl- 89mmol/L。血气分析:pH 7.32,PaO2 82mmHg,PaC02 23mmHg,HCO3- 11.3mmol/L,碱剩余
20.5mmol/L,K+ 2.2mmol/L,Na+ 127mmol/L,Cl- 89mmol/L。血气分析:pH 7.32,PaO2 82mmHg,PaC02 23mmHg,HCO3- 11.3mmol/L,碱剩余 -12.2mmol/L。ESR 3mm/1h,超敏CRP 17.4mg/L。 HIV抗体阴性。抗核抗体、抗可提取核抗原(anti-extractable nuclear antigen,ENA)抗体和抗中性粒细胞胞质抗体
-12.2mmol/L。ESR 3mm/1h,超敏CRP 17.4mg/L。 HIV抗体阴性。抗核抗体、抗可提取核抗原(anti-extractable nuclear antigen,ENA)抗体和抗中性粒细胞胞质抗体 (anti-neutrophil cytoplastic antibody,ANCA)均阴性。血IgG 1.80g/L(正常参考值为7.00~17.00g/L),IgA<0.26g/L(正常参考值为0.70~4.00g/L),lgM<0.17g/L(正常参考值为0.40~2.30g/L)。血促胃液素水平正常。心电图
(anti-neutrophil cytoplastic antibody,ANCA)均阴性。血IgG 1.80g/L(正常参考值为7.00~17.00g/L),IgA<0.26g/L(正常参考值为0.70~4.00g/L),lgM<0.17g/L(正常参考值为0.40~2.30g/L)。血促胃液素水平正常。心电图 示窦性心律,肢导联低电压。胸腹CT见双侧少量胸腔积液
示窦性心律,肢导联低电压。胸腹CT见双侧少量胸腔积液 和少量心包积液,余未见异常。核素标记生长抑素
和少量心包积液,余未见异常。核素标记生长抑素 受体显像阴性。胃镜检查示慢性浅表性胃炎,H.pylori快速尿素酶试验
受体显像阴性。胃镜检查示慢性浅表性胃炎,H.pylori快速尿素酶试验 阴性。结肠镜示末段回肠及全结直肠黏膜水肿(图2),未见溃疡或糜烂,予随机多点活组织检查。经禁食、完全肠外营养
阴性。结肠镜示末段回肠及全结直肠黏膜水肿(图2),未见溃疡或糜烂,予随机多点活组织检查。经禁食、完全肠外营养 并积极补液后,患者尿量
并积极补液后,患者尿量 增多,酸中毒及电解质紊乱被纠正,肾功能恢复正常,但腹泻无好转。
增多,酸中毒及电解质紊乱被纠正,肾功能恢复正常,但腹泻无好转。
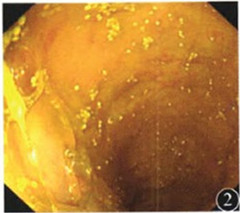
图2 入院后结肠镜见患者结肠黏膜广泛水肿
第二次临床讨论
本例患者Hb和尿比重升高、代谢性酸中毒,为腹泻后严重脱水所致。经充分补液后病情虽有好转,但禁食后腹泻并未减少,符合分泌性腹泻的特点。VIP瘤好发于胰腺。该肿瘤通过释放VIP来激活肠上皮细胞受体,促进肠道分泌增加,导致顽固性水样泻和低钾血症 ,亦称为“胰性霍乱
,亦称为“胰性霍乱 ”。VIP瘤属于罕见病,且低钾血症通常不易被纠正,与本病例的治疗反应不符,加上影像学检查阴性,故基本可以除外。某些自身免疫性疾病若广泛影响肠道(如系统性红斑狼疮、硬皮病等)也可导致大量水样泻,但本例患者自身抗体阴性,且缺乏此类疾病的相关表现,故暂不考虑。肠道淋巴瘤和巨大绒毛状腺瘤理论上也可造成分泌性腹泻,但影像学和内镜检查
”。VIP瘤属于罕见病,且低钾血症通常不易被纠正,与本病例的治疗反应不符,加上影像学检查阴性,故基本可以除外。某些自身免疫性疾病若广泛影响肠道(如系统性红斑狼疮、硬皮病等)也可导致大量水样泻,但本例患者自身抗体阴性,且缺乏此类疾病的相关表现,故暂不考虑。肠道淋巴瘤和巨大绒毛状腺瘤理论上也可造成分泌性腹泻,但影像学和内镜检查 均无阳性发现。显微镜下结肠炎可有大量顽固性水样泻,但结肠镜下黏膜却外观完好,本病例应考虑此病。因此在结肠镜下行多点活组织检查。然而显微镜下结肠炎难以解释患者IgG、IgA和IgM均明显低下。严重腹泻可造成一定量的免疫球蛋白经肠道丢失,多以IgG为主,而IgA和IgM受影响较小,原因在于IgA在肠黏膜含量丰富,而IgM相对分子质量较大,透过肠黏膜的可能性较小。本例患者3类免疫球蛋白均明显降低,难以用肠道丢失来解释,而应考虑为体液免疫缺陷。下一步应重点评估免疫缺陷的性质及严重程度,明确其病因。
均无阳性发现。显微镜下结肠炎可有大量顽固性水样泻,但结肠镜下黏膜却外观完好,本病例应考虑此病。因此在结肠镜下行多点活组织检查。然而显微镜下结肠炎难以解释患者IgG、IgA和IgM均明显低下。严重腹泻可造成一定量的免疫球蛋白经肠道丢失,多以IgG为主,而IgA和IgM受影响较小,原因在于IgA在肠黏膜含量丰富,而IgM相对分子质量较大,透过肠黏膜的可能性较小。本例患者3类免疫球蛋白均明显降低,难以用肠道丢失来解释,而应考虑为体液免疫缺陷。下一步应重点评估免疫缺陷的性质及严重程度,明确其病因。
血清蛋白电泳 见球蛋白比例为3.8% (正常参考值为9.1%~24.0%)。血、尿免疫固定电泳未见单克隆M蛋白。 血IgE、IgD和血、尿免疫球蛋白轻链
见球蛋白比例为3.8% (正常参考值为9.1%~24.0%)。血、尿免疫固定电泳未见单克隆M蛋白。 血IgE、IgD和血、尿免疫球蛋白轻链 水平均在正常范围。血淋巴细胞亚群分析:B淋巴细胞为0[正常参考值为(180~324)×106/L],CD4+T淋巴细胞为102×106/L(占外周血淋巴细胞比值为0.137),CD4+/CD8+T淋巴细胞比例为0.19 (正常参考值为0.90~2.00),CD8+T淋巴细胞异常激活。结肠黏膜病理检查示:HE染色见结肠上皮细胞脱落,表面附有较多细菌(图3),上皮内可见巨细胞病毒(cytomegalovirus,CMV)包涵体(图4)。革兰染色见结肠黏膜附着病原体多为革兰阴性杆菌。心脏彩色多普勒超声未见异常。骨髓穿刺示增生活跃,成熟粒细胞可见中毒颗粒,余未见异常。
水平均在正常范围。血淋巴细胞亚群分析:B淋巴细胞为0[正常参考值为(180~324)×106/L],CD4+T淋巴细胞为102×106/L(占外周血淋巴细胞比值为0.137),CD4+/CD8+T淋巴细胞比例为0.19 (正常参考值为0.90~2.00),CD8+T淋巴细胞异常激活。结肠黏膜病理检查示:HE染色见结肠上皮细胞脱落,表面附有较多细菌(图3),上皮内可见巨细胞病毒(cytomegalovirus,CMV)包涵体(图4)。革兰染色见结肠黏膜附着病原体多为革兰阴性杆菌。心脏彩色多普勒超声未见异常。骨髓穿刺示增生活跃,成熟粒细胞可见中毒颗粒,余未见异常。
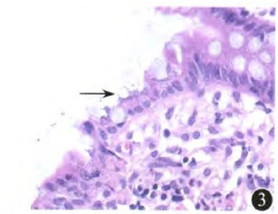
图3 结肠上皮细胞表面有较多细菌附着(箭头处) 苏木精-伊红染色×400
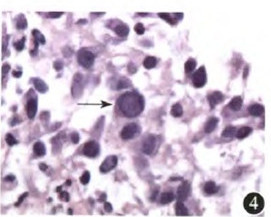
图4 结肠黏膜内可见巨细胞病毒包涵体(箭头处) 苏木精-伊红染色×400
第三次临床讨论
结肠肠腔内虽有大量细菌,但结肠黏膜可分泌具有抗菌活性的黏液,因此正常情况肠上皮表面并无细菌附着。本病例发现结肠上皮细胞不仅形态发生改变,其表面尚有大量细菌和CMV定植,提示免疫缺陷造成肠黏膜屏障功能严重受损。从组织学改变来看,肠道多重感染应该是患者长期顽固性腹泻的根本原因。本例患者不仅体液免疫受损,细胞免疫也有不同程度的缺陷,表现为CD4+T淋巴细胞计数减少, CD4+/CD8+T淋巴细胞比例倒置。免疫缺陷症可分为先天性和后天性两大类。本例患者发育正常,成年发病,既往无反复呼吸道感染病史,普通变异性免疫缺陷病(common variable immunodeficiency disease,CVID)等遗传性疾病可能性较小,应重点考虑后天性的病因,包括恶性肿瘤采用化学、放射疗法,使用免疫抑制剂,以及获得性免疫缺陷综合征(acquired immune deficiency syndrome,AIDS)等。本例患者5年前曾行胸腺瘤手术,但术后并未行化学、放射疗法。患者HIV抗体阴性,且临床表现也不符合AIDS的特征。
老年男性出现低免疫球蛋白血症还应考虑浆细胞 病。IgD型或轻链型多发性骨髓瘤
病。IgD型或轻链型多发性骨髓瘤 (multiple myeloma,MM)可产生大量异常单克隆M蛋白,并抑制IgG、lgA、IgM产生,造成这3种免疫球蛋白水平下降。本例患者心电图有低电压,曾怀疑是否为MM继发心肌淀粉样变性,但进一步检查并未发现MM的客观证据,考虑低电压可能为心包积液所致,后者很可能继发于长期消耗所引起的低白蛋白血症。值得注意的是,患者既往有胸腺瘤病史,结合严重免疫缺陷表现,高度提示—种罕见病——Good综合征。Good综合征以胸腺瘤、低免疫球蛋白血症、B淋巴细胞减少或缺如、CD4+/CD8+T淋巴细胞比例倒置为主要特征,本例患者的临床表现与之相符。
(multiple myeloma,MM)可产生大量异常单克隆M蛋白,并抑制IgG、lgA、IgM产生,造成这3种免疫球蛋白水平下降。本例患者心电图有低电压,曾怀疑是否为MM继发心肌淀粉样变性,但进一步检查并未发现MM的客观证据,考虑低电压可能为心包积液所致,后者很可能继发于长期消耗所引起的低白蛋白血症。值得注意的是,患者既往有胸腺瘤病史,结合严重免疫缺陷表现,高度提示—种罕见病——Good综合征。Good综合征以胸腺瘤、低免疫球蛋白血症、B淋巴细胞减少或缺如、CD4+/CD8+T淋巴细胞比例倒置为主要特征,本例患者的临床表现与之相符。
给予患者静脉输注免疫球蛋白(intravenous immunoglobulin,IVIG)20g/d,并予亚胺培南0.5g(3 次/d) 抗感染和膦甲酸钠 2.0g(3次/d)抗CMV治疗2周。血IgG水平升至正常范围,腹泻逐渐减少,2周后腹泻基本停止。随访半年,患者一般情况良好,体质量增加10kg。随访期间又有两次腹泻发作,及时行IVIG治疗后均好转。
2.0g(3次/d)抗CMV治疗2周。血IgG水平升至正常范围,腹泻逐渐减少,2周后腹泻基本停止。随访半年,患者一般情况良好,体质量增加10kg。随访期间又有两次腹泻发作,及时行IVIG治疗后均好转。
【专家点评】
Good综合征最早于1954年被报道。该病病因不明,好发年龄为40~70岁,是一种以胸腺瘤和免疫 缺陷为特征的原发性免疫缺陷病,可造成低免疫球蛋白血症、外周血B淋巴细胞减少或缺如和细胞免疫缺陷。据估计,成年发病的低免疫球蛋白血症患者约10%合并胸腺瘤;另一方面,6%~11%的胸腺瘤患者合并低免疫球蛋白血症。42%的Good综合征患者中,胸腺瘤的诊断比发生低免疫球蛋白血症或感染早3个月至18年。本例患者于5年前发现胸腺瘤,现诊断为Good综合征,前后相隔5年,与文献报道一致。
与其他免疫缺陷病一样,Good综合征易诱发机会性感染,最常见的感染部位为肺,其次是消化道。50%的Good综合征患者出现感染性腹泻,常见病原体包括革兰阴性肠杆菌、CMV和贾第鞭毛虫。本例患者有革兰阴性菌及CMV在肠黏膜定植的明确证据,可能是因为这些病原体破坏了肠上皮的完整性,造成肠道吸收水分能力严重下降,进而引起大量水样泻。Good综合征患者的预后较CVID患者更差,其5年和10年生存率仅为70%和33%,可能与Good综合征所合并感染的严重程度、血液及自身免疫性疾病相关,而与胸腺瘤的生物学行为无关。IVIG和抗感染治疗是Good综合征的主要治疗手段,IVIG可降低感染的发生率,因此建议Good综合征患者定期行IVIG治疗以维持合适的IgG水平。切除胸腺瘤虽可阻止肿瘤侵犯和转移,但通常不能逆转免疫缺陷状态。本例患者的病程和诊治经过符合上述规律。
由于Good综合征属于少见病,临床医师对其认识不够,加上感染会在胸腺瘤切除术后多年才出现,故早期诊断有时较为困难。北京协和医院的经验表明,胸腺瘤患者常有免疫系统异常,不仅会合并重症肌无力 、单纯红细胞再生障碍性贫血
、单纯红细胞再生障碍性贫血 等自身免疫性疾病,而且也会出现Good综合征这样的免疫缺陷病。在胸腺瘤患者中消化道受累占12.3%,其中以慢性腹泻最常见(7.2%)。免疫缺陷者一旦合并严重或非寻常感染,则应尽量获得病原学证据并及时予抗感染及IVIG治疗。
等自身免疫性疾病,而且也会出现Good综合征这样的免疫缺陷病。在胸腺瘤患者中消化道受累占12.3%,其中以慢性腹泻最常见(7.2%)。免疫缺陷者一旦合并严重或非寻常感染,则应尽量获得病原学证据并及时予抗感染及IVIG治疗。
Tips:医脉通消化科已经开通微信平台(详见微信开通公告),动动手指,点点屏幕,即可获得消化科每日的最新资讯内容。
关注方式:微信“添加朋友”搜索“医脉通消化科”或“medlive-Gastro”;扫描资讯右侧二维码。
