
自身免疫性胰腺炎二例误诊报道
作者:梅建民,聂洪峰,孙泊洋,巨邦律,北京军区总医院肝胆外科
自身免疫性胰腺炎 (autoimmune pancreatitis,AIP)是由自身免疫炎症介导,以胰腺弥漫性或局部增大及胰管不规则狭窄为特征的一种特殊类型的慢性胰腺炎
(autoimmune pancreatitis,AIP)是由自身免疫炎症介导,以胰腺弥漫性或局部增大及胰管不规则狭窄为特征的一种特殊类型的慢性胰腺炎 。Sarles等在1961年首次描述了此病,Yoshida等1995年正式提出了AIP的概念。2001年AIP已被认为是慢性胰腺炎的一种独立分型。
。Sarles等在1961年首次描述了此病,Yoshida等1995年正式提出了AIP的概念。2001年AIP已被认为是慢性胰腺炎的一种独立分型。
AIP临床少见,发病率占慢性胰腺炎的4%~6%,临床易误诊。我院近期收治AIP2例,均在外院误诊,现回顾临床资料并复习相关文献如下。
1病例资料
【例1】男,55岁。因腹痛,皮肤、巩膜黄染15d入院。15d前无明显诱因出现上腹部胀痛,尿呈浓茶样,无发热 、寒战、腹胀、腹泻
、寒战、腹胀、腹泻 。自服健胃消食片
。自服健胃消食片 后腹痛无明显好转,遂到当地医院就诊,行腹部超声示:肝内外胆管扩张,胰腺占位性病变;CT检查
后腹痛无明显好转,遂到当地医院就诊,行腹部超声示:肝内外胆管扩张,胰腺占位性病变;CT检查 示:胰腺弥漫性增大,胰头区占位性病变。为进一步诊治入我院。
示:胰腺弥漫性增大,胰头区占位性病变。为进一步诊治入我院。
无糖尿病、高血压病、冠心病病史,无烟酒史,发病前未暴饮暴食。查体:体温36.4℃,脉搏 75/min,呼吸18/min,血压118/75mmHg。皮肤、巩膜轻度黄染;心、肺无明显异常;腹平坦
75/min,呼吸18/min,血压118/75mmHg。皮肤、巩膜轻度黄染;心、肺无明显异常;腹平坦 ,未见胃肠型、蠕动波;肝脾肋下未触及;全腹无明显压痛,未触及包块,Murphy征(-),移动性浊音
,未见胃肠型、蠕动波;肝脾肋下未触及;全腹无明显压痛,未触及包块,Murphy征(-),移动性浊音 (-)。
(-)。
查血白细胞、粒细胞百分比正常;丙氨酸 转氨酶377U/L,总胆红素50.8μmol/L,直接胆红素23.1μmol/L,γ-谷氨酰转肽酶405U/L,碱性磷酸酶258U/L;血、尿淀粉酶
转氨酶377U/L,总胆红素50.8μmol/L,直接胆红素23.1μmol/L,γ-谷氨酰转肽酶405U/L,碱性磷酸酶258U/L;血、尿淀粉酶 正常;肝炎病毒血清标志物均(-);癌抗原(CA)19-963.0kU/L,余肿瘤标志物均正常。
正常;肝炎病毒血清标志物均(-);癌抗原(CA)19-963.0kU/L,余肿瘤标志物均正常。
CT检查示:胆囊增大,肝内外胆管增宽,胆总管下端梗阻;胰头及体尾部明显增大,胰腺呈“腊肠样”改变(图1),胰体后缘和胰尾前缘“包鞘样”改变。CT诊断:AIP,不除外壶腹部占位性病变,建议进一步行血清免疫学检查或穿刺活检。
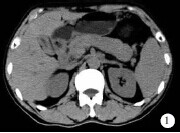
图1自身免疫性胰腺炎CT平扫 所见
所见
磁共振胰胆管造影(MRCP)检查示:低位胆道梗阻,胰腺增粗。根据MRCP检查结果结合CT表现考虑为AIP,不除外壶腹部周围癌。查血清IgG19.2g/L,IgA、IgM正常。鉴于患者有黄疸 、IgG升高、胰腺弥漫性增大,临床拟诊为AIP。
、IgG升高、胰腺弥漫性增大,临床拟诊为AIP。
予醋酸泼尼松 30mg/d口服并保肝治疗。糖皮质激素
30mg/d口服并保肝治疗。糖皮质激素 治疗4d后临床症状明显缓解,复查总胆红素19.4μmol/L,直接胆红素8.4μmol/L,IgG16.0g/L。2周后复查CT示胆囊明显缩小,肝内外胆管增宽减轻,胰腺仍较大,胰体后缘和胰尾前缘“包鞘样”改变与2周前CT检查结果相仿。
治疗4d后临床症状明显缓解,复查总胆红素19.4μmol/L,直接胆红素8.4μmol/L,IgG16.0g/L。2周后复查CT示胆囊明显缩小,肝内外胆管增宽减轻,胰腺仍较大,胰体后缘和胰尾前缘“包鞘样”改变与2周前CT检查结果相仿。
根据治疗结果,确诊为AIP。继续糖皮质激素治疗,醋酸泼尼松减量为20mg/d。1个月后复查CT示肝内外胆管增宽较前明显减轻,胰腺增大有所消退。继续原有治疗,醋酸泼尼松每周递减5mg,至5mg/d后维持治疗。6个月后复查CT示肝内外胆管无明显扩张,胰腺体积基本正常,停用醋酸泼尼松。随访2年,患者一般情况良好,无复发。
【例2】女,49岁。因左上腹部胀闷1个月,伴左上腹痛1周入院。1个月前感左上腹部胀闷不适,进食后加重。1周前无明显诱因出现左上腹疼痛,疼痛向左腰背部、左肩部放射,于当地医院就诊,口服止痛药物治疗(具体不详)效果不佳,查腹部CT 示:胰腺饱满、肿胀,考虑占位性病变;肝内可见低密度病灶影,不除外肝转移癌可能,为进一步诊治入我院。
示:胰腺饱满、肿胀,考虑占位性病变;肝内可见低密度病灶影,不除外肝转移癌可能,为进一步诊治入我院。
无糖尿病、高血压病、冠心病病史,无烟酒史,发病前未暴饮暴食。查体:体温36.7℃,脉搏78/min,呼吸17/min,血压129/82mmHg。皮肤、巩膜无黄染;心、肺无明显异常;左上腹部轻度压痛,无反跳痛及肌紧张,未触及包块。查血白细胞、粒细胞百分比正常;丙氨酸转氨酶377U/L,总胆红素15.7μmol/L,直接胆红素7.5μmol/L,γ-谷氨酰转肽酶187U/L,碱性磷酸酶94U/L;总胆固醇、甘油三酯、血淀粉酶、尿淀粉酶均正常;肝炎病毒血清标志物、肿瘤标志物均(-),自身抗体15项检测均正常。
腹部B超示:肝内外胆管无扩张,肝右叶可见直径0.9 cm无回声区;胰头大小正常,胰体增宽(2.9 cm),胰尾2.2 cm,体尾部回声不均,未见明确肿物回声,主胰管无扩张,提示诊断:胰腺体尾部回声欠均匀,肝囊肿 。腹部CT检查示:肝右叶有一直径8mm小圆形低密度影,胰腺增粗,以颈部为著,见图2;增强扫描示肝右叶低密度影未见强化,胰腺均匀强化,提示诊断:肝右叶囊肿;胰腺增粗,不除外不典型胰腺炎。
。腹部CT检查示:肝右叶有一直径8mm小圆形低密度影,胰腺增粗,以颈部为著,见图2;增强扫描示肝右叶低密度影未见强化,胰腺均匀强化,提示诊断:肝右叶囊肿;胰腺增粗,不除外不典型胰腺炎。
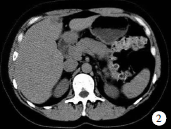
图2自身免疫性胰腺炎CT平扫所见
行血清免疫学检测 :IgG17.0g/L,IgA、IgM正常。临床拟诊为AIP,征得患者和家属同意后,予醋酸泼尼松20mg/d口服试验性治疗。3d后腹痛明显缓解,1周后复查血清IgG12.6g/L,2周后复查CT示胰腺颈部增粗较前有所减轻。结合糖皮质激素治疗效果,临床确诊为AIP。继续糖皮质激素治疗,醋酸泼尼松每周递减5mg,至5mg/d后维持治疗3个月。再次复查CT示胰腺大小、形态基本正常,停用醋酸泼尼松。随访1年,患者一般情况良好,无复发。
:IgG17.0g/L,IgA、IgM正常。临床拟诊为AIP,征得患者和家属同意后,予醋酸泼尼松20mg/d口服试验性治疗。3d后腹痛明显缓解,1周后复查血清IgG12.6g/L,2周后复查CT示胰腺颈部增粗较前有所减轻。结合糖皮质激素治疗效果,临床确诊为AIP。继续糖皮质激素治疗,醋酸泼尼松每周递减5mg,至5mg/d后维持治疗3个月。再次复查CT示胰腺大小、形态基本正常,停用醋酸泼尼松。随访1年,患者一般情况良好,无复发。
2讨论
2.1发病原因
AIP的病因目前尚未完全清楚,本文2例均无胆石症、饮(酗)酒史、高脂血症 、暴饮暴食史、药物等致胰腺炎的常见病因。复习相关文献,AIP发病可能与下列因素有关:
、暴饮暴食史、药物等致胰腺炎的常见病因。复习相关文献,AIP发病可能与下列因素有关:
①免疫因素:免疫介导的发病机制一直以来是AIP研究的重点。大量文献已证实,AIP患者大多患有高球蛋白血症及血清IgG4水平升高表现,可检测出诸如抗核抗体、人类Ⅱ型碳酸酐酶抗体(ACA-Ⅱ)及抗淀粉酶α-2A抗体等自身抗体的阳性表达,胰管基底膜上可见补体C3及IgG沉积。同时,在AIP患者外周血及胰腺组织中CD4+T细胞及CD8+T细胞的比例升高而CD45RA+调节性T细胞显著减少,说明细胞及体液免疫机制均参与了AIP的发生及发展。
②遗传因素:免疫系统疾病的发生往往与基因突变密切相关。AIP可与系统性红斑狼疮、炎症性肠病等其他自身免疫性疾病伴随发生,因此推测AIP的发病亦有遗传因素参与。
③感染因素:幽门螺杆菌感染 后可通过被ACA-Ⅱ识别而诱发自身免疫反应、细胞凋亡,促发AIP并加速慢性胰腺炎的胰腺损害。
后可通过被ACA-Ⅱ识别而诱发自身免疫反应、细胞凋亡,促发AIP并加速慢性胰腺炎的胰腺损害。
2.2分型与病理特征
根据组织病理学的不同,可将AIP分为如下两型。
2.2.1淋巴浆细胞 硬化性胰腺炎(LPSP):或称自身免疫性胰腺炎不伴粒细胞上皮损害(GEL),其具有如下组织病理学特征:
硬化性胰腺炎(LPSP):或称自身免疫性胰腺炎不伴粒细胞上皮损害(GEL),其具有如下组织病理学特征:
①在胰管周围有稠密的浆细胞和淋巴细胞浸润;②特殊的席纹样纤维化;③伴淋巴细胞和浆细胞的小静脉炎,常引起受累静脉闭塞;④大量的IgG4阳性浆细胞[10/高倍视野(HP)]。此型临床表现与IgG4相关系统性疾病的胰腺病变相似。IgG4相关系统性疾病的特征是血清IgG4水平升高,诸如硬化性胆管炎、硬化性涎腺炎、腹膜后纤维化等伴大量IgG4阳性浆细胞浸润的胰腺外病变。
2.2.2自发性导管中心性胰腺炎(IDCP):或称自身免疫性胰腺炎伴GEL,美国和欧洲多发。LPSP与IDCP具有某些相同的组织病理学特征,如胰管周围淋巴浆细胞浸润和席纹样纤维化。但IDCP不同于LPSP之处在于是否伴有GEL,具体组织病理学表现为胰腺腺泡和中、细胰管腔和上皮内中性粒细胞浸润,引起胰管破坏和闭塞。IDCP无或很少有IgG4阳性浆细胞浸润(10/HP)(目前国际胰腺学会将LPSP归于Ⅰ型AIP,IDCP归于Ⅱ型AIP)。
临床资料显示,IDCP不像是一种系统性疾病,更像是一种胰腺独特性病变,不伴血清IgG4升高和其他脏器受累。但文献报道约30%的IDCP患者伴有溃疡性结肠炎 等炎症性肠病。
等炎症性肠病。
2.3临床特点
2.3.1发病特点:
AIP起病隐匿,Ⅰ型AIP以男性为主,通常发病年龄>50岁;Ⅱ型AIP无明显性别差异,发病年龄约40岁。
2.3.2症状、体征:
AIP的临床症状以进行性或间歇性黄疸伴或不伴腹痛为主,腹痛多为上腹部不适或轻度疼痛,少有急性胰腺炎 样重度腹痛,还可有体重下降、乏力、恶心、呕吐、腹胀等表现。本文例1表现为腹痛和轻度黄疸,例2主要表现为左上腹疼痛,均无急性胰腺炎样重度腹痛症状。王科伟等报道AIP1例,并检索数据库收集2001年1月—2010年12月国内文献报道的AIP107例,共分析108例AIP的临床症状,其中74%(80/108)的患者有梗阻性黄疸,46%(50/108)的患者有上腹部不适或疼痛,约1%(1/108)的患者无症状。
样重度腹痛,还可有体重下降、乏力、恶心、呕吐、腹胀等表现。本文例1表现为腹痛和轻度黄疸,例2主要表现为左上腹疼痛,均无急性胰腺炎样重度腹痛症状。王科伟等报道AIP1例,并检索数据库收集2001年1月—2010年12月国内文献报道的AIP107例,共分析108例AIP的临床症状,其中74%(80/108)的患者有梗阻性黄疸,46%(50/108)的患者有上腹部不适或疼痛,约1%(1/108)的患者无症状。
2.3.3伴随疾病:
文献报道20%~50%的AIP伴有其他自身免疫性疾病,如口眼干燥关节炎综合征、原发性硬化性胆管炎 、硬化性涎腺炎、溃疡性结肠炎、系统性红斑狼疮、糖尿病(以2型为主)、肺间质纤维化、自身免疫性甲状腺炎及腹膜后纤维化等,少数患者可同时伴两种自身免疫性疾病。
、硬化性涎腺炎、溃疡性结肠炎、系统性红斑狼疮、糖尿病(以2型为主)、肺间质纤维化、自身免疫性甲状腺炎及腹膜后纤维化等,少数患者可同时伴两种自身免疫性疾病。
2.3.4实验室检查:
AIP患者血清球蛋白、IgG尤其是IgG4水平升高;胆红素升高,丙氨酸转氨酶异常;约50%的AIP患者血淀粉酶升高,但高于正常值3倍者少见;AIP患者血清脂肪酶(胰腺外分泌酶有淀粉酶、脂肪酶和蛋白酶,脂肪酶为其中之一)多正常或轻度升高,血糖升高,血清多种自身抗体阳性表达,部分病例可有CA19-9轻度升高。
2.3.5影像学检查:
AIP患者影像学检查特征表现为胰腺弥漫性或局限性增大,局限性AIP通常累及胰头部,胰腺钙化、胰管结石以及假性囊肿少见。
本文例1为胰腺弥漫性增大,例2为胰腺局限性增大。①B型超声检查:AIP患者增大的胰腺多呈低回声并伴有粗糙斑点状回声。②CT检查:CT检查是诊断AIP最常用的影像学检查手段,弥漫性AIP常表现为胰腺呈“腊肠样”增大,在CT平扫、动脉期、静脉期和延迟期病变胰腺组织密度均匀,胰腺延迟强化。增强CT扫描时,早期为相对低密度,而延迟期密度逐渐升高,呈渐进式强化,这与正常胰腺的强化特点不同。AIP病变延迟强化的特点是由于增生的纤维组织压迫胰腺内微血管致血管管腔变窄,血流速度变慢,造影剂缓慢进入、流出病变组织,从而产生延迟强化效应。此外,胰腺周围还可见胶囊样环,这可能是包含胰周脂肪组织的纤维化改变所致。③MRCP或逆行胰胆管造影检查 :AIP行MRCP或逆行胰胆管造影表现为主胰管弥漫性或节段性狭窄,有时可见胆管狭窄,多累及胰腺段。
:AIP行MRCP或逆行胰胆管造影表现为主胰管弥漫性或节段性狭窄,有时可见胆管狭窄,多累及胰腺段。
2.4诊断标准
AIP最初的诊断标准为日本胰腺学会在2002年制订的日本胰腺病协会(JPS)标准,此后有修正的日本标准和韩国的Kim标准以及美国的HISORT标准。2008年日本与韩国学者共同推出了AIP的亚洲诊断标准:①影像学改变,胰腺弥漫性或局限性增大,有时伴有包块和(或)边缘低密度影或信号;胰管弥漫性或局限性狭窄,常伴有胆管狭窄。②血清学检查,血清IgG或IgG4升高,其他自身免疫性抗体阳性。③组织学检查,胰腺病变部位淋巴细胞浸润伴纤维化。④可选择标准为糖皮质激素治疗有效。影像学征象为必备条件,血清学和组织学检查可仅具备其中之一。
2011年国际胰腺疾病协会发表了AIP的国际诊断标准,该诊断标准按P(胰腺实质影像)、D(胰腺导管影像)、S(血清学)、OOI(other organ involvement,胰腺外器官受累)、H(胰腺组织学)、R(糖皮质激素治疗反应)若干项,将Ⅰ型、Ⅱ型AIP均分为1级和2级。因Ⅱ型AIP缺乏血清学标志物检测,故其国际诊断标准强调了组织学病理检查 的重要性。
的重要性。
2.5鉴别诊断
2.5.1胰腺癌 :
:
AIP临床表现多为逐渐加重的黄疸或腹部不适、腹痛,与胰腺癌的临床表现相似;影像学表现为胰腺弥漫性增大或局限性增大,尤其胰头增大时与胰腺癌在外形上极其相似,加之部分AIP患者CA19-9升高,临床极易误诊为胰头癌。
国内AIP的误诊率高,有报道该病在肝胆外科误诊率高达96%;另有报道该病因误诊而行外科手术者高达91%。对于AIP与胰腺癌的鉴别,要重视临床症状(包括胰腺外器官病变),仔细分析胰腺CT影像学特征。胰腺(头)癌CT检查示胰腺多无弥漫性增大,CT平扫为低密度影,增强扫描强化密度低于正常胰腺组织,多有主胰管突然截断表现,肿瘤远端胰管明显扩张,以腹腔干动脉、门静脉和肠系膜上静脉受侵常见。AIP增强CT扫描示受累胰腺部位静脉期CT值明显高于胰腺癌,受累胰腺远端胰管无扩张或略扩张,胰周血管受侵少见。
此外,AIP与胰腺癌的鉴别诊断还应注意血清球蛋白、IgG或IgG4水平、自身免疫抗体和肿瘤标志物的检测。有研究显示,血清IgG达1777mg/L时,诊断AIP的敏感度和特异度分别为57.1%和93.7%;IgG4达1410mg/L时,敏感度和特异度分别为73.3%和95.1%;IgG4达2800mg/L时,敏感度和特异度分别为53%和99%。有报道显示,血清IgG4和CA19-9联合检测可用于AIP与胰腺癌的鉴别诊断。
2.5.2普通慢性胰腺炎:
普通慢性胰腺炎患者大多有饮酒史或胆源性疾病史,影像学检查常见胰腺实质萎缩,主胰管不规则扩张,常伴有胰管内结石、黏蛋白栓、胰腺实质钙化和胰周假性囊肿形成。临床医生应注意AIP与普通慢性胰腺炎的鉴别诊断,以避免错过糖皮质激素治疗的最佳时机。
2.6治疗方法
糖皮质激素治疗AIP的临床效果良好,可缓解患者症状,改善其实验室指标和胰腺影像学表现,还能使胰腺和胰腺外受累器官情况好转。有关醋酸泼尼松应用的剂量、时间文献报道不一,通常醋酸泼尼松起始剂量为30~40mg/d,治疗2~4周后每1~2周剂量递减5mg,一般总疗程为半年;也有医生初始予醋酸泼尼松40mg/d共1周,以后每周减量5mg,至5mg/d维持,直至病情完全缓解。
Kamisawa等通过长期随访发现AIP的病情改善程度与糖皮质激素治疗起始剂量并无明显关系,因而更推荐糖皮质激素以30mg/d作为起始剂量。还有学者采用糖皮质激素冲击疗法(甲泼尼龙 琥珀酸钠500mg/d,每周3d,共2周),发现AIP患者恢复速度更快。
琥珀酸钠500mg/d,每周3d,共2周),发现AIP患者恢复速度更快。
关于AIP治疗的时间,多数学者主张长疗程,一般需待胰腺影像学形态恢复正常后方可停药。糖皮质激素治疗AIP后复发率为6%~26%,复发患者可再用大剂量糖皮质激素治疗,约6%的患者需小剂量(2.5~5.0mg/d)维持治疗,也有部分患者不经糖皮质激素治疗亦能自行缓解。另有个案报道熊去氧胆酸 对AIP也有治疗作用,但其治疗效果仍有待进一步随访研究。
对AIP也有治疗作用,但其治疗效果仍有待进一步随访研究。
本组例1应用醋酸泼尼松初始剂量为30mg/d,患者症状、体征及影像学改变很快缓解。例2症状相对较轻,未见胰腺弥漫性增大,故醋酸泼尼松剂量较例1小(20mg/d),治疗3d后症状即明显缓解,1周后血清IgG恢复正常。例1应用醋酸泼尼松半年、例2应用3个月,均在CT检查示胰腺形态基本恢复正常后停药,且停药后随访期间均无复发。
通过本组2例治疗,笔者体会AIP的糖皮质激素治疗应采取个体化剂量,治疗过程中应严密观察患者症状缓解情况,严格定期复查血生化和血清免疫学指标及胰腺影像学,当血清IgG和胰腺影像学形态基本恢复正常后停药,但要避免过早停药或糖皮质激素维持剂量不足导致疾病的复发。应用糖皮质激素治疗时,对AIP合并糖尿病患者应注意将血糖控制在正常范围内。如AIP患者临床症状持续而糖皮质激素治疗无效或怀疑恶性肿瘤时,必须行外科手术治疗。
2.7误诊原因与反思
AIP是一种临床少见病,目前国际上对AIP的研究资料大多集中在日本及欧美国家,国内对AIP的认识尚处于起步阶段,病例报道较少,无相关诊断标准,加之临床对AIP缺乏诊治经验,易导致误诊、误治。
本组2例外院影像学检查均诊断为胰腺占位性病变。分析外院误诊原因主要由于AIP影像学表现与胰腺占位性病变极其相似,难以鉴别,加之临床医生对AIP认知较少,未行血清免疫学检查。提示外科医生应拓宽胰腺病的疾病谱,加强对AIP的认知,减少误诊、误治,尤其要避免将AIP误诊为胰腺癌而进行不必要的外科手术治疗。在对胰腺肿物的诊断过程中,应考虑到AIP的可能,仔细分析胰腺肿物的影像学表现,行血清免疫学检查,必要时在B超或CT引导下行胰腺穿刺细胞学检查。如仍不能确诊且无明确胰腺癌证据,可在严密监视下应用糖皮质激素试验性治疗,如糖皮质激素治疗后症状改善,胰腺增大程度减轻或肿物消退,可诊断为AIP。
来源:临床误诊误治2014年4月第27卷第4期
