
EC²大咖食力论道 | 姜涛教授:论食管癌免疫治疗合纵连横的破围之术
近年来,食管癌 领域重磅研究层出不穷,以免疫治疗为首的新型治疗策略逐渐崭露头角,陆续取得令人瞩目的成果,也为食管癌多学科综合治疗模式的发展注入了一针“强心剂”。为了帮助临床医师更好地了解免疫治疗药物临床应用和洞悉食管癌领域前沿进展,推动食管癌规范化和精准治疗进程。本期《EC²大咖食力论道》食管癌访谈栏目特邀空军军医大学唐都医院姜涛教授围绕食管癌围手术期免疫治疗现状、临床研究进展和未来探索方向进行分享。
领域重磅研究层出不穷,以免疫治疗为首的新型治疗策略逐渐崭露头角,陆续取得令人瞩目的成果,也为食管癌多学科综合治疗模式的发展注入了一针“强心剂”。为了帮助临床医师更好地了解免疫治疗药物临床应用和洞悉食管癌领域前沿进展,推动食管癌规范化和精准治疗进程。本期《EC²大咖食力论道》食管癌访谈栏目特邀空军军医大学唐都医院姜涛教授围绕食管癌围手术期免疫治疗现状、临床研究进展和未来探索方向进行分享。
多管齐下——以手术为主的综合治疗显著改善食管癌诊疗现状
我国是食管癌大国,每年新发病例数约占全球总患者数的一半¹,近年来随着人们生活水平的提高及生活方式的改变,食管癌的发病率呈现下降趋势。然而,由于早期食管癌缺乏典型的临床症状和体征,大多数患者就诊时已为局部晚期或存在远处转移;过去三十年间,我国各地医疗条件、技术水平和医生观念存在较大差异,以手术为主的食管癌综合治疗模式还不统一,也欠缺规范,严重影响了患者的生存结局²。
随着食管癌规范化治疗的进步和围手术期治疗的推广应用,以手术为主的综合治疗方案在食管癌诊治中占有重要地位。围手术期治疗包括术前新辅助与术后辅助治疗,涉及化疗、放化疗与免疫治疗等。基于最新CSCO诊疗指南治疗原则,可切除食管癌主要有3种治疗模式:手术+辅助化疗和(或)放疗/观察、新辅助放化疗+手术+辅助免疫治疗/观察/辅助化疗、新辅助化疗+手术+辅助化疗/观察³。得益于多学科综合治疗的理念不断深化,我国较成熟的食管癌外科中心术后3年及5年总生存率已提升至61.6%及52.9%⁴。
尽管如此,有研究显示,中位随访时间近52个月后,局部晚期食管癌术后复发率高达33.7%⁵。因此,突破局部晚期食管癌术后长期无病生存期(DFS)的瓶颈仍旧严重困扰着临床。
瞄准复发——CheckMate-577研究为围手术期免疫治疗破冰开路
尽管采用了根治性切除手术,但由于淋巴结清除具有一定的局限性以及隐蔽微小转移灶的存在,使得患者在根治术后易出现局部复发,并且大部分患者在食管癌根治术后1~2年内复发⁶。食管癌治疗失败的主要原因是局部复发和未控,复发的高危因素包括:肿瘤细胞低分化、肿瘤浸润深度较深(如T4期)、有淋巴结转移、淋巴结转移数多以及残端阳性⁷。建议以上高危人群术后密切随访。
CheckMate-577研究是改变食管癌围手术期治疗格局的一项研究,该研究首次证实,纳武利尤单抗 用于经新辅助放化疗联合根治性手术后仍有病理学残留(non-pCR)的食管癌及胃食管连接部癌的辅助治疗可以获得翻倍的DFS获益。在总人群中,纳武利尤单抗组与安慰剂组的DFS分别为22.4个月和11.0个月(HR=0.69);在腺癌中,DFS分别为19.4个月和11.1个月(HR=0.75);在鳞癌中,DFS分别为29.7个月和11.0个月(HR=0.61),获益更佳⁸。我国食管癌约90%患者为食管鳞癌⁹,CheckMate-577研究的成功无疑给局部晚期食管癌患者带来了福音。
用于经新辅助放化疗联合根治性手术后仍有病理学残留(non-pCR)的食管癌及胃食管连接部癌的辅助治疗可以获得翻倍的DFS获益。在总人群中,纳武利尤单抗组与安慰剂组的DFS分别为22.4个月和11.0个月(HR=0.69);在腺癌中,DFS分别为19.4个月和11.1个月(HR=0.75);在鳞癌中,DFS分别为29.7个月和11.0个月(HR=0.61),获益更佳⁸。我国食管癌约90%患者为食管鳞癌⁹,CheckMate-577研究的成功无疑给局部晚期食管癌患者带来了福音。
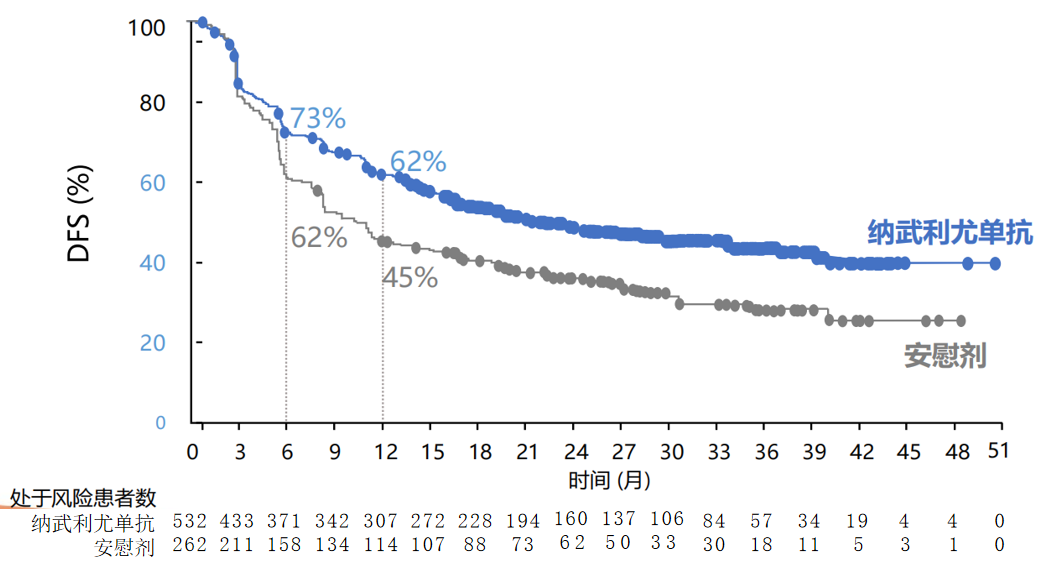
图1:纳武利尤单抗组和安慰剂组在总人群中的DFS
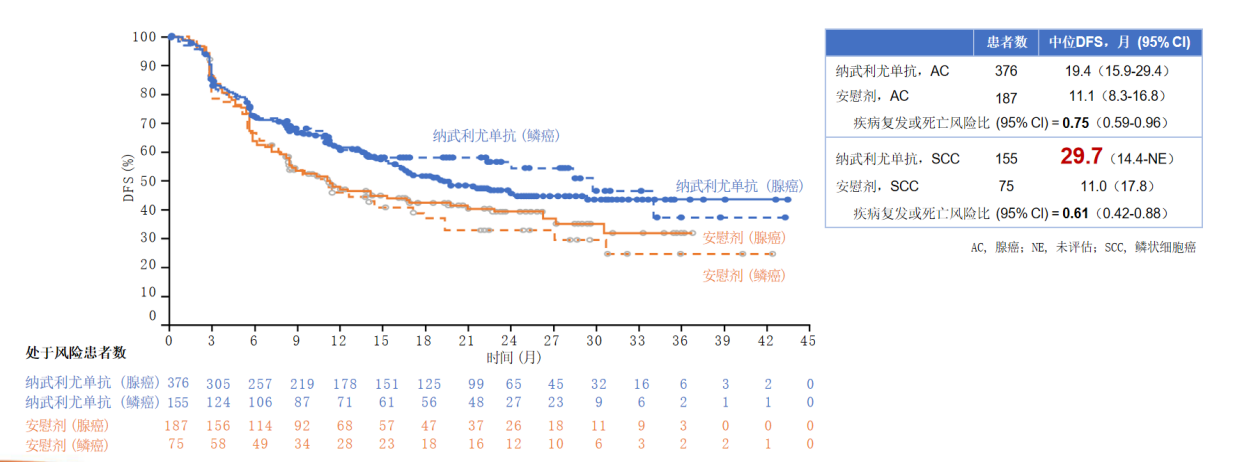
图2:纳武利尤单抗组和安慰剂组在食管腺癌和食管鳞癌中的DFS
此外,2021年ESMO大会公布了CheckMate-577研究14个月随访结果,其探索性研究终点——无远处转移生存期(DMFS)在纳武利尤单抗组和安慰剂组中分别为29.4个月和16.6个月,提高12.8个月,且安全性可控¹⁰。正是基于该研究,纳武利尤单抗获得NCCN和CSCO指南的双重推荐³,填补了食管癌术后辅助免疫治疗的空白。
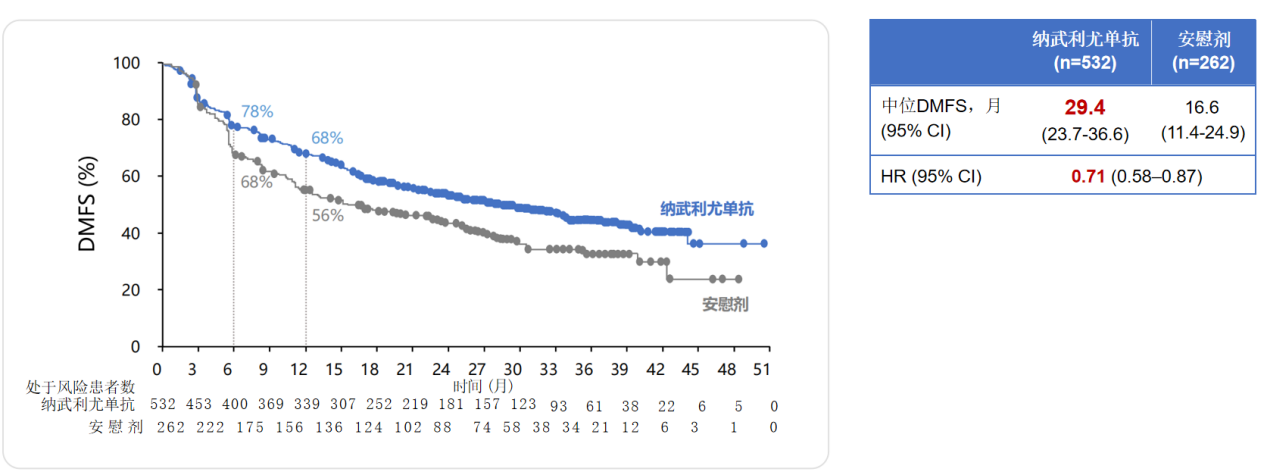
图3:纳武利尤单抗组和安慰剂组的DMFS
百舸争流——新辅助免疫治疗联合放化疗或化疗研究初露锋芒
新辅助治疗有利于肿瘤降期、消灭全身微小转移灶,并观察肿瘤对化疗方案的反应程度,以指导术后化疗。对于可切除的局部晚期患者考虑行新辅助治疗。CROSS研究首先奠定了新辅助放化疗(nCRT)在局部晚期食管癌中的标准治疗地位,其10年随访结果证明,相比单纯手术组,术前放化疗组的10年生存率提高13%(38% vs 25%),死亡风险降低40%¹¹,另外新辅助放化疗联合根治性手术可使29%患者获得病理学完全缓解(pCR)¹²。
鉴于免疫治疗在食管癌晚期一线和术后辅助治疗领域的高歌猛进,食管癌术前新辅助免疫治疗的前景也备受期待,不同新辅助免疫联合治疗相关研究在不断开展。在新辅助化疗联合免疫治疗中,TD-NICE研究¹³的pCR率达到50%;NICE研究¹⁴术后pCR率也达到42.5%;KEYSTONE-001研究¹⁵和ESPRIT研究¹⁶的pCR率分别为41.4%和35%。另外,新辅助同步放化疗联合免疫治疗的PALACE-1研究¹⁷将新辅助免疫治疗联合策略研究推向了白热化,pCR率高达56%,但该研究样本量较小,仍需扩大样本量来进一步证实新辅助同步放化疗联合免疫治疗的疗效和安全性。以上研究初步证明了食管癌新辅助免疫治疗的安全性与可行性,然而高pCR率能否转化为生存获益有待进一步研究,术后长期生存结果仍待不断积累验证。
那么新兴的新辅助免疫治疗与当前作为标准的术后辅助免疫治疗如何布局?一项临床前研究显示新辅助免疫治疗优于辅助免疫治疗,并认为其升高和持续的外周肿瘤特异性免疫反应支持该结论¹⁸,但临床情况复杂,这一结论有待验证。还有学者提出术前新辅助免疫治疗联合术后免疫维持治疗也许可以最大限度地改善食管癌患者的免疫微环境,进而为患者带来更多获益。该设想也需要通过巧妙的试验设计和高质量的临床研究来证实,从而探索出最优围手术期免疫治疗策略。
薪火绵延——食管癌围手术期免疫治疗在探索的征途中永不止步
目前,食管癌围手术期免疫治疗初见曙光,相关研究在如火如荼地进行中。在术后辅助治疗中,CheckMate-577研究已经改变了当前局部晚期食管癌综合治疗模式下的临床实践,那么术前新辅助免疫治疗联合术后免疫维持治疗是否可以达到1+1>2的疗效并实现局部晚期食管癌患者最大获益,值得进一步研究。关于新辅助免疫联合策略选择放化疗还是化疗以及能否改善患者术后生存获益等问题也期待在未来的Ⅲ期临床研究得到答案。
最后,免疫治疗发展迅速,临床中也有很多问题需要解决。比如目前还缺乏准确预测疗效的分子标志物以指导食管癌围手术期免疫治疗。此外,免疫治疗相关不良反应(irAEs)应警惕并且严密监测,如何妥善管理irAEs是当前肿瘤多学科诊疗领域的前沿问题,多学科治疗理念和策略的更新会让更多患者从免疫治疗中获益。
专家简介

参考文献:
1. Sung H,Ferlay J,Siegel RL,et al.Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J].CA Cancer J Clin,2021,71(3):209-249.
2. 毛友生,赫捷,高树庚,薛奇.我国食管癌外科治疗目前存在的热点争议与未来研究方向[J].中华胃肠外科杂志,2015,(9):851-854.
3. 中国临床肿瘤学会指南工作委员会组织.中国临床肿瘤学会(CSCO)食管癌诊疗指南-2022[M]. 北京:人民卫生出版社,2022
4. Mao YS, Gao SG, Wang Q, et al. Analysis of a registry database for esophageal cancer from high-volume centers in China. Dis Esophagus. 2020 Aug 3;33(8):doz091.
5. Liu S, Wen J, Yang H, et al. Recurrence patterns after neoadjuvant chemoradiotherapy compared with surgery alone in oesophageal squamous cell carcinoma: results from the multicenter phase III trial NEOCRTEC5010. Eur J Cancer. 2020 Oct;138:113-121.
6. 王冠,曹锦,刘浩聪,杨怡萍.局部复发性食管癌放疗的研究进展[J].现代肿瘤医学,2020,28(8):1402-1406.
7. 朱自江, 陈学忠, 牛荣,等. 食管癌患者术后肿瘤复发和转移的危险因素分析[J]. 中国胸心血管外科临床杂志, 2011, 18(6):5.
8. Kelly RJ, Ajani JA, Kuzdzal J, et al. Adjuvant Nivolumab in Resected Esophageal or Gastroesophageal Junction Cancer. N Engl J Med. 2021;384(13):1191-1203.
9. 宋琦,蒋冬先,侯英勇.食管鳞状细胞癌的分子生物学研究进展[J].中华病理学杂志,2016,45(3):217-220.
10. Moehler, M et al 2021, Adjuvant nivolumab in resected esophageal or gastroesophageal junction cancer following neoadjuvant chemoradiotherapy: 14-month follow-up of CheckMate 577, Poster 1381P, presented at the ESMO Virtual Congress 2021, September 16-21.
11. Eyck BM, van Lanschot JJB, Hulshof MCCM, et al. Ten-Year Outcome of Neoadjuvant Chemoradiotherapy Plus Surgery for Esophageal Cancer: The Randomized Controlled CROSS Trial. J Clin Oncol. 2021 Jun 20;39(18):1995-2004.
12. van Hagen P, Hulshof MC, van Lanschot JJ, et al. Preoperative chemoradiotherapy for esophageal or junctional cancer. N Engl J Med. 2012 May 31;366(22):2074-84.
13. Yan X, Duan H, Ni Y, et al. Tislelizumab combined with chemotherapy as neoadjuvant therapy for surgically resectable esophageal cancer: A prospective, single-arm, phase II study (TD-NICE). Int J Surg. 2022 Jul;103:106680.
14. LI Z,LIU J,ZHANG M,et al.A phase II study of neoadjuvant immunotherapy combined with chemotherapy(camrelizumab plus albumin paclitaxel and carboplatin)in resectable thoracic esophageal squamous cell cancer(NICE study):Interim results. J Clin Oncol. 2021,39(15_suppl):4060.
15. Shang X, Zhao G, Liang F, et al. Safety and effectiveness of pembrolizumab combined with paclitaxel and cisplatin as neoadjuvant therapy followed by surgery for locally advanced resectable (stage III) esophageal squamous cell carcinoma: a study protocol for a prospective, single-arm, single-center, open-label, phase-II trial (Keystone-001). Ann Transl Med. 2022 Feb;10(4):229.
16. MA J,ZHANG J,YANG Y et al.65P Camrelizumab combined with paclitaxel and nedaplatin as neoadjuvant therapy for locally advanced esophageal squamous cell carcinoma(ESPRIT):A phase II,single-arm,exploratory research. Ann Oncol. 2021,32:S1400.
17. LI C,ZHAO S,ZHENG Y et al.Preoperative pembmlizumab combined with chemoradiotherapy for oesophageal squamous cell carcinoma(PALACE-1). Eur J Cance. 2021,144:232-241.
18. Liu J, Blake SJ, Yong MC, Harjunpää H, Ngiow SF, Takeda K, Young A, O'Donnell JS, Allen S, Smyth MJ, Teng MW. Improved Efficacy of Neoadjuvant Compared to Adjuvant Immunotherapy to Eradicate Metastatic Disease. Cancer Discov. 2016 Dec;6(12):1382-1399.
1506-CN-2300009
