
【2023 ASCO】阿伐替尼治疗KIT突变晚期GIST数据重磅发布,李健教授和张信华教授带来深度解读
前言
美国临床肿瘤学会(ASCO)年会是肿瘤领域最具影响力的国际学术盛会之一,吸引着全球顶尖肿瘤专家汇聚一堂,分享最新的研究成果。2023年ASCO年会于6月2日至6日在美国芝加哥以及线上同步举行,备受瞩目。在此次年会上,阿伐替尼 治疗晚期胃肠间质瘤(GIST)的两项最新研究数据重磅公布,包括一项研究入选壁报讨论,一项研究以壁报形式展示,阿伐替尼治疗KIT外显子17/18突变、KIT外显子9突变,联合舒尼替尼
治疗晚期胃肠间质瘤(GIST)的两项最新研究数据重磅公布,包括一项研究入选壁报讨论,一项研究以壁报形式展示,阿伐替尼治疗KIT外显子17/18突变、KIT外显子9突变,联合舒尼替尼 治疗多线耐药后难治性GIST患者,疗效数据令人惊喜。我们特邀北京大学肿瘤医院李健教授和中山大学附属第一医院张信华教授,深度解读研究数据。
治疗多线耐药后难治性GIST患者,疗效数据令人惊喜。我们特邀北京大学肿瘤医院李健教授和中山大学附属第一医院张信华教授,深度解读研究数据。
阿伐替尼治疗不同KIT突变GIST的临床疗效:1期NAVIGATOR和1/2期CS3007-101研究的事后分析[1]

背景
目前针对不可切除/转移性GIST患者,靶向KIT/PDGFRA的酪氨酸激酶抑制剂(TKI)是标准治疗方案。然而,已获批的TKI在≥2线GIST治疗中疗效有限,并且因基因突变类型而异。因此,基于基因突变类型选择治疗方案的精准治疗模式,有望提升患者的获益。阿伐替尼(AVA)是一种高选择性的KIT/PDGFRA抑制剂,已被批准用于治疗PDGFRA外显子18突变GIST患者,并已证明对KIT活化环(AL)和KIT外显子9突变具有临床前活性。为了证明阿伐替尼对不同KIT突变类型的GIST患者的疗效,本研究对1期NAVIGATOR(NCT02508532)和1/2期中国桥接试验(NCT04254939;CS3007-101)中接受阿伐替尼治疗的KIT突变GIST患者进行了事后分析。
研究设计和患者
所有携带KIT突变(不携带PDGFRA突变)的GIST患者均接受阿伐替尼治疗(300mg QD)。基线时分析肿瘤组织和/或血浆ctDNA以明确肿瘤KIT突变情况。患者分为两组:携带KIT AL(外显子17/18)突变且无KIT ATP结合口袋(ABP;外显子13/14)突变的患者(KIT ALposABPneg组)vs 所有携带其他KIT突变的患者(KIT OTHERS组)。分别采用Cox和logistic回归分析比较无进展生存期(PFS)和客观缓解率(ORR)。
结果
共160例患者纳入此次事后分析,中位随访22.0个月(0.5~39.0个月)。其中男性63.8%,白种人56.9%,基线转移患者96.9%,61.3%的患者接受过≥3线TKI治疗。KIT AL突变的发生率高于KIT ABP突变(46.3% vs 21.3%)。
抗肿瘤活性
•KIT ALposABPneg组的未校正ORR显著高于KIT OTHERS组(26.7% vs 12.0%;P=0.0185)(图1);疾病控制率(DCR)也更高。这一结果在进行IPWBL校正后也得到了证实(ORR 31.4% vs 12.1%;P=0.0047)。
•与接受其他线治疗的患者相比,接受阿伐替尼2线治疗患者的ORR数值上更高(38.5%)。
•接受阿伐替尼≥2线治疗,中国患者的ORR数值上高于非中国患者(36.4% vs 24.5%,P=0.4244)。
•KIT外显子9突变GIST患者接受阿伐替尼≥4L治疗,观察到有意义的抗肿瘤活性(表1)。
表1 肿瘤缓解数据
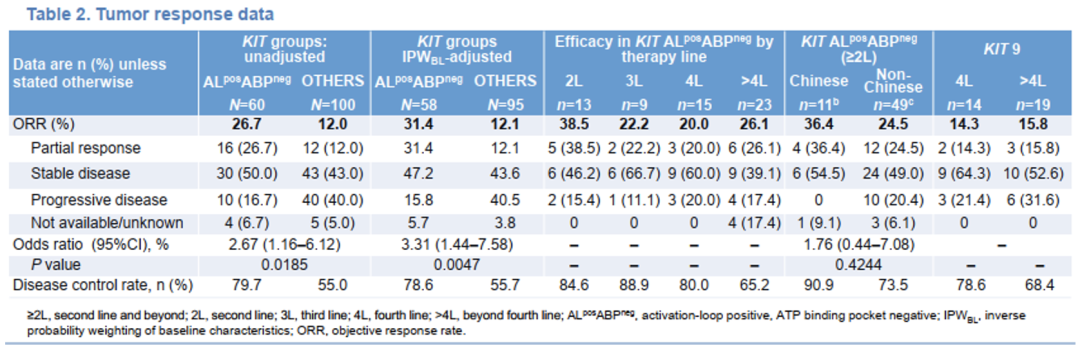
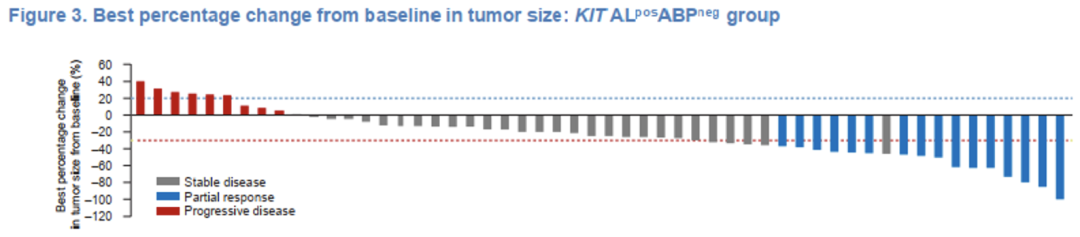
图1 KIT ALposABPneg组靶病灶较基线变化
无进展生存期(PFS)
•KIT ALposABPneg组未校正和IPWBL校正后的mPFS均显著高于KIT OTHERS组(未校正9.1 vs 3.5个月,P=0.0002;IPWBL校正后9.1 vs 3.4个月,P<0.0001)。
•KIT ALposABPneg组患者接受阿伐替尼2线治疗mPFS长达19.3个月。
•KIT外显子9突变患者接受阿伐替尼≥4线治疗观察到有临床意义的PFS获益(4线5.6个月,>4线3.7个月,图2)。KIT外显子9突变合并KIT ALposABPneg患者接受阿伐替尼≥4线治疗,mPFS为7.2个月。
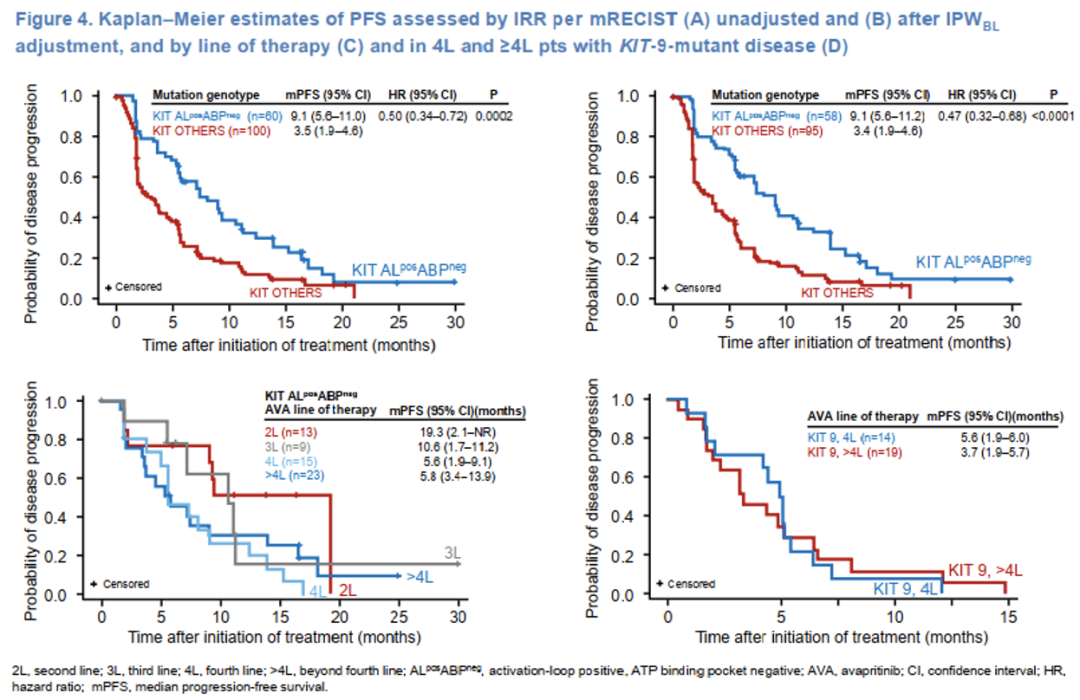
图2 PFS生存曲线
结论
•阿伐替尼对携带KIT ALposABPneg突变的GIST患者对比携带其他KIT突变的患者显示出更强的抗肿瘤活性。
•阿伐替尼是KIT ALposABPneg突变GIST患者的有前景的二线治疗选择,并有潜力成为KIT外显子9突变GIST患者后线(≥4L)治疗选择。
•阿伐替尼可以为携带特定类型KIT突变的GIST患者带来有意义的临床获益,特别是对携带KIT-AL突变或KIT外显子9突变的患者。
壁报讨论环节
Margaret von Mehren教授引导发言:
•对于特定突变型的患者,TKI治疗的顺序可能会影响患者结局。
•该研究还提出了一个问题,那就是阿伐替尼在KIT突变GIST治疗中扮演的角色是怎样的。VOYAGE研究(NCT03465722)表明,ATP结合区突变与阿伐替尼治疗效果不佳相关。此次事后分析发现,AL突变和KIT外显子9突变与阿伐替尼疗效获益相关。
•既往GIST患者的临床治疗主要基于获批的序贯治疗方案,而不太考虑突变型等因素。然而,现有数据表明,应该考虑通过ctDNA检测得出的突变谱来指导治疗。
•在此基础上,GIST诊疗还面临着持续的挑战。一方面是用现有的TKl药物治疗多克隆耐药亚群,已经有III期随机临床试验(NCT05208047)评估Bezuclastinib联合舒尼替尼对比舒尼替尼单药在GIST患者中的效果。此外,还需要确定KIT/PDGFRA以外的晚期GIST靶点及生物标志物,以及探索免疫治疗在GIST中的作用。
壁报作者讨论环节
Q1:ctDNA目前在临床实践中的使用情况如何,未来预期有哪些用途?
Jonathan C.Trent教授介绍了迈阿密希尔维斯特医学中心的情况。他表示,在本中心目前只会对疾病进展的患者进行ctDNA检测。在这种情况下,目前接受ctDNA检测的患者占比约为80%。约有三分之二的患者存在KIT外显子17耐药突变,约三分之一的患者存在外显子13突变。目前,尽管我们对ctDNA很感兴趣,但并没有在临床上将其作为常规检测,因为还没有获得前瞻性的循证依据。如果能够取得前瞻性的支持性结果,将可能重新定义治疗路线。Robin Lewis Jones教授和Michael C.Heinrich教授表示,ctDNA检测并没有在临床实践中常规应用,期待更多的前瞻性数据产出。
Q2:考虑到晚期GIST患者可能会同时携带多种基因突变,以及异质性,对于同时携带KIT13/14/17/18的患者,应该如何选择方案?
Jonathan C.Trent教授表示这种情况并非罕见,既往临床检测过的患者中可能有10%会同时存在ATP结合口袋(外显子13和14)和活化环(外显子17和18)两种类型的突变。随着时间的推移、经历多种治疗之后,这一百分比还会持续增加。未来希望通过COGENT、PEAK等研究,对这一方面展开探索。
Margaret von Mehren教授表示,随着我们对TKI耐药的了解越来越深入,相关机制也变得越来越复杂。我们需要在这些突变中寻找关键点,未来可能会考虑将与之相关的信号通路作为新的靶点研究方向。已经有临床前研究在针对KIT之外的其他靶点进行探索,比如MEK抑制剂等其他重要通路。
Robin Lewis Jones教授赞同在这类患者中需要考虑其他的治疗组合和其他的耐药途径。Michael C.Heinrich教授则表示生物标志物的重要性仍然需要强调。ctDNA检测在GIST中,仍然存在部分患者即使肿瘤体积很大,ctDNA仍无法检出的情况。但一时无法检出不代表一直无法检出,在间隔一段时间后重复检测,也许会有不同的结果。总体而言,我们还是将其作为筛选患者的一种方式,为治疗决策提供一些指导。可能存在其他耐药突变产生非预期的影响,但仍然需要重视ctDNA的检测,并在未来开展更多前瞻性研究,覆盖更多治疗线和更复杂的治疗选择。
同时,几位教授也就采用ctDNA结果预测疾病风险、支付和仿制药使用、TKI药物剂量以及现有TKI药物对患者疾病治愈的意义等问题进行了精彩探讨。
阿伐替尼联合舒尼替尼用于标准治疗失败的难治性GIST患者,一项前瞻性队列研究[2]

背景
目前对于多线TKI治疗失败后的难治性GIST,尚无标准治疗方案,联合应用TKI可能是一种有效的治疗选择。本研究旨在探讨阿伐替尼联合舒尼替尼治疗难治性GIST患者的疗效和安全性。
方法
这是一项前瞻性队列研究,也是真实世界研究(NCT05461664)的一部分。从2022年1月至2023年1月,患者接受阿伐替尼(100~200mg QD)联合舒尼替尼(25~37.5mg QD)治疗,28d为1个周期,直至疾病进展(PD)或停药。评价临床疗效,包括ORR、生存期和安全性。
结果
研究共纳入11例患者,中位年龄57岁。中位随访4.1个月(1.4~12.8个月)。靶病灶直径6.6~47.0cm,中位直径28.2cm。KIT外显子11突变患者4例,外显子9突变6例,外显子17突变1例;继发外显子13突变2例,外显子14突变1例,外显子16突变2例,外显子17突变7例。7例患者既往接受过4线以上TKI治疗,3例接受过3线TKI治疗,1例接受过2线TKI治疗。
根据mRECIST 1.1标准,研究中1例(9.1%)患者获得部分缓解(PR),病灶缩小48.7%;9例(81.8%)患者获得疾病稳定(SD),其中8例患者获得肿瘤缩小(病灶中位缩小20.8%)(图3),1例(9.1%)患者发生PD。
根据Choi标准标准,8例(72.8%)PR,1例(9.1%)SD,2例(18.2%)PD(表2)。截至末次随访,4例PD,1例退出研究,1例术后停止治疗。5例患者仍在治疗中,1例7线治疗1年以上,病灶缩小26.3%。PFS和OS数据尚未成熟。在KIT AL突变GIST患者中,ORR改善,病灶缩小,但无显著统计学差异。
表2 阿伐替尼联合舒尼替尼治疗难治性GIST的疗效数据
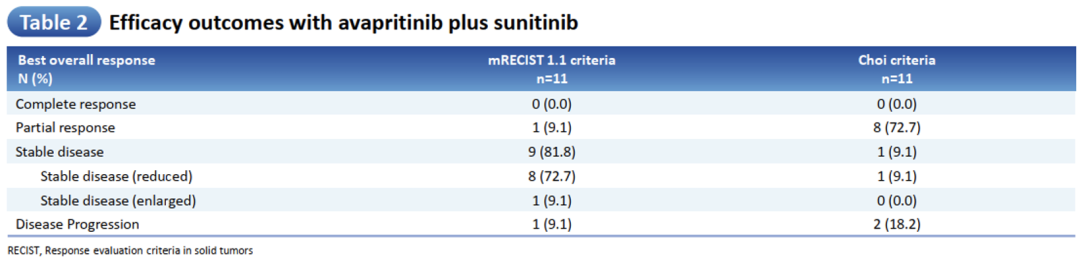
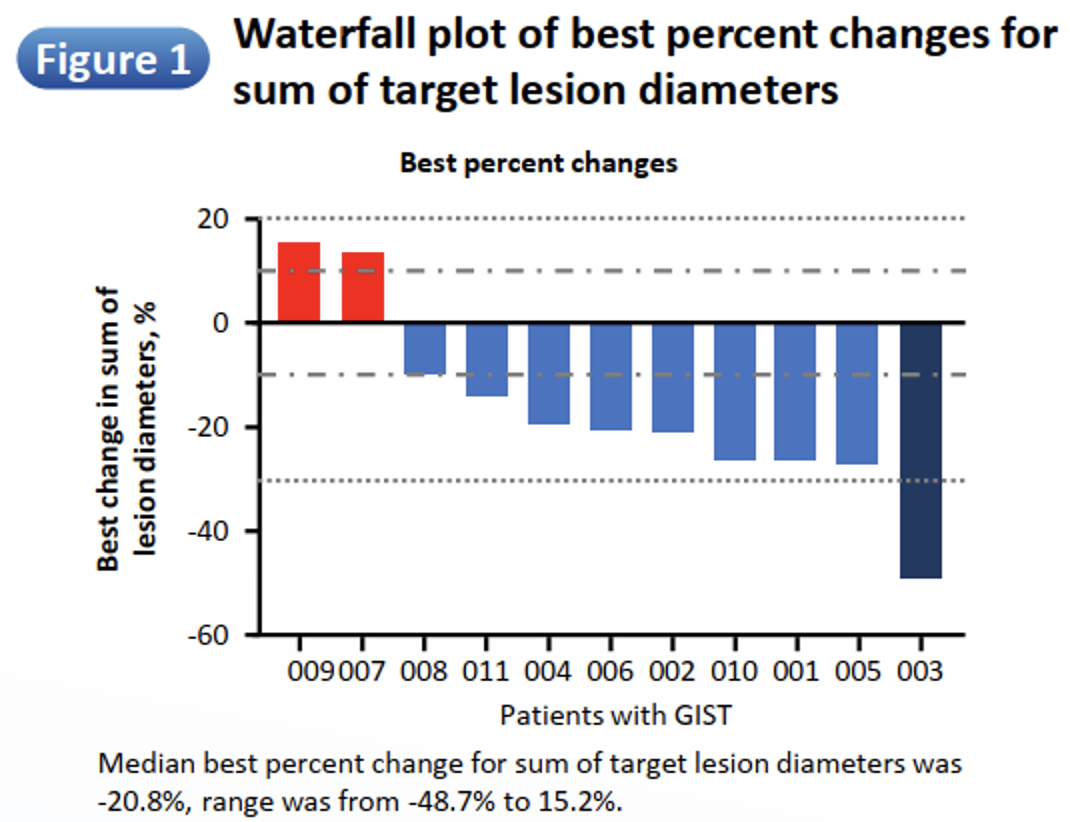
图3 靶病灶直径变化
阿伐替尼(100~150mg/d)和舒尼替尼(25~37.5mg/d)剂量均可耐受。常见的不良反应为贫血 、白细胞减少、腹泻
、白细胞减少、腹泻 、乏力、眶周和面部水肿
、乏力、眶周和面部水肿 、记忆力下降。常见的≥3级不良事件包括贫血(54.5%)、白细胞减少(36.4%)、腹泻(36.4%)、肿瘤出血(27.3%)和消化道出血
、记忆力下降。常见的≥3级不良事件包括贫血(54.5%)、白细胞减少(36.4%)、腹泻(36.4%)、肿瘤出血(27.3%)和消化道出血 (18.2%)。
(18.2%)。
结论
研究的初步结果表明,阿伐替尼联合舒尼替尼治疗难治性GIST可带来显著的临床获益,显著缩瘤,特别是对于携带KIT AL继发性突变的GIST。还需要进一步研究来确定这两种靶向药物的最佳给药方案。
专家点评
针对晚期胃肠间质瘤(GIST),既往主要采用分线治疗。PDGFRA或KIT突变是GIST的主要发病机制,但针对PDGFRA外显子18突变GIST的治疗,II型TKI的疗效有限。阿伐替尼作为中国GIST治疗领域目前唯一获批的I型TKI,可通过与激酶活性构象结合,高选择性强效抑制KIT/PDGFRA活化环突变,治疗PDGFRA 外显子18突变患者ORR高达86%(PDGFRA D842V突变患者91%)[3-4],打破了晚期GIST一线治疗领域分线治疗模式,开创并实现了基于基因突变类型选择药物的精准治疗模式,即PDGFRA外显子18突变GIST患者一线治疗优选阿伐替尼。
然而,目前晚期GIST二线、三线、四线治疗仍以分线治疗为主,已获批的II型TKI用于不同KIT突变晚期GIST的疗效不同,基于不同KIT突变类型选择合适的药物是未来的发展趋势。
本次ASCO年会上公布了1期NAVIGATOR和1/2期CS3007-101研究事后分析结果,发现接受阿伐替尼二线治疗的KIT外显子17/18(非外显子13/14)突变患者,ORR达到38.5%,80%以上的患者肿瘤缩小,mPFS长达19.3个月[1]。此外,针对四线标准治疗疗效不佳的KIT外显子9突变GIST患者,接受阿伐替尼治疗同样可以带来有意义的临床获益。这些结果表明,阿伐替尼不仅对PDGFRA外显子18活化环突变有强效抑制作用,在部分KIT突变的晚期GIST治疗中,阿伐替尼也具有潜在价值,尤其是2线治疗KIT外显子17/18(非外显子13/14)突变患者,以及≥4线治疗KIT外显子9突变患者。
虽然目前KIT继发性突变的检测面临挑战,如二次活检的可行性、继发突变的异质性、液体活检的一致性等,但这项研究为阿伐替尼在多种KIT突变晚期GIST患者中的应用提供了有力支持,提示阿伐替尼具有潜在价值和作用,值得进一步深入探索。未来的研究需要更加深入地探究阿伐替尼在不同突变类型GIST患者中的疗效,以实现更为精准的治疗。
专家点评
目前,多线治疗耐药后的难治性GIST仍然缺乏有效的治疗手段,联合使用I型TKI和II型TKI可能是一种潜在的治疗选择。已有研究显示,联合使用I型KIT抑制剂PLX9486和II型TKI舒尼替尼治疗难治性GIST具有优秀的临床缓解率和长时间缓解效果,mPFS 12.1个月,mOS 18.11月,且耐受性良好[5]。然而,I型TKI PLX9486尚未获批上市,临床不可及,因此中国GIST治疗领域目前唯一获批上市的I型TKI阿伐替尼成为不二之选,与舒尼替尼的联合应用有望成为难治性GIST的有效治疗方案。
I型TKI阿伐替尼对KIT活化环突变GIST具有强效抑制作用,而II型TKI舒尼替尼对KIT结合口袋突变表现出良好的抑制效果。这两种药物的机制互补,不良反应谱相对不重叠,因此具有潜在的联合治疗优势。
我们开展的这项前瞻性队列研究初步结果证实了阿伐替尼联合舒尼替尼这一联合方案的临床价值。研究结果显示,对于多线治疗失败的难治性GIST患者,联合使用阿伐替尼和舒尼替尼仍然可以取得显著的缩瘤效果,根据Choi标准,有72.8%的患者达到PR[2]。因此,这一联合方案有望成为难治性GIST患者的有效治疗选择。
当然,需要注意的是,多线治疗耐药后的GIST患者可能存在体力状况较差等问题,因此如何把握好联合方案的用药剂量、平衡好疗效和安全性,实现联合治疗的“高效低毒”,需要进一步探索和深入思考,以充分发挥联合治疗的优势,达到最佳治疗效果。


