
前献解泌第9期 | 郑伏甫教授与您共同探讨人工智能预测前列腺癌包膜外侵犯的可行性
聚前沿文献之声,解泌尿学术之惑,这里是聚焦前列腺癌 的《菲长视野 · 前献解泌》专栏。
的《菲长视野 · 前献解泌》专栏。
本期与我们用声音见面的是中山大学附属第一医院郑伏甫教授,他将与大家一同分享一项近日发表于《Lancet Digit Health》杂志(影响因子:30.8)的有关探索在前列腺癌利用人工智能预测肿瘤前列腺包膜外侵犯的临床研究。

研究背景
进行根治性前列腺切除术时保留临近的神经血管束可降低患者术后勃起功能障碍和尿失禁的风险,但也会增加手术切缘阳性、肿瘤复发的可能。准确预测单侧前列腺包膜外侵犯(side-specific extra-prostatic extension,ssEPE)对减轻局限性前列腺癌患者接受神经保留手术后出现的治疗相关不良反应(如阳痿、大小便失禁)意义重大[1]。
目前,已有多种列线图模型被开发用以预测ssEPE风险。随着人工智能(artificial intelligence,AI)在泌尿领域的发展深入,AI可以提供可靠且个性化的ssEPE预测,更好地为前列腺根治性切除术期间的神经保留提供信息。本研究的目的在于开发、外部验证并执行基于AI的ssEPE风险评估工具(Side-specific Extra-Prostatic Extension Risk Assessment,SEPERA)[1]。
研究方法
研究将患者的每一个前列腺叶视作1个单独的病例,因此每位患者为整体队列提供了2个病例。SEPERA基于2010-2020年来自社区医院的1022例的数据集进行开发,在来自3家医疗中心的3914个病例中进行验证。通过受试者工作特征曲线下面积(area under the receiver operating characteristic curve,AUROC)、Precision-Recall曲线下面积(area under the precision recall curve,AUPRC)、模型校准和净获益评估该模型性能,并与现有的预测工具进行比较。研究进行了算法稽查,以评估模型偏倚并确定预测误差中的常见患者特征。
研究结果
研究共纳入2468例患者,包含4936例病例(前列腺叶),ssEPE的发生率在18%-32%不等。有140例病例(2.8%)在活检良性的同时,存在病理性ssEPE。不同医疗中心术前磁共振成像 (magnetic resonance imaging,MRI)的使用率不同,从5%-100%不等。共36.1%(1782/4936)的病例接受了术前MRI检查,在468例病理性ssEPE病例中,仅64例被MRI检出(敏感性14%)。总体而言,术前MRI检出ssEPE的阳性预测值为54%。
(magnetic resonance imaging,MRI)的使用率不同,从5%-100%不等。共36.1%(1782/4936)的病例接受了术前MRI检查,在468例病理性ssEPE病例中,仅64例被MRI检出(敏感性14%)。总体而言,术前MRI检出ssEPE的阳性预测值为54%。
● SEPERA与其他列线图预测效能对比
在所有队列中,SEPERA的AUROC和AUPRC表现均优于现有的列线图(表1)。
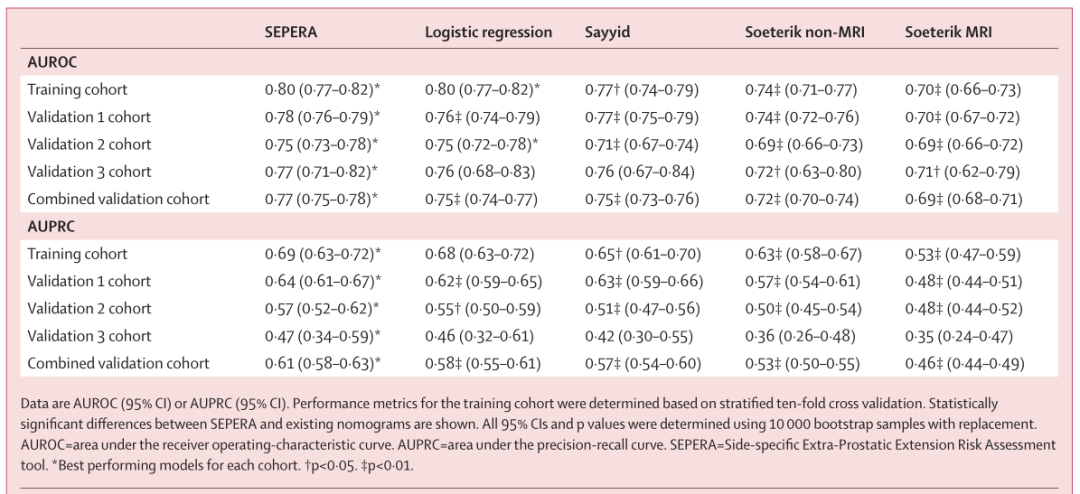
表1 不同模型基于AUROC和AUPRC的验证效能比较
在联合验证队列中,SEPERA的AUROC为0.77(95%CI 0.75-0.78),AUPRC为0.61(95%CI 0.58-0.63)。此外,SEPERA在验证队列中的校正效果也同样优于其他列线图(图1)。
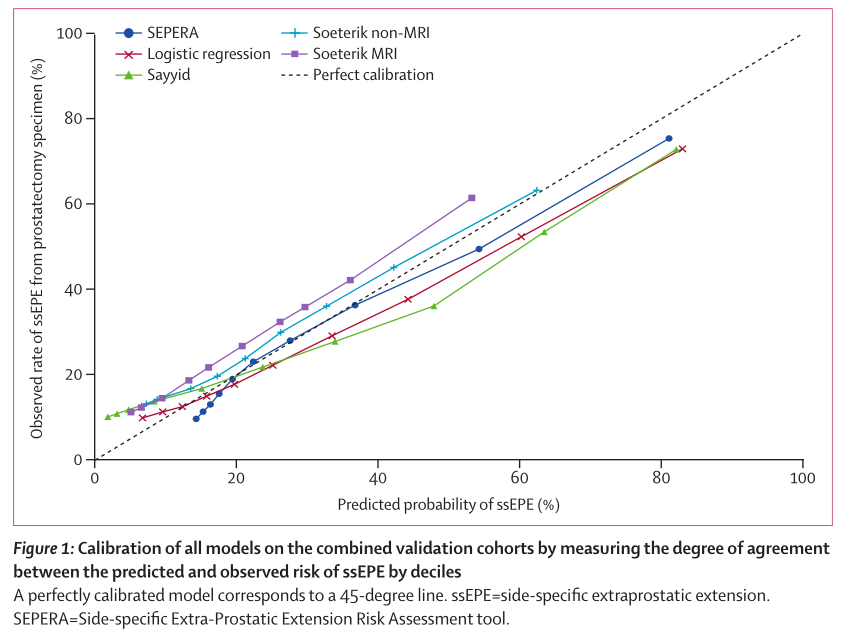
图1 通过评估ssEPE预测和观察风险之间的一致程度,对合并验证队列的所有模型进行校准
此外,研究者将MRI纳入模型后,MRI SEPERA的AUROC为0.72(95%CI 0.65-0.79),AUPRC为0.41(95%CI 0.31-0.54)。综合考虑下,研究者最终选择了SEPERA作为最终模型进行进一步分析。
● SEPERA的进一步验证
使用预先设定的阈值在开发队列中灵敏度达到了95%,SEPERA在联合验证队列中灵敏度达到了93%。在106例同侧活检阴性的病理性ssEPE病例中,SEPERA检出了其中72例(68%),而其他模型分别检出47例(44%,logistic回归模型)、0例(0%,Sayyid模型)、13例(12%,Soeterik非MRI模型)和5例(5%,Soeterik MRI模型)。
研究者使用决策曲线分析以帮助理解在临床实践中使用SEPERA的益处。总体而言,在临床相关阈值概率方面,SEPERA具有15%-30%的净获益,这意味着如果使用SEPERA而非其他列线图,会有更多患者可以安全地接受保留神经手术(图2)。
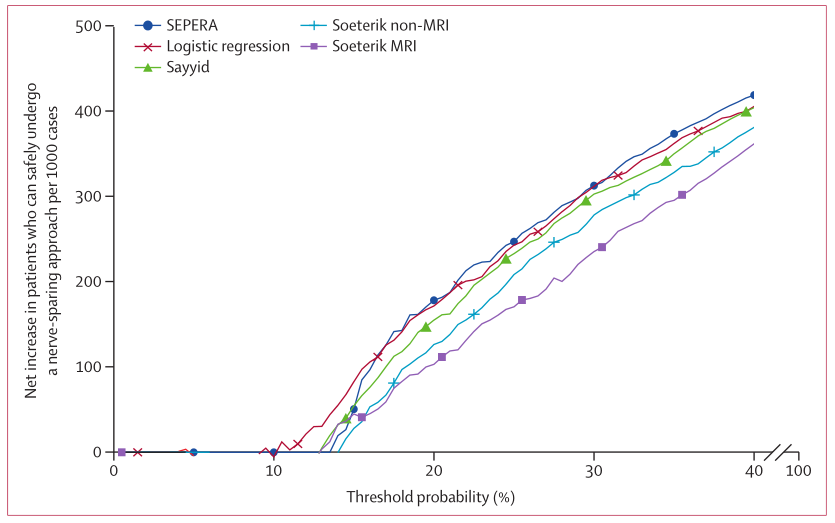
图2 联合验证队列的净获益(潜在临床影响)
研究者还对不同亚组病例进行分析,以评估SEPERA模型在临床相关亚组中的公平性。亚组分析结果显示,SEPERA在不同亚组病例中的AUROC水平无显著差异(图3)。
年龄亚组分析:<55岁为0.77,56-65岁为0.79,66-75岁为0.76,>75岁为0.73,p>0.086。
种族亚组分析:白人为0.77,黑人为0.74,拉美裔为0.80,亚洲裔为0.75,p>0.19。
活检年份亚组分析:2010年及之前为0.78,2011-2012年为0.74,2013-2014年为0.80,2015-2016年为0.77,2017-2018年为0.77,2019-2020年为0.76,p>0.13。
活检类型(仅系统性 vs. 系统性活检联合MRI靶向活检)亚组分析:仅系统性活检为0.74,系统性活检联合MRI靶向活检为0.74,p=0.91。
活检医院类型(教学医院 vs. 社区医院)亚组分析:社区医院为0.77,教学医院为0.78,p=0.76。
D’Amico风险组亚组分析:低危组为0.74,中危组为0.75,高危组为0.79,p>0.051。
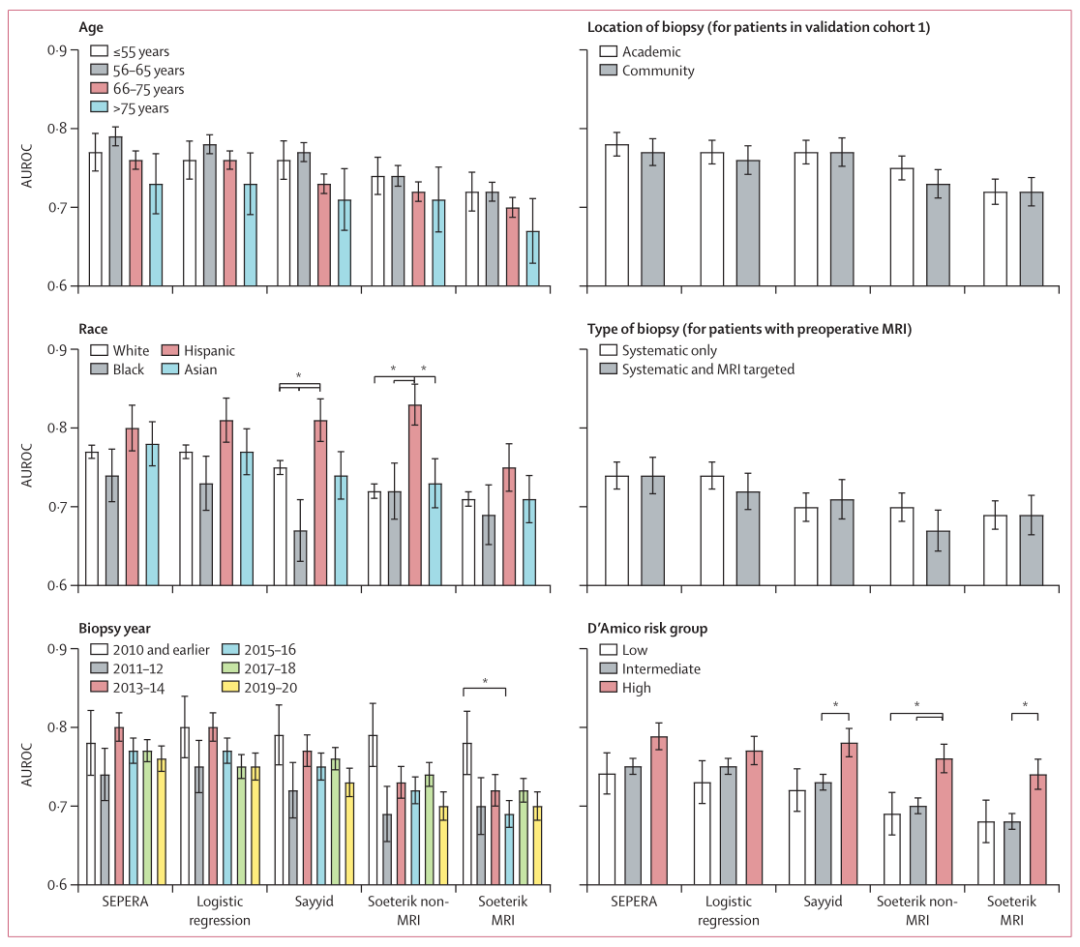
图3 不同模型在各病例亚组中的AUROC
研究结论
SEPERA预测ssEPE的净获益高于其他模型,使更多患者能够安全接受保留神经的手术。在算法稽查中,未观察到SEPERA模型偏倚的证据,当按种族、接受活检的年份、年龄、活检类型、进行活检的医院类型和D’Amico风险组分层时,AUROC无显著差异。根据审计,最常见的错误是假阳性,特别是对于高危前列腺癌的老年患者。在假阴性病例中未发现侵袭性前列腺癌(即ISUP> 2级或高危前列腺癌)。
专家有话说
随着人工智能技术在医学领域的广泛应用,其在前列腺癌的精确诊断和治疗方面发挥了重要作用。根据该项研究,对于接受根治性前列腺切除术的患者,术前通过基于AI的SEPERA精确预测ssEPE对于制定手术中的神经保留策略至关重要。作为泌尿外科医生,我们希望能在手术前准确评估前列腺癌包膜外侵犯,选择合适的手术方案,以期更好地改善患者的泌尿功能,降低尿潴留风险,缓解排尿困难和等待排尿的症状,从而提高患者术后的生活质量。因此,这项研究的发现对我们的临床实践具有重要意义。
然而,在临床实践中,许多患者在确诊时已处于晚期或转移期,预后不佳。对于这部分无法手术的患者,以促性腺激素释放激素激动剂(gonadotropin releasing hormone agonist,GnRH-a)为代表的雄激素剥夺治疗(androgen deprivation therapy,ADT)是主要的治疗方案,可以显著改善患者的预后,延长患者生存期,提高患者生活质量。这就要求医生在处方决策时须兼顾治疗的有效性、药物安全性以及用药便利性等多重因素。
今年6月,曲普瑞林 的6月剂型在中国获批,为前列腺癌患者提供了1月、3月及6月三种剂型的选择。德国一项前瞻性、非干预、多中心研究,纳入608例晚期前列腺癌患者,结果显示,接受曲普瑞林6月剂型治疗12个月后,约四分之一的患者生活质量评分提高[2]。此外,根据欧洲一项对402例接受GnRH-a治疗的前列腺癌患者调查,大多数患者(60%)更喜欢GnRH-a 6月剂型,注射便利性、改善生活质量和减少注射次数是选择的主要原因[3]。因此,曲普瑞林6月剂型不仅提高了患者的治疗依从性,也大大改善了他们的生活质量。
的6月剂型在中国获批,为前列腺癌患者提供了1月、3月及6月三种剂型的选择。德国一项前瞻性、非干预、多中心研究,纳入608例晚期前列腺癌患者,结果显示,接受曲普瑞林6月剂型治疗12个月后,约四分之一的患者生活质量评分提高[2]。此外,根据欧洲一项对402例接受GnRH-a治疗的前列腺癌患者调查,大多数患者(60%)更喜欢GnRH-a 6月剂型,注射便利性、改善生活质量和减少注射次数是选择的主要原因[3]。因此,曲普瑞林6月剂型不仅提高了患者的治疗依从性,也大大改善了他们的生活质量。
更重要的是,曲普瑞林6月剂型可持续强效降低患者前列腺特异性抗原 (prostate specific antigen,PSA),同时也可以使患者达到深度降酮(睾酮
(prostate specific antigen,PSA),同时也可以使患者达到深度降酮(睾酮 < 20 ng/dl)。一项前瞻性、开放标签、多中心、单臂、III期研究,322例局部晚期或转移性前列腺癌患者接受曲普瑞林6月剂型治疗。结果显示,在基线时患者中位PSA水平为45.5 ng/ml,中位睾酮水平为329 ng/dl;经曲普瑞林6月剂型治疗1、3和6个月后,中位PSA水平分别可降低至8.3、1.8和1.2 ng/ml,中位睾酮水平分别可降低至15、10和12 ng/dl[4]。
< 20 ng/dl)。一项前瞻性、开放标签、多中心、单臂、III期研究,322例局部晚期或转移性前列腺癌患者接受曲普瑞林6月剂型治疗。结果显示,在基线时患者中位PSA水平为45.5 ng/ml,中位睾酮水平为329 ng/dl;经曲普瑞林6月剂型治疗1、3和6个月后,中位PSA水平分别可降低至8.3、1.8和1.2 ng/ml,中位睾酮水平分别可降低至15、10和12 ng/dl[4]。
综上,曲普瑞林6月剂型在为前列腺癌患者长期强效降低PSA和深度降酮的同时,还可以提高患者生活质量,提高患者治疗依从性,有助于为患者实现“前列腺癌慢病化”的长期管理目标。相信未来曲普瑞林6月剂型将在中国前列腺癌诊疗事业中发挥更大的作用,为中国前列腺癌患者的健康和福祉保驾护航。
专家简介

郑伏甫 教授
中山大学附属第一医院
主任医师 博士生导师 博士后合作导师
哈佛大学麻省总医院 访问学者
美国泌尿外科学会(AUA) 国际会员
中国医疗保健国际交流促进会泌尿生殖分会 委员
广东省医学会泌尿外科分会前列腺学组 副组长
广东省医师协会泌尿外科分会 委员
广东省抗癌协会泌尿生殖肿瘤专委会 委员
广东省中西医结合学会泌尿外科分会 常委
广东省泌尿生殖协会肿瘤分会 常委
泌尿外科杂志(电子版) 常务编委
中华实验外科杂志 审稿专家
DIP-CN-011964

